下列说法不正确的是
| A.对于有气体参加的反应增大压强能提高单位体积内活化分子数 |
| B.升高温度增大了活化分子百分数 |
| C.催化剂能够改变化学反应途径 |
| D.具有较高能量的反应物分子一定能发生有效碰撞 |
更新时间:2020-08-31 17:23:21
|
相似题推荐
单选题
|
较易
(0.85)
解题方法
【推荐1】已知
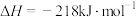 。该反应分两步完成:
。该反应分两步完成:
慢反应①: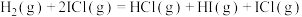

快反应②: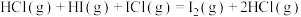

下列示意图能正确表示反应过程中能量变化的是

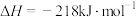 。该反应分两步完成:
。该反应分两步完成:慢反应①:
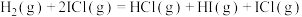

快反应②:
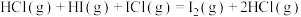

下列示意图能正确表示反应过程中能量变化的是
A.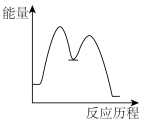 | B.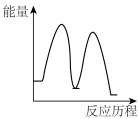 | C.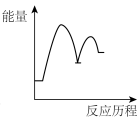 | D. |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】对于有气体参加的反应,一定能使化学反应速率加快的因素是
①扩大容器的容积 ②使用催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容积 ⑥充入稀有气体增大容器内的压强
①扩大容器的容积 ②使用催化剂 ③增加反应物的物质的量 ④升高温度 ⑤缩小容积 ⑥充入稀有气体增大容器内的压强
| A.②③ | B.②③④⑥ | C.②④⑤ | D.②④ |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】某反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
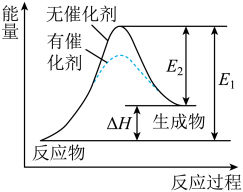

| A.该反应为放热反应 |
| B.催化剂能同时改变该反应的活化能和焓变 |
| C.使用催化剂能同时提高正逆反应速率 |
| D.该反应的ΔH=E2-E1 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】PtNiFe—LDHGO催化甲醛氧化的反应机理如图:
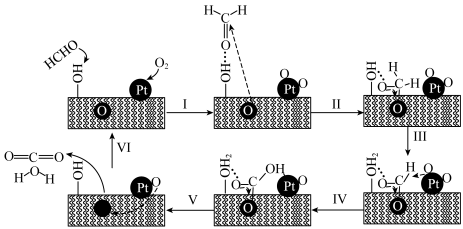
A.步骤Ⅰ中甲醛通过氢键吸附在催化剂表面的 上 上 |
| B.上述反应机理涉及极性键和非极性键的形成 |
C.该反应每生成1 mol ,转移电子的数目约为 ,转移电子的数目约为 |
| D.PtNiFe—LDHGO降低了该反应的活化能 |
您最近一年使用:0次



