A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO 、SO
、SO 、Cl-、CO
、Cl-、CO 中的某一种。①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。②若向①的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。根据①、②实验事实请完成以下问题:
中的某一种。①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。②若向①的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。根据①、②实验事实请完成以下问题:
(1)推断它们的化学式为:A.______ B.______ C.______ D.______
(2)并写出第②中盐酸与B盐溶液有沉淀产生的离子方程式______ ;盐酸与D盐溶液有无色无味气体逸出的离子方程式______ 。
 、SO
、SO 、Cl-、CO
、Cl-、CO 中的某一种。①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。②若向①的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。根据①、②实验事实请完成以下问题:
中的某一种。①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。②若向①的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。根据①、②实验事实请完成以下问题:(1)推断它们的化学式为:A.
(2)并写出第②中盐酸与B盐溶液有沉淀产生的离子方程式
19-20高一·全国·单元测试 查看更多[2]
更新时间:2020-09-02 10:52:10
|
相似题推荐
解答题-无机推断题
|
较易
(0.85)
【推荐1】某同学利用Fe、CuO、H2SO4制备CuSO4,制备路线及相关物质之间的转化关系如图所示。
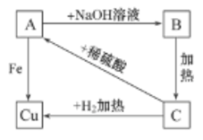
回答下列问题:
(1)写出A、B、C的化学式:A________ 、B_________ 、C________ 。
(2)写出有关反应的离子方程式:A→B__________ ;A→Cu__________ ;C→A__________ ;

回答下列问题:
(1)写出A、B、C的化学式:A
(2)写出有关反应的离子方程式:A→B
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】以高铁脱硫渣(主要成分为Fe2O3、Fe3O4、Al2O3等)为原料,可制备高纯度七水合硫酸亚铁(FeSO4•7H2O)和草酸亚铁晶体(FeC2O4•2H2O)。
(1)制备高纯硫酸亚铁晶体
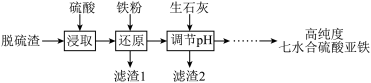
如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算)。
①“浸取”中Fe3O4发生反应的离子方程式为____ 。实验表明,“浸取”中所用硫酸浓度不宜过高,其原因可能是____ 。
②用生石灰调节溶液pH约5.0,所得“滤渣2”的主要成分为____ (填化学式)。
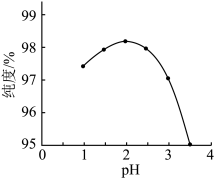
③获得高纯度七水合硫酸亚铁晶体前须要在硫酸亚铁溶液中先用硫酸调节pH,实验测得其他条件相同时溶液pH对产品纯度的影响如图所示,当pH>2.0时,硫酸亚铁晶体纯度下降的原因是____ 。
(2)制备高纯草酸亚铁晶体
实验方案:将一定量的高纯度七水合硫酸亚铁晶体溶于水配成溶液,在搅拌条件下将氨水加入上述纯净硫酸亚铁溶液中,____ (实验中还须使用的试剂有:草酸溶液,水,氯化钡溶液)。已知:草酸亚铁晶体难溶于水,受热易分解。
(1)制备高纯硫酸亚铁晶体

如表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol·L-1计算)。
| 金属 | 离子开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.9 | 3.2 |
| Al3+ | 3.4 | 4.7 |
| Fe2+ | 7.0 | 9.0 |
②用生石灰调节溶液pH约5.0,所得“滤渣2”的主要成分为
③获得高纯度七水合硫酸亚铁晶体前须要在硫酸亚铁溶液中先用硫酸调节pH,实验测得其他条件相同时溶液pH对产品纯度的影响如图所示,当pH>2.0时,硫酸亚铁晶体纯度下降的原因是

(2)制备高纯草酸亚铁晶体
实验方案:将一定量的高纯度七水合硫酸亚铁晶体溶于水配成溶液,在搅拌条件下将氨水加入上述纯净硫酸亚铁溶液中,
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐3】实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案。请回答下列问题。
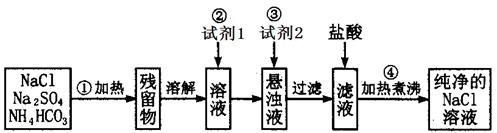
(1)操作①可选择__________ 仪器。
(2)试剂1为__________ (填化学式)。
(3)加入试剂2的目的________________ ,此时发生反应的离子方程式:______________ 。
(4)加入盐酸时,所发生反应的离子方程式:_________________________________ 。

(1)操作①可选择
(2)试剂1为
(3)加入试剂2的目的
(4)加入盐酸时,所发生反应的离子方程式:
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】某无色透明溶液中可能存在Ag+、Mg2+、Cu2+、Fe2+、Na+中的几种:
(1)不做任何实验就可以肯定原溶液中不存在的离子是______ (填离子符号,下同)。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中,肯定存在的离子是______ ,有关离子方程式为______ 。
(3)取(2)中的滤液,加入过量的稀氨水(NH3•H2O),出现白色沉淀,说明原溶液中肯定含有的离子是______ ,可能存在的离子是______ ,过程中发生的离子方程式有______ 。
(4)原溶液大量存在的阴离子可能是______ (填选项字母)。
A.Cl- B.NO C.CO
C.CO D.OH- E.SO
D.OH- E.SO
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中,肯定存在的离子是
(3)取(2)中的滤液,加入过量的稀氨水(NH3•H2O),出现白色沉淀,说明原溶液中肯定含有的离子是
(4)原溶液大量存在的阴离子可能是
A.Cl- B.NO
 C.CO
C.CO D.OH- E.SO
D.OH- E.SO
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐2】某无色透明溶液中可能大量存在Ag+、Mg2+、Fe3+、Na+、K+、Cl-、CO 、OH-和NO
、OH-和NO 中的几种,请填写下列空白:
中的几种,请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是_______ 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_______ ,有关的离子方程式_______ 。
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有_______ ,有关的离子方程式为_______ 。
(4)综上所述,原溶液中一定存在的离子有_______ ,可能存在的离子是_______ 。
 、OH-和NO
、OH-和NO 中的几种,请填写下列空白:
中的几种,请填写下列空白:(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有
(4)综上所述,原溶液中一定存在的离子有
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐3】现有X、Y、M、N四种化合物,已知它们的阳离子含有 、
、 、
、 、
、 ,阴离子含有
,阴离子含有 、
、 、
、 、
、 。现将它们分别配成
。现将它们分别配成 的溶液,常温下进行如下实验:
的溶液,常温下进行如下实验:
①溶液X、Y的焰色试验为黄色,溶液M的 ;
;
②盐溶液X和溶液Y混合,有气体生成;
③向溶液N中滴加溶液M,先出现白色沉淀,继续滴加,沉淀完全溶解;
④溶液Y和溶液N混合,既有气体生成,又有沉淀生成。
根据上述实验现象,回答下列问题:
(1)溶液Y显___________ (“酸”、“碱”或“中”)性。
(2)写出下列物质的化学式:X___________ 、M___________ 。
(3)实验②中,反应的离子方程式为___________ 。
(4)溶液X和溶液M混合,溶液显中性时,反应的离子方程式为___________ 。
(5)实验④中,反应的离子方程式为___________ 。
(6)设计实验方案检验溶液X中的阴离子___________ 。
 、
、 、
、 、
、 ,阴离子含有
,阴离子含有 、
、 、
、 、
、 。现将它们分别配成
。现将它们分别配成 的溶液,常温下进行如下实验:
的溶液,常温下进行如下实验:①溶液X、Y的焰色试验为黄色,溶液M的
 ;
;②盐溶液X和溶液Y混合,有气体生成;
③向溶液N中滴加溶液M,先出现白色沉淀,继续滴加,沉淀完全溶解;
④溶液Y和溶液N混合,既有气体生成,又有沉淀生成。
根据上述实验现象,回答下列问题:
(1)溶液Y显
(2)写出下列物质的化学式:X
(3)实验②中,反应的离子方程式为
(4)溶液X和溶液M混合,溶液显中性时,反应的离子方程式为
(5)实验④中,反应的离子方程式为
(6)设计实验方案检验溶液X中的阴离子
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】某无色溶液X,由 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种离子组成,取该溶液进行如下实验:
中的若干种离子组成,取该溶液进行如下实验:
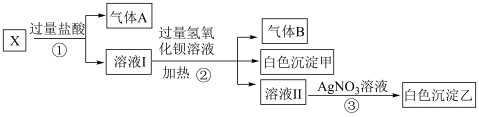
(1)白色沉淀甲是___________ 。
(2)试写出实验过程中生成气体A、B的离子方程式___________ 。
(3)通过上述实验,可确定X溶液中一定存在的离子是___________ ,一定不存在的离子是___________ ,可能存在的是___________ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种离子组成,取该溶液进行如下实验:
中的若干种离子组成,取该溶液进行如下实验:
(1)白色沉淀甲是
(2)试写出实验过程中生成气体A、B的离子方程式
(3)通过上述实验,可确定X溶液中一定存在的离子是
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】有一瓶 无色透明溶液,只含等物质的量的
无色透明溶液,只含等物质的量的 中的某几种,分别取两份
中的某几种,分别取两份 该溶液于试管Ⅰ、Ⅱ中,做如下实验:
该溶液于试管Ⅰ、Ⅱ中,做如下实验:
①实验一:试管Ⅰ中,加入少量锌粒,有气泡产生;
②实验二:试管Ⅱ中,加入足量的 ,产生白色沉淀,经过滤、洗涤、低温干燥,称量得固体
,产生白色沉淀,经过滤、洗涤、低温干燥,称量得固体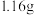 。
。
回答下列问题:
(1)仅通过观察就可以判断不存在的离子是_______ (用离子符号表示)。
(2)由实验一可知溶液中一定不含有的离子是_______ (用离子符号表示)。
(3)试管Ⅱ中生成白色沉淀的离子方程式为_______ 。
(4)根据上述实验,可以确定一定_______ (填“含有”或“不含”) ,理由是
,理由是_______ 。
(5)原溶液中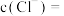
_______  。
。
 无色透明溶液,只含等物质的量的
无色透明溶液,只含等物质的量的 中的某几种,分别取两份
中的某几种,分别取两份 该溶液于试管Ⅰ、Ⅱ中,做如下实验:
该溶液于试管Ⅰ、Ⅱ中,做如下实验:①实验一:试管Ⅰ中,加入少量锌粒,有气泡产生;
②实验二:试管Ⅱ中,加入足量的
 ,产生白色沉淀,经过滤、洗涤、低温干燥,称量得固体
,产生白色沉淀,经过滤、洗涤、低温干燥,称量得固体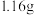 。
。回答下列问题:
(1)仅通过观察就可以判断不存在的离子是
(2)由实验一可知溶液中一定不含有的离子是
(3)试管Ⅱ中生成白色沉淀的离子方程式为
(4)根据上述实验,可以确定一定
 ,理由是
,理由是(5)原溶液中
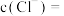
 。
。
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐3】A、B、C、D四种可溶性盐,其阳离子分别是Na+、Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO 、CO
、CO 、NO
、NO 中的某一种。现做以下实验:①将四种盐各取少量,分别溶于盛有5mL蒸馏水的4支试管中,只有C盐溶液呈蓝色。②分别向4支试管中加入2mL稀盐酸,发现D盐溶液中产生白色沉淀,A盐溶液中有较多气泡产生,而B盐溶液无明显现象。
中的某一种。现做以下实验:①将四种盐各取少量,分别溶于盛有5mL蒸馏水的4支试管中,只有C盐溶液呈蓝色。②分别向4支试管中加入2mL稀盐酸,发现D盐溶液中产生白色沉淀,A盐溶液中有较多气泡产生,而B盐溶液无明显现象。
(1)根据上述实验事实,推断这四种盐的化学式分别为:
A:______ ;B:______ ;C:______ ;D:_______ 。
(2)写出下列反应的离子方程式:
①A+足量盐酸→气体:________ 。
②B+C→:___________ 。
③B+D→:___________ 。
 、CO
、CO 、NO
、NO 中的某一种。现做以下实验:①将四种盐各取少量,分别溶于盛有5mL蒸馏水的4支试管中,只有C盐溶液呈蓝色。②分别向4支试管中加入2mL稀盐酸,发现D盐溶液中产生白色沉淀,A盐溶液中有较多气泡产生,而B盐溶液无明显现象。
中的某一种。现做以下实验:①将四种盐各取少量,分别溶于盛有5mL蒸馏水的4支试管中,只有C盐溶液呈蓝色。②分别向4支试管中加入2mL稀盐酸,发现D盐溶液中产生白色沉淀,A盐溶液中有较多气泡产生,而B盐溶液无明显现象。(1)根据上述实验事实,推断这四种盐的化学式分别为:
A:
(2)写出下列反应的离子方程式:
①A+足量盐酸→气体:
②B+C→:
③B+D→:
您最近半年使用:0次



