高铁酸钾(K2FeO4)是一种易溶于水,高效的多功能水处理剂。工业上通常先制得高铁酸钠,然后在一定温度下,向高铁酸钠溶液中加入KOH至饱和,从而使高铁酸钾析出。
(1)高铁酸钾与水反应生成O2、Fe(OH)3(胶体)和KOH。
①该反应的离子方程式为_______________________________ 。
②高铁酸钾作为水处理剂起到的作用是______________________________________ 。
(2)①在无水条件下制备高铁酸钠的主要反应为2FeSO4+aNa2O2=2Na2FeO4+bX+2Na2SO4+cO2↑,该反应中物质X的化学式为________ ,b与c的关系是________ 。
②一定温度下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,原因是___________________________________________________________________ 。
(3)在碱性条件下,由氯化铁、氯气可制备出高铁酸钾,写出该反应的离子方程式:____________________________________________________________________________ 。
(1)高铁酸钾与水反应生成O2、Fe(OH)3(胶体)和KOH。
①该反应的离子方程式为
②高铁酸钾作为水处理剂起到的作用是
(2)①在无水条件下制备高铁酸钠的主要反应为2FeSO4+aNa2O2=2Na2FeO4+bX+2Na2SO4+cO2↑,该反应中物质X的化学式为
②一定温度下,向高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,原因是
(3)在碱性条件下,由氯化铁、氯气可制备出高铁酸钾,写出该反应的离子方程式:
更新时间:2020-09-24 21:19:58
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)写出该反应的化学方程式_____________________________ ,反应中生成0.2 mol HNO3,转移的电子数目为_____________ 。
(2)NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是_____________________________ 。
(1)写出该反应的化学方程式
(2)NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】根据元素周期表中第三周期元素知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___________。
(2)原子最外层电子数与次外层中p能级电子数相同的元素名称是___________ ,原子核外电子总数是最外层电子数3倍的元素原子价电子排布式是___________ 。
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是___________ ;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
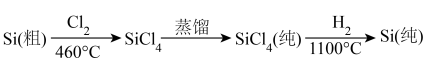
在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___________ 。
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:___________ 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___________。
| A.原子半径和简单离子半径均减小 | B.金属性减弱,非金属性增强 |
| C.氧化物对应的水化物碱性减弱,酸性增强 | D.单质的熔点降低 |
(2)原子最外层电子数与次外层中p能级电子数相同的元素名称是
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐极值为0.01mg/L。已知在酸性条件下有以下反应:
①2BrO +I2=2IO
+I2=2IO +Br2
+Br2
②2IO +10Br-+12H+=I2+5Br2+6H2O
+10Br-+12H+=I2+5Br2+6H2O
③5Br-+BrO +6H+=3Br2+3H2O
+6H+=3Br2+3H2O
请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由是:_______ 。
(2)现向含6mol的KI的硫酸溶液中逐滴滴加KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图的关系:

完成a→b阶段的反应方程式并配平:I-+BrO +H+→
+H+→_______ 。
(3)b→c阶段只有一种元素化合价发生了改变,反应中氧化产物和还原产物的质量之比为_______ 。
(4)a→b、b→c、c→d阶段的还原剂分别是_______ 、_______ 、_______ ,依次发生的这些反应,说明有关物质(I2、Br2、I-、Br-)还原性由强到弱的顺序是_______ 。
①2BrO
 +I2=2IO
+I2=2IO +Br2
+Br2②2IO
 +10Br-+12H+=I2+5Br2+6H2O
+10Br-+12H+=I2+5Br2+6H2O③5Br-+BrO
 +6H+=3Br2+3H2O
+6H+=3Br2+3H2O请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由是:
(2)现向含6mol的KI的硫酸溶液中逐滴滴加KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图的关系:

完成a→b阶段的反应方程式并配平:I-+BrO
 +H+→
+H+→(3)b→c阶段只有一种元素化合价发生了改变,反应中氧化产物和还原产物的质量之比为
(4)a→b、b→c、c→d阶段的还原剂分别是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】铁的重要化合物高铁酸钠 Na2FeO4 是一种新型净水剂,具有消毒能力强、安全性好等优点。
(1)高铁酸钠生产方法之一是 Fe+2NaOH+2H2O Na2FeO4+3H2↑,该反应中还原剂是
Na2FeO4+3H2↑,该反应中还原剂是 ____________ (填化学式,下同),还原产物是___________ 。
(2)高铁酸钠生产方法之二是2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O,用双线桥表示该反应的电子转移的方向和数目:___________ 。
(3)高铁酸钠在水中可以发生如下反应 4FeO +10H2O = 4Fe(OH)3(胶体)+8OH–+3O2 ↑。 由此看来,高铁酸钠能够杀菌消毒是因为它具有
+10H2O = 4Fe(OH)3(胶体)+8OH–+3O2 ↑。 由此看来,高铁酸钠能够杀菌消毒是因为它具有________________ 性,而能够除去水中悬浮物是因为____________________ 。
(1)高铁酸钠生产方法之一是 Fe+2NaOH+2H2O
 Na2FeO4+3H2↑,该反应中还原剂是
Na2FeO4+3H2↑,该反应中还原剂是 (2)高铁酸钠生产方法之二是2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O,用双线桥表示该反应的电子转移的方向和数目:
(3)高铁酸钠在水中可以发生如下反应 4FeO
 +10H2O = 4Fe(OH)3(胶体)+8OH–+3O2 ↑。 由此看来,高铁酸钠能够杀菌消毒是因为它具有
+10H2O = 4Fe(OH)3(胶体)+8OH–+3O2 ↑。 由此看来,高铁酸钠能够杀菌消毒是因为它具有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】高铁酸钠(Na2FeO4)是一种多功能新型水处理剂。
(1)Na2FeO4中铁元素的化合价是________ 价,Na2FeO4能给水消毒利用的是________ 性。
(2)用Na2FeO4代替氯气作净水消毒剂的优点是_________________________ ,在水处理过程中,形成Fe(OH)3胶体,使水中悬浮物聚沉,Fe(OH)3胶体中分散质粒子直径的范围是_______________ .
(3)工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,配平反应的离子方程式:______ Fe3++______ OH﹣+_____ ClO﹣=__ FeO42﹣+ _______ +____ Cl﹣,若反应过程中转移了0.5mol电子,则还原产物的物质的量为___________ mol。
(1)Na2FeO4中铁元素的化合价是
(2)用Na2FeO4代替氯气作净水消毒剂的优点是
(3)工业上可用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,配平反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】元素的价类二维图是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图。下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,回答下列问题:
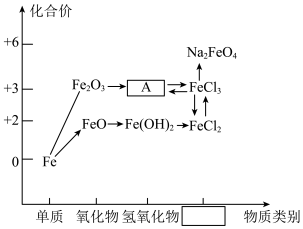
(1)上图横坐标方框中对应的物质类别是___________ ,物质A的颜色是___________ 。
(2)类比推理是学习和研究化学物质及其变化的一种常用的思维方法。下列推理正确的是___________。
(3)向沸水中滴加5~6滴FeCl3饱和溶液,继续煮沸,可制得A的胶体,写出该反应的化学方程式___________ 。向FeCl3溶液中加入NaClO和NaOH溶液,可制得新型绿色消毒剂高铁酸钠(Na2FeO4),相应的反应方程式如下:
 ,请用单线桥法标示出该反应中电子转移的方向和数目。
,请用单线桥法标示出该反应中电子转移的方向和数目。_________

(1)上图横坐标方框中对应的物质类别是
(2)类比推理是学习和研究化学物质及其变化的一种常用的思维方法。下列推理正确的是___________。
A.由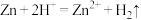 ,可推知 ,可推知 |
B.由 ,可推知 ,可推知 |
C.由 ,可推知 ,可推知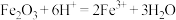 |
D.由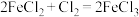 ,可推知 ,可推知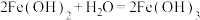 |
(3)向沸水中滴加5~6滴FeCl3饱和溶液,继续煮沸,可制得A的胶体,写出该反应的化学方程式
 ,请用单线桥法标示出该反应中电子转移的方向和数目。
,请用单线桥法标示出该反应中电子转移的方向和数目。
您最近一年使用:0次



