实验室常用浓硫酸的溶质质量分数为98%,密度为1.84 g·cm-3。
(1)此浓硫酸的物质的量浓度是_______________ 。
(2)配制480 mL 0.5 mol·L-1的硫酸,需以上浓硫酸_________ mL(精确到0.1位)。
(3)用浓硫酸配制该稀硫酸需要以下哪些步骤(按操作顺序填写序号):____________ 。
①计算 ②装瓶 ③量取一定体积的浓硫酸 ④洗涤
⑤移液 ⑥稀释 ⑦定容 ⑧摇匀
(4)某实验小组用0.55 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行反应热的测定。
①写出表示中和热的热化学方程式:__________________________ 。
②某实验小组取100 mL NaOH溶液和50 mL 硫酸溶液进行实验测定,计算出该反应的反应热ΔH=-53.5 kJ·mol-1,与-57.3 kJ·mol-1有偏差,产生偏差的原因不可能是_____ (填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请回答下列问题:
①判断滴定终点的方法是________________________________________ 。
②下列操作中可能使所测NaOH溶液的浓度数值偏低的是____ (填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
③某学生根据3次实验分别记录有关数据如表所示:
依据表中数据列式计算该NaOH溶液的物质的量浓度__________________ 。
(1)此浓硫酸的物质的量浓度是
(2)配制480 mL 0.5 mol·L-1的硫酸,需以上浓硫酸
(3)用浓硫酸配制该稀硫酸需要以下哪些步骤(按操作顺序填写序号):
①计算 ②装瓶 ③量取一定体积的浓硫酸 ④洗涤
⑤移液 ⑥稀释 ⑦定容 ⑧摇匀
(4)某实验小组用0.55 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行反应热的测定。
①写出表示中和热的热化学方程式:
②某实验小组取100 mL NaOH溶液和50 mL 硫酸溶液进行实验测定,计算出该反应的反应热ΔH=-53.5 kJ·mol-1,与-57.3 kJ·mol-1有偏差,产生偏差的原因不可能是
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。请回答下列问题:
①判断滴定终点的方法是
②下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
③某学生根据3次实验分别记录有关数据如表所示:
| 滴定次数 | 待测NaOH溶液的 体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
更新时间:2020-10-16 10:01:32
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】取0.55mol·L−1的NaOH溶液50mL与0.25mol·L−1的硫酸50mL置于下图所示的装置中进行中和热的测定实验,回答下列问题:
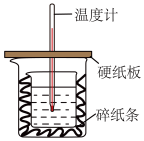
(1)从如图实验装置可知,缺少的一种仪器名称是________ 。
(2)若改用60mL0.25mol·L−1H2SO4和50mL0.55mol·L−1NaOH溶液进行反应,则比上述实验所放出的热量________ (填“多”或“少”)。
(3)写出用稀H2SO4和稀氢氧化钠溶液的反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol−1):_________ 。
(4)某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=_________ (结果保留一位小数)(已知稀溶液的比热容为4.18J/(g·℃),稀溶液的密度1g/cm3)。
(5)上述实验数值结果与57.3kJ·mol−1有偏差,产生偏差的原因可能是_________ 。
a.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
b.量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.实验装置保温、隔热效果差

(1)从如图实验装置可知,缺少的一种仪器名称是
(2)若改用60mL0.25mol·L−1H2SO4和50mL0.55mol·L−1NaOH溶液进行反应,则比上述实验所放出的热量
(3)写出用稀H2SO4和稀氢氧化钠溶液的反应表示中和热的热化学方程式(中和热数值为57.3kJ·mol−1):
(4)某学生实验记录数据如下:
实验 | 起始温度t1/℃ | 终止温度t2/℃ | |
序号 | 硫酸 | 氢氧化钠溶液 | 混合溶液 |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.4 | 20.6 | 23.6 |
(5)上述实验数值结果与57.3kJ·mol−1有偏差,产生偏差的原因可能是
a.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
b.量取硫酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.实验装置保温、隔热效果差
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.用如图所示的装置测定中和反应反应热。实验药品: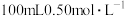 盐酸、
盐酸、 溶液、
溶液、 氨水。
氨水。

实验步骤:类似教材中实验
已知:弱碱电离时吸热。
请回答下列问题:
(1)从实验装置上看,还缺少_______ ;
(2)装置中隔热层的作用是_______ ;
(3)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各
的碱溶液各 混合(溶液密度均为
混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容 ,测得温度如下表:
,测得温度如下表:
① 两组实验结果存在差异的原因是_______ ;
②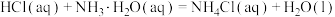 的
的
_______ (保留一位小数);
③ 某同学利用上述装置重新做甲组实验,测得反应热 偏大,可能的原因是
偏大,可能的原因是_______ (填序号)。
A.测完盐酸的温度计直接测NaOH溶液温度 B.杯盖未盖严
C.做该实验时室温较高 D.NaOH溶液一次性迅速倒入
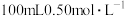 盐酸、
盐酸、 溶液、
溶液、 氨水。
氨水。
实验步骤:类似教材中实验
已知:弱碱电离时吸热。
请回答下列问题:
(1)从实验装置上看,还缺少
(2)装置中隔热层的作用是
(3)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各
的碱溶液各 混合(溶液密度均为
混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容 ,测得温度如下表:
,测得温度如下表:| 反应物 | 起始温度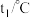 | 最高温度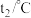 |
甲组 | 20.0 | 23.3 |
乙组 | 20.0 | 23.1 |
②
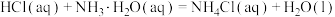 的
的
③ 某同学利用上述装置重新做甲组实验,测得反应热
 偏大,可能的原因是
偏大,可能的原因是A.测完盐酸的温度计直接测NaOH溶液温度 B.杯盖未盖严
C.做该实验时室温较高 D.NaOH溶液一次性迅速倒入
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】中和热的测定实验中取0.5 mol/L的NaOH溶液50 mL与0.25 mol/L的硫酸50 mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
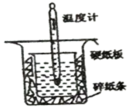
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是___ ,除此之外装置中的一个明显错误是___ 。
(2)若改用60 mL 0.25mol/LH2SO4和50 mL 0.55mol/LNaOH溶液进行反应与上述实验相比,所放出的热量_____ ( 填“相等”或“不相等”)。
(3)近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是l g/cm3,中和后生成溶液的比热c=4.18 J(g·℃),通过以上数据计算中和热△H=____ (结果保留小数点后一位)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)______ 。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把 NaOH溶液倒入盛有硫酸的小烧杯中

(1)从上图实验装置看,其中尚缺少的一种玻璃用品是
(2)若改用60 mL 0.25mol/LH2SO4和50 mL 0.55mol/LNaOH溶液进行反应与上述实验相比,所放出的热量
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把 NaOH溶液倒入盛有硫酸的小烧杯中
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某实验小组测定食醋的总酸量(g/100mL)的实验操作如下:
①用移液管量取10.00mL市售白醋样品,置于100mL容量瓶中,加水至刻度线,摇匀得待测食醋溶液。
②用移液管量取待测食醋溶液20.00mL于锥形瓶中,滴入2~3滴酸碱指示剂。
③把0.1000mol•L﹣1标准NaOH溶液装入碱式滴定管,静置后,读取并记录NaOH标准溶液体积的初读数。
④滴定,并记录NaOH标准溶液的终读数。重复滴定4次。所得实验数据如表一:
表一:
回答下列问题:
(1)滴定时,用___________ (填“左手”或“右手”)振荡锥形瓶,眼睛注视___________ 。
(2)该小组同学在滴定过程中使用pH计将溶液的pH变化情况记录如表二。
表二:
由表和图可知:在允许的误差范围(±0.1%)内,pH突变(滴定突跃)范围为___________ ,所以可选择___________ 作指示剂。
附:常见指示剂的变色范围
(3)经计算,该实验消耗标准NaOH溶液的体积为________ mL,样品总酸量为________ g/100mL。
(4)若在滴定过程中,所用的碱式滴定管水洗后,未用标准NaOH溶液润洗,会使所测结果___________ (填“偏低”、“偏高”或“无影响”,下同);若碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失会使所测结果___________ 。
①用移液管量取10.00mL市售白醋样品,置于100mL容量瓶中,加水至刻度线,摇匀得待测食醋溶液。
②用移液管量取待测食醋溶液20.00mL于锥形瓶中,滴入2~3滴酸碱指示剂。
③把0.1000mol•L﹣1标准NaOH溶液装入碱式滴定管,静置后,读取并记录NaOH标准溶液体积的初读数。
④滴定,并记录NaOH标准溶液的终读数。重复滴定4次。所得实验数据如表一:
表一:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
(1)滴定时,用
(2)该小组同学在滴定过程中使用pH计将溶液的pH变化情况记录如表二。
表二:
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 |
| 溶液pH | 2.88 | 4.70 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 |
附:常见指示剂的变色范围
| 指示剂 | 变色的范围(pH) |
| 甲基橙 | 3.1~4.4 |
| 石蕊 | 5.0~8.0 |
| 酚酞 | 8.2~10.0 |
(4)若在滴定过程中,所用的碱式滴定管水洗后,未用标准NaOH溶液润洗,会使所测结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某课外小组采用廉价原料NH4VO3、TiO2和Fe2O3,制出含VO2+、TiO2+和Fe3+的金属盐溶液,然后选择氨水作沉淀剂进行共沉淀反应,对共沉淀物[含VO(OH)2、Ti(OH)4、Fe(OH)3]进行煅烧还原制备合金样品,钒基固溶体合金是一类重要的贮氢材料。制备共沉淀物的装置如下图:_______ 、_______ 、_______ 。
(2)装置C中支管插入三颈烧瓶中的作用是_______ 。
(3)制备VO2+时,用草酸将 还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为
还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为_______ 。
(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是_______ 。
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是_______ 。
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是_______ 。
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol/L酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁的质量分数为_______ 。
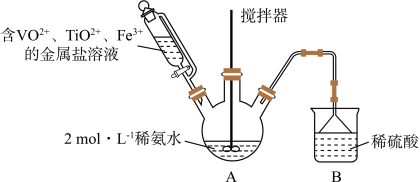
(2)装置C中支管插入三颈烧瓶中的作用是
(3)制备VO2+时,用草酸将
 还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为
还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol/L酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】滴定分析法是分析化学中常用方法之一,其中酸碱中和滴定是高中化学中最重要的定量实验之一。现实验室有一未知浓度的盐酸,利用酸碱中和滴定测定其物质的量浓度。
Ⅰ.一定物质的量浓度溶液的配制
需配制100mL0.1000mol•L-1NaOH溶液作标准溶液。具体步骤如图所示:
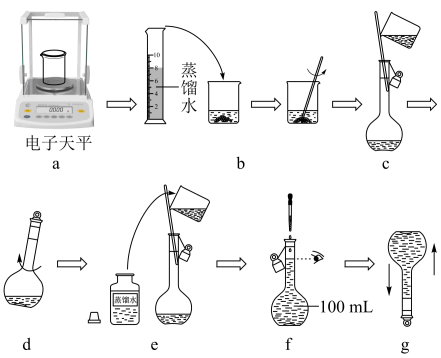
(1)流程中操作步骤c的名称为___ ,涉及的仪器有小烧杯、玻璃棒和___ 。
(2)流程中操作步骤d的目的是___ 。
Ⅱ.酸碱中和滴定
利用已配0.1000mol•L-1NaOH溶液滴定待测盐酸。
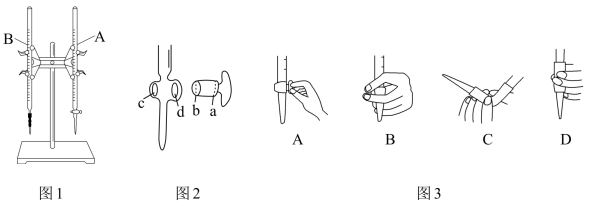
(3)滴定前,有关滴定管的正确操作为:___ 。
检漏→蒸馏水洗涤→(______)→(______)→(______)→(______)→(______)→(______)→后续操作。
A.记录起始读数
B.装入待装液至“0”刻度以上2~3cm处
C.调整滴定液液面至“0”刻度或“0”刻度以下
D.固定在滴定管夹上
E.排除管嘴气泡
F.用待装液润洗2至3次
①本实验中应该用图1中仪器___ (填“A”或“B”)装标准液,名称为___ 。
②如果滴定管A在检漏时发现下口旋塞处微量漏水,需涂抹凡士林。图2中,应将凡士林涂在旋塞的___ 端和旋塞套内的___ 端。
③滴定管B的管嘴有气泡时,图3中排气方式正确的是___ 。
(4)若用酚酞作指示剂,则判断滴定终点的方法是___ 。
(5)实验中做了4组平行实验,所得数据如表所示:
计算该盐酸的浓度c=___ mol•L-1(精确到小数点后4位)。
(6)下列操作会导致测定结果偏高的是___ (填字母)。
Ⅰ.一定物质的量浓度溶液的配制
需配制100mL0.1000mol•L-1NaOH溶液作标准溶液。具体步骤如图所示:

(1)流程中操作步骤c的名称为
(2)流程中操作步骤d的目的是
Ⅱ.酸碱中和滴定
利用已配0.1000mol•L-1NaOH溶液滴定待测盐酸。

(3)滴定前,有关滴定管的正确操作为:
检漏→蒸馏水洗涤→(______)→(______)→(______)→(______)→(______)→(______)→后续操作。
A.记录起始读数
B.装入待装液至“0”刻度以上2~3cm处
C.调整滴定液液面至“0”刻度或“0”刻度以下
D.固定在滴定管夹上
E.排除管嘴气泡
F.用待装液润洗2至3次
①本实验中应该用图1中仪器
②如果滴定管A在检漏时发现下口旋塞处微量漏水,需涂抹凡士林。图2中,应将凡士林涂在旋塞的
③滴定管B的管嘴有气泡时,图3中排气方式正确的是
(4)若用酚酞作指示剂,则判断滴定终点的方法是
(5)实验中做了4组平行实验,所得数据如表所示:
| 实验编号 | 盐酸待测液体积V/mL | NaOH标准液体积(消耗)V/mL |
| 1 | 25.00 | 18.05 |
| 2 | 25.00 | 18.95 |
| 3 | 25.00 | 17.95 |
| 4 | 25.00 | 18.00 |
(6)下列操作会导致测定结果偏高的是
| A.盛标准液的滴定管滴定前管嘴没有气泡,滴定后有气泡 |
| B.锥形瓶因有蒸馏水残留,进行润洗后盛装待测液 |
| C.NaOH溶液配制中,定容时仰视刻度 |
| D.盛待测液盐酸的滴定管未润洗 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】实验室欲配制480mL 0.5 mol·L-1的CuSO4溶液,据此回答下列问题:
(1)需称量胆矾CuSO4.5H2O______________ g。
(2)在配制的过程中一定不需要使用到的仪器是(填写代号)______ ,还缺少的仪器有____ 、_____ 。
A.烧杯 B.药匙 C.玻璃棒 D.1000mL容量瓶 E.锥形瓶 F.胶头滴管
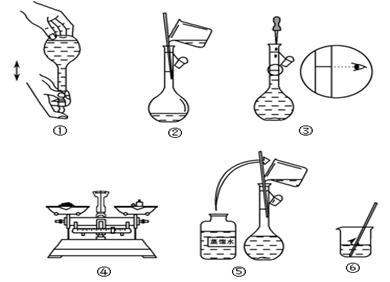
(3)下图所示的实验操作的先后顺序为________________
(4)玻璃棒在溶液配制中的作用:_________________________________ 。
(5)从配制好的CuSO4溶液中取出10mL,将这10mL的CuSO4溶液稀释至100mL,稀释后CuSO4溶液的浓度变为___________ mol·L-1。
(6)下列的实验操作可能导致配制的溶液浓度偏低的是____________ 。
A.容量瓶内原来存有少量的水
B.定容时液面超过刻度线,用胶头滴管吸出
C.称量所需CuSO4.5H2O的质量时,物品与砝码的位置放反了(1g以下用游码)
D.定容时俯视刻度线
(1)需称量胆矾CuSO4.5H2O
(2)在配制的过程中一定不需要使用到的仪器是(填写代号)
A.烧杯 B.药匙 C.玻璃棒 D.1000mL容量瓶 E.锥形瓶 F.胶头滴管
(3)下图所示的实验操作的先后顺序为

(4)玻璃棒在溶液配制中的作用:
(5)从配制好的CuSO4溶液中取出10mL,将这10mL的CuSO4溶液稀释至100mL,稀释后CuSO4溶液的浓度变为
(6)下列的实验操作可能导致配制的溶液浓度偏低的是
A.容量瓶内原来存有少量的水
B.定容时液面超过刻度线,用胶头滴管吸出
C.称量所需CuSO4.5H2O的质量时,物品与砝码的位置放反了(1g以下用游码)
D.定容时俯视刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】实验室要配制480mL0.2mol•L-1NaCl溶液,实验室只有含有少量硫酸钠的氯化钠固体,设计如下方案,请回答下列问题:
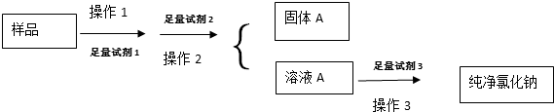
(1)固体A的化学式为____________________ ;
(2)试剂2的名称为___________ ,判断试剂2是否过量的方法___________ ,操作3的名称___________ ;
(3)加入试剂1,3发生反应的离子方程式分别为____________________ ;
Ⅱ配置溶液
(1)配制过程中不需要使用的化学仪器有________ (填选项的字母).
(2)用托盘天平称取氯化钠,其质量为_________ g;
(3)下列主要操作步骤的正确顺序是__________ (填序号).
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到500mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中.
(4)如果实验过程中缺少步骤⑤,会使配制出的NaCl溶液浓度__________ (填“偏高”或“偏低”或“不变”)。

(1)固体A的化学式为
(2)试剂2的名称为
(3)加入试剂1,3发生反应的离子方程式分别为
Ⅱ配置溶液
(1)配制过程中不需要使用的化学仪器有
| A.烧杯 | B.500mL容量瓶 | C.漏斗 | D.胶头滴管 |
(3)下列主要操作步骤的正确顺序是
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到500mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中.
(4)如果实验过程中缺少步骤⑤,会使配制出的NaCl溶液浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一。某中学的化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究。
I.甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,而今总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知以下信息:
①醋分两种,酿造醋和配制醋。正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋。
②酿造醋国家标准为醋酸含量必须大于3.50g/100mL,而配制醋国家标准仅为1.50g~3.50g/100mL。
③在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.75mol/L。
(1)请帮助甲同学计算从超市购买的食醋中醋酸含量为_____ g/100mL,属于_____ 醋(填“酿造”或“配制”,醋酸的化学式为CH3COOH)。
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式_____ 。
II.如图是该学校化学实验室浓盐酸试剂标签上的部分内容。乙同学现用该浓盐酸配制100mL 1mol•L﹣1的稀盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题:

(1)配制稀盐酸时,还缺少的仪器有_____ 。
(2)经计算,配制100mL1mol•L﹣1的稀盐酸需要用量筒量取上述浓盐酸的体积为_____ mL。
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol•L﹣1,引起误差的原因可能是_____ 。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
III.丙同学对课堂上学到的胶体的相关知识产生了浓厚兴趣。
(1)他利用买来的鸡蛋的蛋清配制成溶液,用激光笔照射溶液,发现一条光束穿过鸡蛋清溶液,此现象称为_____ 。
(2)他将乙同学配制好的盐酸溶液加入到鸡蛋清溶液中,发现出现絮状沉淀,此现象称为_____ 。
IV.丁同学试图测定CO2的相对分子质量。
①利用丙同学用完后剩下的鸡蛋壳和乙同学配制好的稀盐酸溶液制备CO2;
②查询相关书籍后,设计了如图装置:

(1)B装置在此处_____ 必要(填写“有”、“无”)请简述原因_____ 。
(2)A装置中的饱和NaHCO3的作用_____ 。
(3)实验前测得C装置(含水)重量为50.00g,实验完毕后C装置(含水)重量为40.02g,D中量筒读数为10.0mL,已知相同条件下H2密度为0.09g/L,请根据以上数据用相对密度法计算CO2的相对分子质量为_____ (保留一位小数)。
I.甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,而今总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知以下信息:
①醋分两种,酿造醋和配制醋。正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋。
②酿造醋国家标准为醋酸含量必须大于3.50g/100mL,而配制醋国家标准仅为1.50g~3.50g/100mL。
③在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.75mol/L。
(1)请帮助甲同学计算从超市购买的食醋中醋酸含量为
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式
II.如图是该学校化学实验室浓盐酸试剂标签上的部分内容。乙同学现用该浓盐酸配制100mL 1mol•L﹣1的稀盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题:

(1)配制稀盐酸时,还缺少的仪器有
(2)经计算,配制100mL1mol•L﹣1的稀盐酸需要用量筒量取上述浓盐酸的体积为
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol•L﹣1,引起误差的原因可能是
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
III.丙同学对课堂上学到的胶体的相关知识产生了浓厚兴趣。
(1)他利用买来的鸡蛋的蛋清配制成溶液,用激光笔照射溶液,发现一条光束穿过鸡蛋清溶液,此现象称为
(2)他将乙同学配制好的盐酸溶液加入到鸡蛋清溶液中,发现出现絮状沉淀,此现象称为
IV.丁同学试图测定CO2的相对分子质量。
①利用丙同学用完后剩下的鸡蛋壳和乙同学配制好的稀盐酸溶液制备CO2;
②查询相关书籍后,设计了如图装置:

(1)B装置在此处
(2)A装置中的饱和NaHCO3的作用
(3)实验前测得C装置(含水)重量为50.00g,实验完毕后C装置(含水)重量为40.02g,D中量筒读数为10.0mL,已知相同条件下H2密度为0.09g/L,请根据以上数据用相对密度法计算CO2的相对分子质量为
您最近一年使用:0次



