为了除去粗盐(主要成分为NaCl)样品中含有的少量氯化钙、氯化镁和硫酸钠杂质,某同学运用所学知识设计了如图所示的除杂方案。
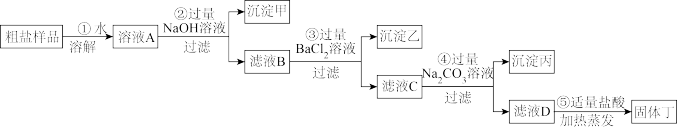
请根据上述除杂方案,回答下列问题:
(1)沉淀甲的主要成分是____________ (填化学式,后同);沉淀乙是______ ;沉淀丙是______ ;滤液C中的溶质是__________ ;⑤中加入适量盐酸的目的是______________________ 。
(2)假设整个操作过程中物质转化无损失,则固体丁中NaCl的质量相对于样品中NaCl的质量是____ (填“增大”“不变”或“减小”)的;若在②中改为加入过量的KOH溶液,则固体丁中可能含有的杂质是______ 。

请根据上述除杂方案,回答下列问题:
(1)沉淀甲的主要成分是
(2)假设整个操作过程中物质转化无损失,则固体丁中NaCl的质量相对于样品中NaCl的质量是
19-20高一·全国·课时练习 查看更多[2]
更新时间:2020-10-08 21:53:59
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】下列物质是生产、生活中常见的物质。
① 固体 ②葡萄糖 ③稀硫酸 ④铝箔 ⑤
固体 ②葡萄糖 ③稀硫酸 ④铝箔 ⑤ 固体 ⑥粒子直径为1nm~100nm的
固体 ⑥粒子直径为1nm~100nm的 ⑦乙醇(
⑦乙醇( ) ⑧饱和食盐水
) ⑧饱和食盐水
请回答下列问题:
(1)以上物质中属于电解质的是___________ (填序号,下同)。
(2)以上物质在该状态下能导电的是___________ 。
(3)将⑥均匀地分散在水中,形成的分散系属于___________ ,可用的鉴别原理是___________ 。
(4) 在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
在实验室和工业上均有重要应用,其工业制备的部分工艺如下:

资料:软锰矿的主要成分为 ,
, 。为暗绿色固体,在强碱性溶液中稳定存在,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
。为暗绿色固体,在强碱性溶液中稳定存在,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
a.写出“焙烧”时生成 的化学方程式:
的化学方程式:___________ 。
b.过滤需要使用的玻璃仪器除漏斗外,还有___________ 。
c.通入 可发生歧化反应,有
可发生歧化反应,有 生成,写出
生成,写出 与
与 反应的化学方程式:
反应的化学方程式:___________ 。
d.高锰酸钾在酸性介质中的强氧化性广泛应用于分析化学中,配平以下反应方程式。___________
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________
①
 固体 ②葡萄糖 ③稀硫酸 ④铝箔 ⑤
固体 ②葡萄糖 ③稀硫酸 ④铝箔 ⑤ 固体 ⑥粒子直径为1nm~100nm的
固体 ⑥粒子直径为1nm~100nm的 ⑦乙醇(
⑦乙醇( ) ⑧饱和食盐水
) ⑧饱和食盐水请回答下列问题:
(1)以上物质中属于电解质的是
(2)以上物质在该状态下能导电的是
(3)将⑥均匀地分散在水中,形成的分散系属于
(4)
 在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
在实验室和工业上均有重要应用,其工业制备的部分工艺如下:
资料:软锰矿的主要成分为
 ,
, 。为暗绿色固体,在强碱性溶液中稳定存在,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。
。为暗绿色固体,在强碱性溶液中稳定存在,在近中性或酸性溶液中易发生歧化反应(Mn的化合价既升高又降低)。a.写出“焙烧”时生成
 的化学方程式:
的化学方程式:b.过滤需要使用的玻璃仪器除漏斗外,还有
c.通入
 可发生歧化反应,有
可发生歧化反应,有 生成,写出
生成,写出 与
与 反应的化学方程式:
反应的化学方程式:d.高锰酸钾在酸性介质中的强氧化性广泛应用于分析化学中,配平以下反应方程式。
___________
 ___________
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________
您最近一年使用:0次
【推荐2】按要求回答下列问题。
(1)铁盐可用作净水剂,用离子方程式表示其原理:___________ 。配制 溶液时,需将
溶液时,需将 晶体溶解到较浓的
晶体溶解到较浓的___________ 中,然后再加水稀释到所需的浓度。将 溶液蒸干并灼烧,得到的产物是
溶液蒸干并灼烧,得到的产物是___________ (填化学式)。
(2)某 溶液中含有
溶液中含有 杂质,可向溶液中加入足量的
杂质,可向溶液中加入足量的___________ ,充分反应后过滤,即可除去 。
。
(3)在 的
的 溶液中,含有杂质
溶液中,含有杂质 。若通过直接调节
。若通过直接调节 的方法使
的方法使 沉淀完全,是否同时会有
沉淀完全,是否同时会有 沉淀生成?
沉淀生成?___________ (填“是”或“否”)。向溶液中加入 将
将 氧化为
氧化为 ,调节
,调节 使
使 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 ),此时溶液的
),此时溶液的 约为
约为___________ 。(已知 时
时 、
、 、
、 的
的 分别为
分别为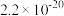 、
、 、
、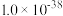 )
)
(1)铁盐可用作净水剂,用离子方程式表示其原理:
 溶液时,需将
溶液时,需将 晶体溶解到较浓的
晶体溶解到较浓的 溶液蒸干并灼烧,得到的产物是
溶液蒸干并灼烧,得到的产物是(2)某
 溶液中含有
溶液中含有 杂质,可向溶液中加入足量的
杂质,可向溶液中加入足量的 。
。(3)在
 的
的 溶液中,含有杂质
溶液中,含有杂质 。若通过直接调节
。若通过直接调节 的方法使
的方法使 沉淀完全,是否同时会有
沉淀完全,是否同时会有 沉淀生成?
沉淀生成? 将
将 氧化为
氧化为 ,调节
,调节 使
使 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于 ),此时溶液的
),此时溶液的 约为
约为 时
时 、
、 、
、 的
的 分别为
分别为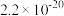 、
、 、
、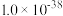 )
)
您最近一年使用:0次
填空题
|
适中
(0.65)
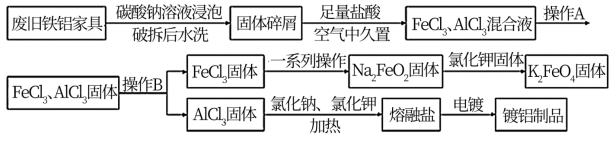
【推荐3】某再回收利用公司对一厨房铁铝合金废旧家具进行回收利用,其流程如下图所示:
请回答下列问题:
(1)流程中加碳酸钠溶液浸泡的目的是_______________ ;在空气中久置的目的是_________________ 。
(2)同条件下Na2FeO4溶解度__________ K2FeO4溶解度(填“低于”,“高于”, “不确定”),推测K2FeO4在净水方面的作用_______________ 。(至少答两条)
(3)已知K2FeO4水解显碱性。在洗涤K2FeO4固体时最好选用__________ 。
A.水 B.亚硫酸氢钠溶液 C.氢氧化钠溶液 D.先氢氧化钠溶液后乙醇
(4)熔融盐电镀中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,铝电镀的主要电极反应式为___________________ 。(写出一个电极反应即可)
(5)已知氯化铝受热易升华,气态氯化铝的密度为11.92g/L(已转化为标准状况),则气态氯化铝的分子式为______________________ 。
(6)氢氧化铝经常用于做药品,有两种溶解方式:可以溶解为Al3+或[Al(OH)4]-。已知25℃时氢氧化铝在pH=3和pH=10的两溶液中溶解度均为7.8×10-3g(溶液密度近似为1g/mL),则25℃下氢氧化铝的两种溶解方式的溶度积之比为____________ 。

请回答下列问题:
(1)流程中加碳酸钠溶液浸泡的目的是
(2)同条件下Na2FeO4溶解度
(3)已知K2FeO4水解显碱性。在洗涤K2FeO4固体时最好选用
A.水 B.亚硫酸氢钠溶液 C.氢氧化钠溶液 D.先氢氧化钠溶液后乙醇
(4)熔融盐电镀中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,铝电镀的主要电极反应式为
(5)已知氯化铝受热易升华,气态氯化铝的密度为11.92g/L(已转化为标准状况),则气态氯化铝的分子式为
(6)氢氧化铝经常用于做药品,有两种溶解方式:可以溶解为Al3+或[Al(OH)4]-。已知25℃时氢氧化铝在pH=3和pH=10的两溶液中溶解度均为7.8×10-3g(溶液密度近似为1g/mL),则25℃下氢氧化铝的两种溶解方式的溶度积之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】选择下列实验方法分离物质,将分离方法的序号填在横线上
A 萃取分液法 B 过滤法 C 分液法 D 蒸馏法 E 蒸发结晶法
①______ 分离饱和食盐水与沙子的混合物。
②______ 分离水和汽油的混合物。
③______ 分离互溶的四氯化碳(沸点76.8℃)和甲苯(沸点110.6℃)的混合物。
④______ 从碘的水溶液里提取碘。
A 萃取分液法 B 过滤法 C 分液法 D 蒸馏法 E 蒸发结晶法
①
②
③
④
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)下列实验装置一般用于什么实验操作(填实验操作名称)
A______________ B______________ C____________
A.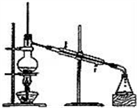 B.
B.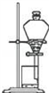 C.
C.
(2) 在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4 g。
①CO的质量为________ ②混合气体的平均摩尔质量为________
③CO2的体积为________ ④混合气体的密度为_____ (小数点后保留1位)
A
A.
 B.
B. C.
C.
(2) 在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4 g。
①CO的质量为
③CO2的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】选择下列实验方法分离物质,将分离方法的序号填在横线上.
A萃取分液 B升华 C结晶 D过滤 E蒸馏 F分液
(1)分离饱和食盐水与沙子的混合物___________
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾___________
(3)从碘水中提取碘单质___________
(4)分离氯化钠固体和碘单质的混合物___________
(5)分离水和汽油的混合物___________
(6)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物___________
A萃取分液 B升华 C结晶 D过滤 E蒸馏 F分液
(1)分离饱和食盐水与沙子的混合物
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾
(3)从碘水中提取碘单质
(4)分离氯化钠固体和碘单质的混合物
(5)分离水和汽油的混合物
(6)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】常温下,青蒿素为无色针状晶体,难溶于水,易容有机溶剂,熔点为156-157℃。青蒿素是一种有效的抗疟药,某化学兴趣小组对青蒿素的提取和组成进行如下的探究。
Ⅰ.提取青蒿素的方法之一是乙醚浸取法,提取流程如下:
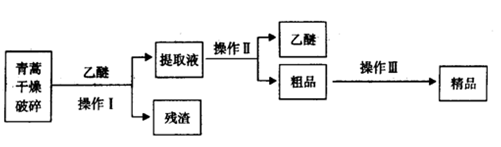
(1)对青蒿进行破碎的目的是___________
(2)操作Ⅰ用到的玻璃仪器是__________ ,操作Ⅱ的名称是__________
Ⅱ.燃烧法测定青蒿素的最简式:
利用下列实验装置,将28.2g青蒿素放在燃烧管C中充分燃烧,测出生成的CO2和H2O的质量后,计算得出青蒿素的最简式。

主要实验步骤如下:
①组装仪器,并检查装置的气密性。
②先将A装置的药品反应一会后,再将C装置通电反应。
③称量有关装置的实验前后的质量。
请回答下列问题:
(3)仪器各接口的连接顺序从左到右依次为_____ (每个装置限用一次)。
(4)①装置B中的试剂为________ ,其作用是__________ 。
②装置C中CuO的作用是__________ 。
③装置D中的试剂为______ ,其作用是________________ 。
④装置E中的试剂为______ ,其作用是________________ 。
⑤装置F中的试剂为______ ,其作用是_________________ 。
(5)已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验,测量数据如表:
则青蒿素的最简式为_____________ .
Ⅰ.提取青蒿素的方法之一是乙醚浸取法,提取流程如下:

(1)对青蒿进行破碎的目的是
(2)操作Ⅰ用到的玻璃仪器是
Ⅱ.燃烧法测定青蒿素的最简式:
利用下列实验装置,将28.2g青蒿素放在燃烧管C中充分燃烧,测出生成的CO2和H2O的质量后,计算得出青蒿素的最简式。

主要实验步骤如下:
①组装仪器,并检查装置的气密性。
②先将A装置的药品反应一会后,再将C装置通电反应。
③称量有关装置的实验前后的质量。
请回答下列问题:
(3)仪器各接口的连接顺序从左到右依次为
(4)①装置B中的试剂为
②装置C中CuO的作用是
③装置D中的试剂为
④装置E中的试剂为
⑤装置F中的试剂为
(5)已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验,测量数据如表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E | 80.2 | 146.2 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】为测定氯化钾和硫酸钾混合物中氯化钾的含量,某同学设计了如下实验:称量样品,溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C。
回答下列问题:
(1)溶液A溶质的化学式_______ ,物质C的化学式_______ 。
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码质量为26g,游码为0.4g,则右盘样品实际质量是_______ 。
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是_______ 。
(4)若C的质量为23.3g,则原混合物中氯化钾的质量分数为_______ 。
回答下列问题:
(1)溶液A溶质的化学式
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码质量为26g,游码为0.4g,则右盘样品实际质量是
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是
(4)若C的质量为23.3g,则原混合物中氯化钾的质量分数为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】某研究性学习小组同学用含有少量泥沙、CaCl2、MgCl2、Na2SO4的粗盐制取纯净的NaCl,实验前他们设计了如图方案(框图)
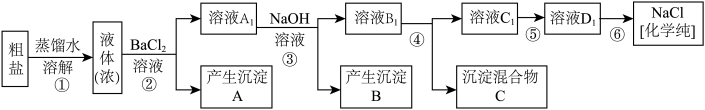
(1)请写出操作第④步所加试剂名称及第②步操作名称:
④_____________________ ,②___________________________ 。
(2)写出第⑤步操作中可能发生反应的离子方程式:____________________ 。
(3)如何检验第②步操作中硫酸根离子已完全除尽:_____________________ 。
(4)你认为该设计里哪些步骤调换后不影响实验结果:___________________ 。

(1)请写出操作第④步所加试剂名称及第②步操作名称:
④
(2)写出第⑤步操作中可能发生反应的离子方程式:
(3)如何检验第②步操作中硫酸根离子已完全除尽:
(4)你认为该设计里哪些步骤调换后不影响实验结果:
您最近一年使用:0次



