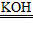铅蓄电池是常用的化学电源,其电极材料分别是Pb和 ,电解液为硫酸。
,电解液为硫酸。
(1)该蓄电池放电时,电解质溶液中阴离子移向_________ (填“正极”或“负极”)放电时,负极的电极反应式为____________ ,充电时阳极反应式为________ (用离子方程式表示)
(2)实验室用铅蓄电池做电源电解饱和食盐水制取氯气,若制得 ,这时电池内消耗的
,这时电池内消耗的 的物质的量是
的物质的量是_______ ,电解饱和食盐水的化学方程式为_________ 。
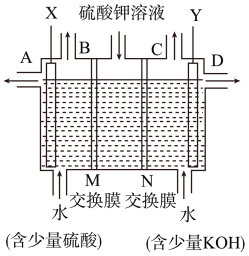
(3)某同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。X极与电源的___________ (填“正”或“负”)极相连,氢气从___________ (选填“A”、“B”、“C”或“D”)口导出,若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为_____________ 。若将氢气换成甲醇,与氧气和氢氧化钾溶液组合为甲醇燃料电池那么负极反应为______________ ,将氢氧化钾溶液换成熔融碳酸钾为介质,就构成了熔融盐甲醇燃料电池,电池正极反应为______________ 。
 ,电解液为硫酸。
,电解液为硫酸。(1)该蓄电池放电时,电解质溶液中阴离子移向
(2)实验室用铅蓄电池做电源电解饱和食盐水制取氯气,若制得
 ,这时电池内消耗的
,这时电池内消耗的 的物质的量是
的物质的量是(3)某同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。X极与电源的

更新时间:2020-11-26 21:49:50
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】Ⅰ.回答下列问题:
(1)在实验室中配制FeCl3溶液时,配制方法是将FeCl3晶体溶于____ 中,然后加水稀释到所需浓度,这样操作的目的是____ 。
(2)如果盐的水解程度很大,则可用于无机化合物的制备。例如用TiCl4制备TiO2的反应可表示为:____ ,将所得产物TiO2·xH2O焙烧得到TiO2。
Ⅱ.以废旧铅酸蓄电池中的含铅废料和H2SO4为原料,可以制取高纯PbO,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①2Fe2++PbO2+4H++SO =2Fe3++PbSO4+2H2O
=2Fe3++PbSO4+2H2O
②2Fe3++Pb+SO =2Fe2++PbSO4
=2Fe2++PbSO4
(3)写出Pb与PbO2反应生成PbSO4的化学方程式____ 。
(4)在上述过程中,Fe2+的作用是____ 。
(5)下列实验方案,可证实上述过程,请将方案补充完整。
a.向酸化的FeSO4溶液中加入____ 溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.向a得到的溶液中加入____ 溶液恢复原来的颜色。
(1)在实验室中配制FeCl3溶液时,配制方法是将FeCl3晶体溶于
(2)如果盐的水解程度很大,则可用于无机化合物的制备。例如用TiCl4制备TiO2的反应可表示为:
Ⅱ.以废旧铅酸蓄电池中的含铅废料和H2SO4为原料,可以制取高纯PbO,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①2Fe2++PbO2+4H++SO
 =2Fe3++PbSO4+2H2O
=2Fe3++PbSO4+2H2O②2Fe3++Pb+SO
 =2Fe2++PbSO4
=2Fe2++PbSO4(3)写出Pb与PbO2反应生成PbSO4的化学方程式
(4)在上述过程中,Fe2+的作用是
(5)下列实验方案,可证实上述过程,请将方案补充完整。
a.向酸化的FeSO4溶液中加入
b.向a得到的溶液中加入
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为 ,碱性锌锰干电池的负极材料是
,碱性锌锰干电池的负极材料是______ (填名称),负极上发生的电极反应为______ 。若反应消耗13g负极材料,则电池中转移电子的物质的量______ mol。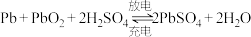 。下列说法正确的是______(填标号)。
。下列说法正确的是______(填标号)。
(3)镁铝电池的构造如图所示,当电解质溶液为 溶液时,可知电池的负极材料为
溶液时,可知电池的负极材料为______ (填“Mg”或“Al”)反应式为______ 。
(1)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为
 ,碱性锌锰干电池的负极材料是
,碱性锌锰干电池的负极材料是
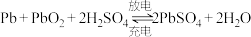 。下列说法正确的是______(填标号)。
。下列说法正确的是______(填标号)。A.电解液中 的浓度始终保持不变 的浓度始终保持不变 |
B.放电时正极上的电极反应式为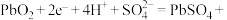 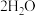 |
C.放电时,当外电路通过 电子时,理论上负极质量增加 电子时,理论上负极质量增加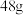 |
D.放电时,溶液中的 向正极移动 向正极移动 |
(3)镁铝电池的构造如图所示,当电解质溶液为
 溶液时,可知电池的负极材料为
溶液时,可知电池的负极材料为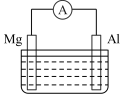
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】回答下列问题
(1)将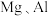 用导线相连浸入
用导线相连浸入 溶液中,形成原电池,负极的电极反应为
溶液中,形成原电池,负极的电极反应为___________
(2)铅蓄电池放电时的正极反应为___________ 。
(3)以硫酸溶液为电解质时,甲烷燃料电池的正极反应为___________ 。
(4)某研究性学习小组根据反应 设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为
设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为 ,溶液的体积均为
,溶液的体积均为 ,盐桥中装有饱和
,盐桥中装有饱和 溶液。
溶液。
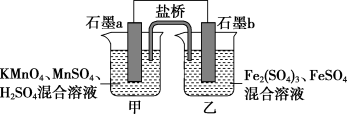
回答下列问题:
①此原电池的负极是石墨___________ (填“a”或“b”)。
②电池工作时,盐桥中的 移向
移向___________ (填“甲”或“乙”)烧杯。
③甲烧杯中的电极反应式为___________ 。
④若不考虑溶液的体积变化, ,则反应中转移的电子为
,则反应中转移的电子为___________  。
。
(1)将
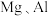 用导线相连浸入
用导线相连浸入 溶液中,形成原电池,负极的电极反应为
溶液中,形成原电池,负极的电极反应为(2)铅蓄电池放电时的正极反应为
(3)以硫酸溶液为电解质时,甲烷燃料电池的正极反应为
(4)某研究性学习小组根据反应
 设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为
设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为 ,溶液的体积均为
,溶液的体积均为 ,盐桥中装有饱和
,盐桥中装有饱和 溶液。
溶液。
回答下列问题:
①此原电池的负极是石墨
②电池工作时,盐桥中的
 移向
移向③甲烧杯中的电极反应式为
④若不考虑溶液的体积变化,
 ,则反应中转移的电子为
,则反应中转移的电子为 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。请回答下列问题:
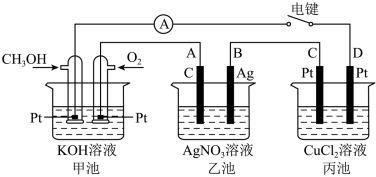
(1)甲池中O2的电极反应式为________________ ;CH3OH的电极反应式为_______________ ;
(2)当乙池中B极质量增加10.8g时,甲池中理论上消耗O2的体积为____________ mL(标准状况下),丙池总反应方程式__________________ ;
(3)若丙中电极不变,将其溶液换成CuSO4溶液,电键闭合一段时间后,甲中溶液的pH将____________ (填“增大”“减小”或“不变”);丙中溶液的pH将______________ (填“增大”“减小”或“不变”)。
(4)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O Pb+PbO2+2H2SO4,铅蓄电池放电时,
Pb+PbO2+2H2SO4,铅蓄电池放电时,______________ (填物质化学式)在负极发生反应。若电解液体积为2 L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移4 mol电子,则硫酸浓度由5 mol/L下降到_____________ mol/L。

(1)甲池中O2的电极反应式为
(2)当乙池中B极质量增加10.8g时,甲池中理论上消耗O2的体积为
(3)若丙中电极不变,将其溶液换成CuSO4溶液,电键闭合一段时间后,甲中溶液的pH将
(4)铅蓄电池是常见的化学电源之一,其充电、放电的总反应是:2PbSO4+2H2O
 Pb+PbO2+2H2SO4,铅蓄电池放电时,
Pb+PbO2+2H2SO4,铅蓄电池放电时,
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】甲醇( )是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。已知:
)是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。已知:
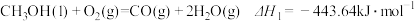
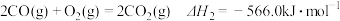
(1)试写出 (1)在氧气中完全燃烧生成
(1)在氧气中完全燃烧生成 和
和 的热化学方程式:
的热化学方程式:________
(2)科研人员研发出一种由强碱溶液作电解质溶液的新型甲醇手机电池,充满电后手机可连续使用一个月,则放电时,甲醇在___________ (填“正”或“负”)极发生反应。
(3)某同学设计了一种用电解法制取 的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是
的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是__________ (填序号)。
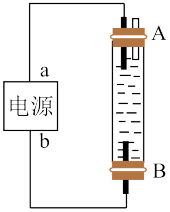
A.a为电源正极,b为电源负极 B.可以用NaCl溶液作为电解质溶液
C.A.B两端都必须用铁作电极 D.阴极发生的反应为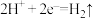
 )是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。已知:
)是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。已知: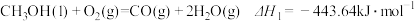
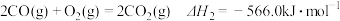
(1)试写出
 (1)在氧气中完全燃烧生成
(1)在氧气中完全燃烧生成 和
和 的热化学方程式:
的热化学方程式:(2)科研人员研发出一种由强碱溶液作电解质溶液的新型甲醇手机电池,充满电后手机可连续使用一个月,则放电时,甲醇在
(3)某同学设计了一种用电解法制取
 的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是
的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是
A.a为电源正极,b为电源负极 B.可以用NaCl溶液作为电解质溶液
C.A.B两端都必须用铁作电极 D.阴极发生的反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,要实现铁电极上镀银。请回答下列问题:
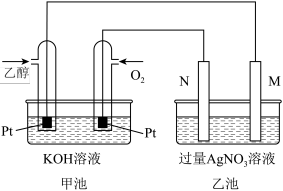
(1)M电极的材料是_____ ,电极名称是_____ ,N的电极反应式为_____ ,加入乙醇的铂电极的电极反应式_____ 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为_____ L(标准状况下);若此时乙池溶液的体积为400mL,则常温下乙池中溶液的pH为_____ 。若要使乙池中AgNO3溶液复原,可以加下列物质中的_____ 。
A.Ag B.Ag2O C.AgNO3

(1)M电极的材料是
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为
A.Ag B.Ag2O C.AgNO3
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】按要求回答下列问题:
(1)已知:1gH2完全燃烧生成液态水的热量为142.9kJ,请写出氢气燃烧热 的热化学方程式_______ 。
(2)H2CO3的电离方程式是_______ 。
(3)硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应的化学方程式是_______ 。
(4)FeCl3水解的离子方程式是_______ 。
(5)写出NaHCO3溶液中的物料守恒式_______ 。
(6)写出氢氧燃料电池(电解质为碱性溶液)的正极电极方程式是_______ 。
(1)已知:1gH2完全燃烧生成液态水的热量为142.9kJ,请写出氢气
(2)H2CO3的电离方程式是
(3)硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应的化学方程式是
(4)FeCl3水解的离子方程式是
(5)写出NaHCO3溶液中的物料守恒式
(6)写出氢氧燃料电池(电解质为碱性溶液)的正极电极方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】氢能是一种极具发展潜力的清洁能源。
(1)可采用太阳能光催化分解水法制备氢气:2H2O(l) 2H2(g)+O2(g)
2H2(g)+O2(g)
①该反应中能量转化的主要形式是_______ 。
②该反应中2molH2O(l)具有的能量_______ (填“大于”“小于”或“等于”)2molH2(g)和1molO2(g)具有的总能量。
(2)金属氢化物是一类储氢材料,如MgH2,该物质能与水反应:MgH2+2H2O=Mg(OH)2+2H2↑。上述反应中涉及的物质属于共价化合物的是_______ (填化学式,下同),含有离子键的是MgH2、_______ 。
(3)CO2与CH4在一定条件下反应转化为H2和CO,其反应为CO2(g)+CH4(g) 2H2(g)+2CO(g)
2H2(g)+2CO(g)
①下列措施能加快其反应速率的是_______ (填字母)。
a降低温度 b.增加CH4浓度 c.使用催化剂
②反应过程中体系中各物质的量随时间变化的关系如图1由此可得出平衡时n(CO2)消耗>n(CH4)消耗的原因可能是_______ 。

(4)氧氧燃料电池以NaOH溶液为电解质溶液,其工作原理如图2所示。

①外电路中电子移动方向为_______ (填“a→b”或“b→a”)。
②a电极的电极反应式为_______ 。
(1)可采用太阳能光催化分解水法制备氢气:2H2O(l)
 2H2(g)+O2(g)
2H2(g)+O2(g)①该反应中能量转化的主要形式是
②该反应中2molH2O(l)具有的能量
(2)金属氢化物是一类储氢材料,如MgH2,该物质能与水反应:MgH2+2H2O=Mg(OH)2+2H2↑。上述反应中涉及的物质属于共价化合物的是
(3)CO2与CH4在一定条件下反应转化为H2和CO,其反应为CO2(g)+CH4(g)
 2H2(g)+2CO(g)
2H2(g)+2CO(g)①下列措施能加快其反应速率的是
a降低温度 b.增加CH4浓度 c.使用催化剂
②反应过程中体系中各物质的量随时间变化的关系如图1由此可得出平衡时n(CO2)消耗>n(CH4)消耗的原因可能是

(4)氧氧燃料电池以NaOH溶液为电解质溶液,其工作原理如图2所示。

①外电路中电子移动方向为
②a电极的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】世界上绝大部分卤素都存在于海洋。海水呈微碱性,海水晒盐可以得到粗盐和卤水,对粗盐和卤水进一步加工可以得到氯气、溴以及其他一些重要的化工产品。
完成下列填空:
(1)工业上用电解饱和食盐水的方法获取氯气。写出阴极的电极反应式_______________ ,该反应为________ (选填“氧化”、“还原”)反应。若转移5mol电子,生成氯气______ L(标准状况下)。
(2)工业上从卤水获取溴,涉及到“氧化”、“提取”等步骤。“氧化”时先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是________________ 。在“提取”过程中,用空气把溴吹出,然后用碳酸钠溶液吸收,这时溴转化为Br-和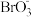 ,同时有CO2生成,写出反应的化学方程式
,同时有CO2生成,写出反应的化学方程式________________________________ 。
(3)用上述方法制得的液溴常溶有少量氯气,除去氯气的方法是_____________ 。
(4)足量氯气与铁反应生成氯化铁,足量碘与铁反应生成碘化亚铁。运用原子结构和元素周期律简要说明导致产物中铁元素价态不同的原因__________________________________ 。
完成下列填空:
(1)工业上用电解饱和食盐水的方法获取氯气。写出阴极的电极反应式
(2)工业上从卤水获取溴,涉及到“氧化”、“提取”等步骤。“氧化”时先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是
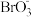 ,同时有CO2生成,写出反应的化学方程式
,同时有CO2生成,写出反应的化学方程式(3)用上述方法制得的液溴常溶有少量氯气,除去氯气的方法是
(4)足量氯气与铁反应生成氯化铁,足量碘与铁反应生成碘化亚铁。运用原子结构和元素周期律简要说明导致产物中铁元素价态不同的原因
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】写出下列反应的化学方程式,是离子反应的写离子方程式。
(1) 和
和 溶液的反应
溶液的反应_______ ;
(2) 和石灰乳的反应
和石灰乳的反应_______ ;
(3)把 通
通 溶液中
溶液中_______ ;
(4)将 和
和 混合通入
混合通入 中
中_______ ;
(5)将 通入氢硫酸溶液中
通入氢硫酸溶液中_______ ;
(6)将浓盐酸和 混合加热
混合加热_______ ;
(7)电解饱和食盐水_______ ;
(8)将浓盐酸与漂白液混合_______ ;
(9)向 固体滴加浓盐酸
固体滴加浓盐酸_______ ;
(10)向漂白粉溶液中通入少量 气体
气体_______ 。
(1)
 和
和 溶液的反应
溶液的反应(2)
 和石灰乳的反应
和石灰乳的反应(3)把
 通
通 溶液中
溶液中(4)将
 和
和 混合通入
混合通入 中
中(5)将
 通入氢硫酸溶液中
通入氢硫酸溶液中(6)将浓盐酸和
 混合加热
混合加热(7)电解饱和食盐水
(8)将浓盐酸与漂白液混合
(9)向
 固体滴加浓盐酸
固体滴加浓盐酸(10)向漂白粉溶液中通入少量
 气体
气体
您最近一年使用:0次
填空题
|
适中
(0.65)
真题
【推荐3】工业上对海水资源综合开发利用的部分工艺流程如下图所示。
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽,离子膜和隔膜均允许通过的分子或离子是_______ 。电解槽中的阳极材料为_________________ 。
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备_______ ?原因是____________________________ 。
(3)膜在四氧化碳中的溶解度比在水中大得多,四氧化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氧化碳,原因是______________________________________ 。
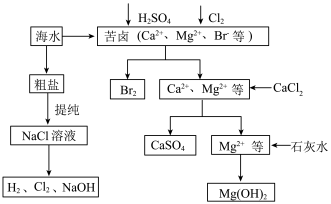
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽,离子膜和隔膜均允许通过的分子或离子是
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备
(3)膜在四氧化碳中的溶解度比在水中大得多,四氧化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氧化碳,原因是
您最近一年使用:0次