用MnO2的质量分数为80%的软锰矿与足量的浓盐酸反应(假设杂质不与盐酸反应),制取氯气11.2 L(标准状况下)。
(1)配平发生反应的化学方程式,并用“双线桥法”标出反应中电子转移的方向与数目。指出氧化剂和还原剂分别是什么物质。
MnO2+ HCl(浓) MnCl2+ Cl2↑+ H2O
MnCl2+ Cl2↑+ H2O
___________________________________________ ;氧化剂:______ ,还原剂:_______ 。
(2)至少需要这种软锰矿________ 克?
(3)若浓盐酸的质量分数为37%,密度为1.18 g/cm3,试求该盐酸的物质的量浓度_______ 。
(1)配平发生反应的化学方程式,并用“双线桥法”标出反应中电子转移的方向与数目。指出氧化剂和还原剂分别是什么物质。
MnO2+ HCl(浓)
 MnCl2+ Cl2↑+ H2O
MnCl2+ Cl2↑+ H2O(2)至少需要这种软锰矿
(3)若浓盐酸的质量分数为37%,密度为1.18 g/cm3,试求该盐酸的物质的量浓度
更新时间:2020-11-30 15:59:41
|
相似题推荐
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】海水中有丰富的资源,海底有丰富的矿藏、石油、天然气等,此外还含有大量的电解质,它们电离产生 、
、 、
、 、
、 、
、 、
、 等,都是重要资源。
等,都是重要资源。
(1)以海水为原料,必须经过化学反应才能获得的是___________。(填代号)
(2)对粗盐进行精制。将粗盐溶解滤去不溶性杂质后,还需要除去可溶性杂质(如: 、
、 、
、 ),需要加入试剂的顺序及作用分别是:
),需要加入试剂的顺序及作用分别是:
①加入过量的 溶液,以除去
溶液,以除去___________ 。
②加入过量的___________ ,以除去___________ 。
③加入过量的___________ ,以除去___________ 。
④过滤,在滤液中加入盐酸调节至中性。
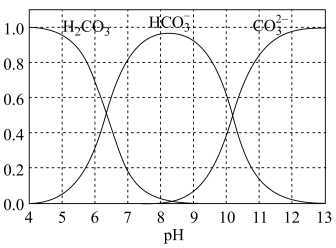
(3)查阅资料如图:常温下,溶液中含碳微粒的物质的量分数随溶液 变化的图象。由该图象可知,食盐水经过上述精制过程后,仍然存在的含碳杂质微粒是
变化的图象。由该图象可知,食盐水经过上述精制过程后,仍然存在的含碳杂质微粒是___________ ,为了继续纯化,应向上一步滤液中加入盐酸至 约为
约为___________ ,发生反应的离子方程式为:___________ 。
(4)以海水为原料获得氯气的反应原理为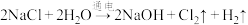
①该反应的还原剂是___________ 。
②若得到标准状况下 氯气时,则消耗
氯气时,则消耗
___________  ,生成氢气
,生成氢气___________  。
。
③分离产物,取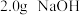 固体。欲配制浓度为
固体。欲配制浓度为 的
的 溶液,需要用到的玻璃仪器有
溶液,需要用到的玻璃仪器有___________ 、___________ 。
 、
、 、
、 、
、 、
、 、
、 等,都是重要资源。
等,都是重要资源。(1)以海水为原料,必须经过化学反应才能获得的是___________。(填代号)
| A.金属镁 | B.粗盐 | C.溴单质 | D.淡水 |
 、
、 、
、 ),需要加入试剂的顺序及作用分别是:
),需要加入试剂的顺序及作用分别是:①加入过量的
 溶液,以除去
溶液,以除去②加入过量的
③加入过量的
④过滤,在滤液中加入盐酸调节至中性。
(3)查阅资料如图:常温下,溶液中含碳微粒的物质的量分数随溶液
 变化的图象。由该图象可知,食盐水经过上述精制过程后,仍然存在的含碳杂质微粒是
变化的图象。由该图象可知,食盐水经过上述精制过程后,仍然存在的含碳杂质微粒是 约为
约为
(4)以海水为原料获得氯气的反应原理为
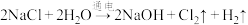
①该反应的还原剂是
②若得到标准状况下
 氯气时,则消耗
氯气时,则消耗
 ,生成氢气
,生成氢气 。
。③分离产物,取
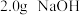 固体。欲配制浓度为
固体。欲配制浓度为 的
的 溶液,需要用到的玻璃仪器有
溶液,需要用到的玻璃仪器有
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】我们已经学习了钠、氯、铁、铝等元素的单质及其化合物的相关性质,请回答下列问题:
(1)四种元素的单质中,氧化性和还原性最强的两种单质反应生成某种化合物,用电子式表示该化合物的形成过程:____ 。
(2)把8.3g铁铝合金的粉末放入过量的盐酸中,得到5.6L标况下的H2,则合金中铁的质量分数为:____ (保留三位有效数字)。
(3)配平Na2FeO4与盐酸反应的方程式:____Na2FeO4+____HCl=____NaCl+____FeCl3+____H2O+____Cl2↑____ ,Na2FeO4的电离方程式为____ 。该反应按方程式计量数关系,所得产物中离子键与共价键的个数比为:____ 。
(1)四种元素的单质中,氧化性和还原性最强的两种单质反应生成某种化合物,用电子式表示该化合物的形成过程:
(2)把8.3g铁铝合金的粉末放入过量的盐酸中,得到5.6L标况下的H2,则合金中铁的质量分数为:
(3)配平Na2FeO4与盐酸反应的方程式:____Na2FeO4+____HCl=____NaCl+____FeCl3+____H2O+____Cl2↑
您最近一年使用:0次
填空题
|
较易
(0.85)
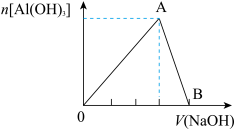
【推荐1】向20mL含有1mol/L的氯化铝溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的物质的量与所加碱的体积如图所示:
(1)写出OA段和AB段发生反应的离子方程式:OA段_____ ;AB段_____ 。
(2)A点溶液中的溶质为:____ 。(填化学式)
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是____ mL或____ mL。
(4)B点表示的氢氧化钠溶液的体积是___ mL。
(1)写出OA段和AB段发生反应的离子方程式:OA段
(2)A点溶液中的溶质为:
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是
(4)B点表示的氢氧化钠溶液的体积是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】在 300 mL 2 mol/L H2SO4 溶液中,SO 的物质的量浓度是
的物质的量浓度是________ ,H+ 的物质的量浓度是________ ,溶质的质量是________ ,此溶液中含 H+ 的物质的量是________ 。
 的物质的量浓度是
的物质的量浓度是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】完成下列问题
(1)11g 2H218O 所含的中子的物质的量为_______ 。
(2)10.8g R2O5 中氧原子的数目为 3.01×1023,则元素R 的相对原子质量为_______ 。
(3)质量相同的H2、NH3、SO2、O3 四种气体中,含有分子数目最少的是_______ 。
(4)标准状况下,3.4g NH3 与_______ L H2S 含有相同数目的氢原子。
(5)由 CH4 和 O2 的组成的混和气体,在标况下的密度是H2 的 14.5 倍。则该混合气体中 CH4 和 O2的体积比为_______ 。
(6)将标准状况下 44.8L HCl 溶于 100mL 水中(ρ=1g·cm-3),所得溶液的密度为 1.384g/mL,则其物质的量浓度为_______ 。
(1)11g 2H218O 所含的中子的物质的量为
(2)10.8g R2O5 中氧原子的数目为 3.01×1023,则元素R 的相对原子质量为
(3)质量相同的H2、NH3、SO2、O3 四种气体中,含有分子数目最少的是
(4)标准状况下,3.4g NH3 与
(5)由 CH4 和 O2 的组成的混和气体,在标况下的密度是H2 的 14.5 倍。则该混合气体中 CH4 和 O2的体积比为
(6)将标准状况下 44.8L HCl 溶于 100mL 水中(ρ=1g·cm-3),所得溶液的密度为 1.384g/mL,则其物质的量浓度为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】化学是打开物质世界的一把钥匙。现有物质:①熔融NaCl ②稀硫酸 ③ ④
④ 固体 ⑤Zn ⑥蔗糖 ⑦
固体 ⑤Zn ⑥蔗糖 ⑦ 固体 ⑧石墨 ⑨
固体 ⑧石墨 ⑨ 固体。请回答下列问题:
固体。请回答下列问题:
(1)属于钠盐的有___________ (填序号,下同),属于非电解质的是___________ ,能导电的是___________ 。
(2)⑨在水中的电离方程式为___________ 。
(3)②与④反应的离子方程式为___________ 。
(4)写出③与⑦反应的化学方程式并用双线桥标出电子转移的方向和数目:___________ 。
 ④
④ 固体 ⑤Zn ⑥蔗糖 ⑦
固体 ⑤Zn ⑥蔗糖 ⑦ 固体 ⑧石墨 ⑨
固体 ⑧石墨 ⑨ 固体。请回答下列问题:
固体。请回答下列问题:(1)属于钠盐的有
(2)⑨在水中的电离方程式为
(3)②与④反应的离子方程式为
(4)写出③与⑦反应的化学方程式并用双线桥标出电子转移的方向和数目:
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】在氯氧化法处理含 的废水过程中,液氧在碱性条件下可以将氧化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
的废水过程中,液氧在碱性条件下可以将氧化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含 ,其浓度为
,其浓度为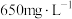 。现用氯氧化法处理,发生如下反应(其中
。现用氯氧化法处理,发生如下反应(其中 均为-3价、0均为-2价
均为-3价、0均为-2价 。该反应中,被氧化的元素是
。该反应中,被氧化的元素是___________ ,氧化产物是___________ 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气: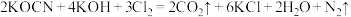 ,该反应中氧化产物与还原产物的微粒个数比为
,该反应中氧化产物与还原产物的微粒个数比为___________ 。请用单线桥法标出电子转移方向和数目。___________
 的废水过程中,液氧在碱性条件下可以将氧化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
的废水过程中,液氧在碱性条件下可以将氧化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。(1)某厂废水中含
 ,其浓度为
,其浓度为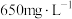 。现用氯氧化法处理,发生如下反应(其中
。现用氯氧化法处理,发生如下反应(其中 均为-3价、0均为-2价
均为-3价、0均为-2价 。该反应中,被氧化的元素是
。该反应中,被氧化的元素是(2)投入过量液氯,可将氰酸盐进一步氧化为氮气:
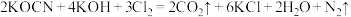 ,该反应中氧化产物与还原产物的微粒个数比为
,该反应中氧化产物与还原产物的微粒个数比为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】元素周期表中第ⅦA 族元素的单质及其化合物的用途广泛。
(1)能作为氯、溴、碘元素非金属性递变规律的判断依据是_______ (填序号)
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI 的热稳定性 d.HCl、HBr、HI 的酸性
(2)工业上,通过如下转化可制得 KClO3 晶体:
NaCl溶液 NaClO3
NaClO3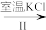
_____ KClO3晶体
①完成 I 中反应的总化学方程式:_______ NaCl+________ H2O =_______ NaClO3+_______ 。
②反应Ⅰ中 NaClO3是_______ 极(选填“阴”或“阳”极)产物。
③Ⅱ中转化的基本反应类型是_________ ,该反应过程能析出 KClO3晶体而无其它晶体析出的原因是_______ 。
(3)一定条件,在水溶液中 1 mol Cl-、ClOX-(x=1,2,3,4)的能量(kJ)相对大小如图所示。
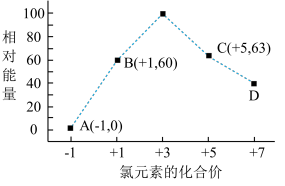
①D 是_______ (填离子符号)。
②B→A+C 反应的离子方程式为_______ ;生成 1mol C 时,________ (填吸收或放热)________ kJ 的能量
(1)能作为氯、溴、碘元素非金属性递变规律的判断依据是
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI 的热稳定性 d.HCl、HBr、HI 的酸性
(2)工业上,通过如下转化可制得 KClO3 晶体:
NaCl溶液
 NaClO3
NaClO3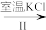
①完成 I 中反应的总化学方程式:
②反应Ⅰ中 NaClO3是
③Ⅱ中转化的基本反应类型是
(3)一定条件,在水溶液中 1 mol Cl-、ClOX-(x=1,2,3,4)的能量(kJ)相对大小如图所示。

①D 是
②B→A+C 反应的离子方程式为
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
⑴写出上述反应的化学方程式______
⑵NaH2PO2为______  填“正盐”或“酸式盐”
填“正盐”或“酸式盐”
⑶已知NaH2PO2水溶液pH > 7,次磷酸的电离方程式为______ ;NaH2PO2水溶液pH > 7的原因:______ 。
⑷H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为______  填化学式
填化学式 。
。
⑴写出上述反应的化学方程式
⑵NaH2PO2为
 填“正盐”或“酸式盐”
填“正盐”或“酸式盐”
⑶已知NaH2PO2水溶液pH > 7,次磷酸的电离方程式为
⑷H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为
 填化学式
填化学式 。
。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】 氧化性强,可以和浓盐酸直接反应。其反应方程式如下:___________
氧化性强,可以和浓盐酸直接反应。其反应方程式如下:___________ ___________
___________ 浓
浓 ___________
___________ ___________
___________ ___________
___________ ___________
___________
 配平该反应
配平该反应________ 。
 该反应中盐酸体现了哪两种性质?
该反应中盐酸体现了哪两种性质? ___________ 两种盐酸的物质的量之比是___________ 。
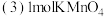 完全反应,被氧化的HCl的物质的量为
完全反应,被氧化的HCl的物质的量为___________ mol。
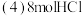 完全反应,产生的
完全反应,产生的 在标准状况下的体积为
在标准状况下的体积为___________ L。
 氧化性强,可以和浓盐酸直接反应。其反应方程式如下:___________
氧化性强,可以和浓盐酸直接反应。其反应方程式如下:___________ ___________
___________ 浓
浓 ___________
___________ ___________
___________ ___________
___________ ___________
___________
 配平该反应
配平该反应 该反应中盐酸体现了哪两种性质?
该反应中盐酸体现了哪两种性质? 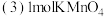 完全反应,被氧化的HCl的物质的量为
完全反应,被氧化的HCl的物质的量为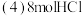 完全反应,产生的
完全反应,产生的 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次



