某一反应体系有反应物和生成物共五种物质: 、
、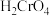 、
、 、
、 、
、 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程: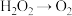 。
。
(1)该反应中的还原剂是_______ 。
(2)该反应中,发生还原反应的过程是________ →_________ 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目_________ 。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为______ 。
(5)已知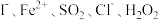 均有还原性,它们在酸性溶液中还原性的强弱顺序为:
均有还原性,它们在酸性溶液中还原性的强弱顺序为: 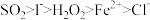 ,则下列反应不能发生的是
,则下列反应不能发生的是____ 。
A.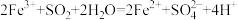
B.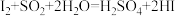
C.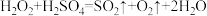
D.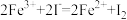
 、
、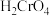 、
、 、
、 、
、 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程: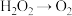 。
。(1)该反应中的还原剂是
(2)该反应中,发生还原反应的过程是
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为
(5)已知
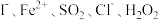 均有还原性,它们在酸性溶液中还原性的强弱顺序为:
均有还原性,它们在酸性溶液中还原性的强弱顺序为: 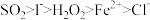 ,则下列反应不能发生的是
,则下列反应不能发生的是A.
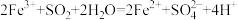
B.
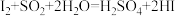
C.
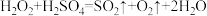
D.
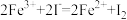
更新时间:2020-12-16 10:17:35
|
相似题推荐
【推荐1】镁与稀硝酸的反应为:Mg+HNO3(稀)——Mg(NO3)2+NO↑+H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目_____________ 。
(2)该反应中,还原产物是_________ ,HNO3表现了___________ (选填“还原性”、“氧化性”、“酸性”、“碱性”)。还原剂与氧化剂的的物质的量之比为____________ 。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________ 。
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目
(2)该反应中,还原产物是
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见表:
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是__________ 。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为__________ 。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有__________ 性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法表示出该反应电子转移的方向和数目______________ 。
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是__________ (填序号)。
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为__________ 。
| 化学式 | Cl2O | ClO2 | Cl2O7 |
| 沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式为
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法表示出该反应电子转移的方向和数目
(5)工业上制备ClO2的反应原理为:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是
A.还原性 B.氧化性 C.酸性
②若上述反应中产生0.1molClO2,则转移的电子数为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】钠是一种非常活泼、具有广泛应用的金属。
(1)金属钠非常活泼,通常保存在___________ 里,以隔绝空气。
(2)汽车安全气囊的气体发生剂 :可由金属钠生产。某汽车安全气囊内含
:可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。
①当汽车发生较严重的碰撞时,引发 分解
分解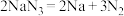 ,从而为气囊充气。用单线桥表示该反应电子转移的方向数目
,从而为气囊充气。用单线桥表示该反应电子转移的方向数目___________ 。
②产生的Na立即与 发生置换反应生成
发生置换反应生成 ,化学方程式是:
,化学方程式是:___________ 。
③ 是冷却剂,吸收产气过程释放的热量。
是冷却剂,吸收产气过程释放的热量。 起冷却作用时发生反应的化学方程式为:
起冷却作用时发生反应的化学方程式为:___________ 。
(3)工业通过电解NaCl生产金属钠: ,过程如图:
,过程如图:
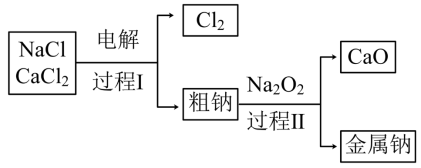
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入 从而把培点降至约580℃。
从而把培点降至约580℃。
①NaCl固体加热至熔融状态,目的是___________ 。
②粗钠中含有少量杂质Ca,过程Ⅱ在加热条件下除去Ca的化学方程式是:___________ 。
③过程Ⅰ中, 能发生像NaCl那样的电解反应而被消耗。但在过程1中
能发生像NaCl那样的电解反应而被消耗。但在过程1中 却不断地被重新生成,原因是:
却不断地被重新生成,原因是:___________ 。
(1)金属钠非常活泼,通常保存在
(2)汽车安全气囊的气体发生剂
 :可由金属钠生产。某汽车安全气囊内含
:可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。①当汽车发生较严重的碰撞时,引发
 分解
分解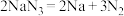 ,从而为气囊充气。用单线桥表示该反应电子转移的方向数目
,从而为气囊充气。用单线桥表示该反应电子转移的方向数目②产生的Na立即与
 发生置换反应生成
发生置换反应生成 ,化学方程式是:
,化学方程式是:③
 是冷却剂,吸收产气过程释放的热量。
是冷却剂,吸收产气过程释放的热量。 起冷却作用时发生反应的化学方程式为:
起冷却作用时发生反应的化学方程式为:(3)工业通过电解NaCl生产金属钠:
 ,过程如图:
,过程如图:
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入
 从而把培点降至约580℃。
从而把培点降至约580℃。①NaCl固体加热至熔融状态,目的是
②粗钠中含有少量杂质Ca,过程Ⅱ在加热条件下除去Ca的化学方程式是:
③过程Ⅰ中,
 能发生像NaCl那样的电解反应而被消耗。但在过程1中
能发生像NaCl那样的电解反应而被消耗。但在过程1中 却不断地被重新生成,原因是:
却不断地被重新生成,原因是:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)一种新型的人工固氮原理如图a所示,该过程中属于氧化还原反应的是_________ (填反应编号)。_________ 。
(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放,SCR(选择性催化还原)工作原理如图b所示,NSR(NOx储存还原)工作原理如图c所示。_________ 。
②SCR催化过程中,当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒,用化学方程式表示(NH4)2SO4的形成:_________ 。
③NSR转化中,通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原,其中储存NOx的物质是_________ 。
④用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图d表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的H2与Ba(NO3)2的物质的量之比是_________ 。
经过简单猜测,小组成员认为该氮肥的有效成分为铵盐,为了验证猜想,他们取了少量氮肥配制为溶液,后续应当进行的操作为_________ 。
(1)一种新型的人工固氮原理如图a所示,该过程中属于氧化还原反应的是

(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放,SCR(选择性催化还原)工作原理如图b所示,NSR(NOx储存还原)工作原理如图c所示。

②SCR催化过程中,当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒,用化学方程式表示(NH4)2SO4的形成:
③NSR转化中,通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原,其中储存NOx的物质是
④用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图d表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的H2与Ba(NO3)2的物质的量之比是

经过简单猜测,小组成员认为该氮肥的有效成分为铵盐,为了验证猜想,他们取了少量氮肥配制为溶液,后续应当进行的操作为
您最近一年使用:0次
【推荐2】北京市施行的《北京市小规模食品生产经营管理规定》中明确规定:小规模食品生产经营者不得购进、存放、使用亚硝酸盐等易滥用的食品添加剂。
(1)根据物质组成上分类,亚硝酸钠 属于
属于_______  填序号
填序号
A.钠盐 B.硝酸盐 C.氧化物
(2)实验室中,亚硝酸钠可用来处理过量的叠氮化钠,有关反应的化学方程式如下:

①上述两个反应中,属于氧化还原反应的是_______ (填“ ”或“
”或“ ”
” 。
。
②其中的氧化还原反应的氧化剂是_______  填化学式
填化学式 ,用双线桥法表示该氧化还原反应中电子转移情况:
,用双线桥法表示该氧化还原反应中电子转移情况:_______ 。
(3)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒。解毒过程的说法中,正确的是_______ 。
A.亚硝酸钠是还原剂 B.维生素C是氧化剂
C.维生素C能把铁离子还原成为亚铁离子 D.亚硝酸钠被还原
②鉴别方法如下:将样品盐放入稀硫酸与另外一种溶液(溶质为X)的混合液中,振荡,再滴加淀粉溶液如果溶液显蓝色,则可以证明该样品盐是亚硝酸钠;如果溶液无变化,则可以证明该样品盐为氯化钠。X与亚硝酸钠发生的反应可表示为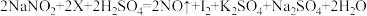 (已配平),其中X是
(已配平),其中X是_______ (填化学式)。
(1)根据物质组成上分类,亚硝酸钠
 属于
属于 填序号
填序号
A.钠盐 B.硝酸盐 C.氧化物
(2)实验室中,亚硝酸钠可用来处理过量的叠氮化钠,有关反应的化学方程式如下:

①上述两个反应中,属于氧化还原反应的是
 ”或“
”或“ ”
” 。
。②其中的氧化还原反应的氧化剂是
 填化学式
填化学式 ,用双线桥法表示该氧化还原反应中电子转移情况:
,用双线桥法表示该氧化还原反应中电子转移情况:(3)亚硝酸钠外观与食盐相似,且均有咸味。
①若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒。解毒过程的说法中,正确的是
A.亚硝酸钠是还原剂 B.维生素C是氧化剂
C.维生素C能把铁离子还原成为亚铁离子 D.亚硝酸钠被还原
②鉴别方法如下:将样品盐放入稀硫酸与另外一种溶液(溶质为X)的混合液中,振荡,再滴加淀粉溶液如果溶液显蓝色,则可以证明该样品盐是亚硝酸钠;如果溶液无变化,则可以证明该样品盐为氯化钠。X与亚硝酸钠发生的反应可表示为
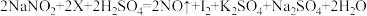 (已配平),其中X是
(已配平),其中X是
您最近一年使用:0次
【推荐3】(1)将SO2通入氯化钡溶液中无现象;若将SO2通入硝酸钡溶液中,有白色沉淀产生,其化学反应方程式如下(未配平):SO2+Ba(NO3)2+H2O→BaSO4↓+HNO3+NO↑
①配平上述化学反应方程式:___ 。
②该反应中,___ 元素发生氧化反应,氧化剂是___ (写化学式)。氧化产物与还原产物的物质的量之比为___ 。
③当反应消耗19.2gSO2时,反应中转移电子____ mol。
(2)维生素C又称“抗坏血酸”,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有___ (填氧化性或还原性)。
①配平上述化学反应方程式:
②该反应中,
③当反应消耗19.2gSO2时,反应中转移电子
(2)维生素C又称“抗坏血酸”,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有
您最近一年使用:0次



