关于有效碰撞理论,下列说法不正确 的是
| A.化学反应的实质是活化分子有合适取向时的有效碰撞 |
| B.增大反应物浓度能够增大活化分子百分数,化学反应速率一定增大 |
| C.升高温度,活化分子百分数增加,化学反应速率一定增大 |
| D.催化剂能改变反应历程和活化能,影响化学反应速率 |
19-20高二上·福建三明·阶段练习 查看更多[6]
山西省太原市第五中学校2023-2024学年高二上学期10月月考化学试题福建省福州铜盘中学2021-2022学年高二上学期12月月考化学试题(已下线)2.1.3 活化能(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)海南省北京师范大学万宁附中2020-2021学年高一下学期期中考试化学试题福建省泉州第十六中学2020-2021学年高二上学期期中考试化学(选考班)试题福建省三明市泰宁县福建省泰宁第一中学2019-2020学年高二上学期第二次阶段考试化学试题
更新时间:2020-12-08 10:38:52
|
相似题推荐
单选题
|
较易
(0.85)
名校
解题方法
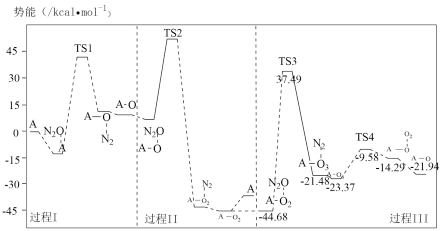
【推荐1】NO与CO在金属铑(Rh)的催化下发生反应:2NO(g)+CO(g) N2O(g)+CO2(g) ΔH,该反应过程经历如下两步:
N2O(g)+CO2(g) ΔH,该反应过程经历如下两步:
反应I:NO(g)+CO(g)+Rh(s) RhN(s)+CO2(g) ΔH1=-33.44kJ·mol-1
RhN(s)+CO2(g) ΔH1=-33.44kJ·mol-1
反应II:RhN(s)+NO(g) Rh(s)+N2O ΔH2=-319.35kJ·mol-1
Rh(s)+N2O ΔH2=-319.35kJ·mol-1
如图所示为该反应在无催化剂(a)和有催化剂(b)时反应过程的能量变化对比图。下列有关判断正确的是

 N2O(g)+CO2(g) ΔH,该反应过程经历如下两步:
N2O(g)+CO2(g) ΔH,该反应过程经历如下两步:反应I:NO(g)+CO(g)+Rh(s)
 RhN(s)+CO2(g) ΔH1=-33.44kJ·mol-1
RhN(s)+CO2(g) ΔH1=-33.44kJ·mol-1反应II:RhN(s)+NO(g)
 Rh(s)+N2O ΔH2=-319.35kJ·mol-1
Rh(s)+N2O ΔH2=-319.35kJ·mol-1如图所示为该反应在无催化剂(a)和有催化剂(b)时反应过程的能量变化对比图。下列有关判断正确的是

| A.ΔH=-285.91 kJ·mol-1 |
B.E1为反应2NO(g)+CO(g) N2O(g)+CO2(g)不使用催化剂和使用催化剂的活化能之差 N2O(g)+CO2(g)不使用催化剂和使用催化剂的活化能之差 |
| C.E2为使用催化剂后降低的活化能 |
| D.使用合适的催化剂可降低反应的活化能,提高平衡转化率 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】其他条件不变,增大反应物的浓度能增大反应速率的原因是
| A.单位体积内分子数增多 | B.单位体积内活化分子数增多 |
| C.活化分子百分数增大 | D.分子碰撞的次数增多 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】锰系氧化物催化降解甲醛具有去除效率高无二次污染等优点,其中一种催化机理如图所示。下列说法错误的是
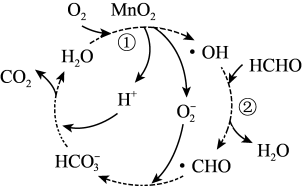

A. 为中间产物 为中间产物 |
B. 降低了反应①的活化能 降低了反应①的活化能 |
| C.反应②中有碳氧键断裂 |
D.该机理的总反应的化学方程式为 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】NO是大气污染物之一,常用 还原。
还原。 与
与 的反应历程如图所示。下列说法错误的是
的反应历程如图所示。下列说法错误的是
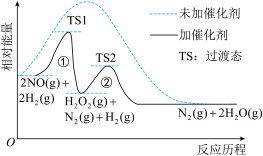
 还原。
还原。 与
与 的反应历程如图所示。下列说法错误的是
的反应历程如图所示。下列说法错误的是
| A.催化剂能降低反应的活化能,提高活化分子百分数 |
| B.反应②的活化能小于反应①的活化能 |
C.反应①、②和总反应的 都小于0 都小于0 |
D.催化剂能提高总反应中 的平衡转化率 的平衡转化率 |
您最近一年使用:0次

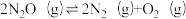 的势能曲线示意图如下(…表示吸附作用,A表示催化剂,TS表示过渡态分子)。下列说法错误的是
的势能曲线示意图如下(…表示吸附作用,A表示催化剂,TS表示过渡态分子)。下列说法错误的是