肼又称联氨, 是重要的化工原料。某兴趣小组以尿素为原料按下列流程制备水合肼(N2H4·H2O),并进一步得到无水肼。
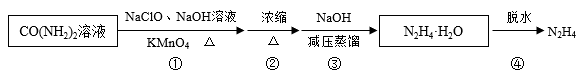
已知:水合肼:沸点(118.5℃),有强还原性,属于弱碱(类似NH3·H2O);
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
N2H4·H2O+2I2=N2↑+4HI+H2O
实验装置如图所示:
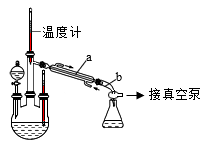
请回答:
(1)仪器a的名称为_________ 。
(2)工业上还可以用NH3和NaClO溶液反应制取水合肼,写出反应的化学方程式______________ 。
(3)用化学用语解释N2H4的水溶液呈碱性的原因___________________ 。
(4)下列操作或描述不正确的是________ 。
A.步骤①,NaOH和NaClO的混合溶液可以用过量的NaOH溶液中通入Cl2来制备
B.步骤①,需要使用温度计控制温度
C.步骤①,为了使CO(NH2)2完全反应,分液漏斗中盛放CO(NH2)2溶液
D.步骤③,采用减压蒸馏可使产品在较低温度下气化,避免温度过高而分解
(5)称取10.00 g水合肼样品,加水配成1000 mL溶液,从中取出10.00 mL溶液与0.200 mol/L的I2溶液反应。如完全反应时消耗I2溶液16.40 mL,则样品中水合肼(N2H4·H2O)的质量分数为_________ 。

已知:水合肼:沸点(118.5℃),有强还原性,属于弱碱(类似NH3·H2O);
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
N2H4·H2O+2I2=N2↑+4HI+H2O
实验装置如图所示:

请回答:
(1)仪器a的名称为
(2)工业上还可以用NH3和NaClO溶液反应制取水合肼,写出反应的化学方程式
(3)用化学用语解释N2H4的水溶液呈碱性的原因
(4)下列操作或描述不正确的是
A.步骤①,NaOH和NaClO的混合溶液可以用过量的NaOH溶液中通入Cl2来制备
B.步骤①,需要使用温度计控制温度
C.步骤①,为了使CO(NH2)2完全反应,分液漏斗中盛放CO(NH2)2溶液
D.步骤③,采用减压蒸馏可使产品在较低温度下气化,避免温度过高而分解
(5)称取10.00 g水合肼样品,加水配成1000 mL溶液,从中取出10.00 mL溶液与0.200 mol/L的I2溶液反应。如完全反应时消耗I2溶液16.40 mL,则样品中水合肼(N2H4·H2O)的质量分数为
19-20高二·浙江·期中 查看更多[1]
(已下线)【浙江新东方】93
更新时间:2020-12-18 11:05:10
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】氯化镍(NiCl2·6H2O)常用于电镀、陶瓷等工业,某实验室以单质Ni为原料制取氯化镍的实验步骤如下:

已知:①Fe(OH)3完全沉淀pH为3.2;Ni(OH)2开始沉淀pH为7.2,完全沉淀pH为9.2。
②NiCl2易水解,从溶液中获取NiCl2·6H2O须控制pH<2。
(1)在三颈烧瓶中(装置见图)加入一定量Ni粉和水,通入空气,滴入稀硝酸和稀硫酸的混酸,至反应结束,过滤,制得NiSO4溶液。
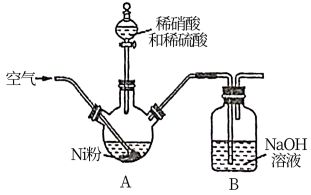
①反应过程中,为提高稀硝酸的利用率,在不改变投料比的情况下,可采取的合理措施有___________ 。
②向A装置中通入空气的作用是搅拌、___________ 。
③若镍粉过量,判断反应完成的现象是___________ 。
(2)将所得NiSO4溶液与NaHCO3溶液混合反应得到NiCO3·Ni(OH)2沉淀,过滤,洗涤。
①沉淀反应的离子方程式为___________ 。
②检验NiCO3·Ni(OH)2沉淀是否洗涤完全的方法是___________ 。
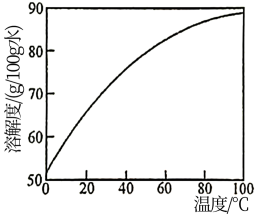
(3)在NiCO3·Ni(OH)2固体中混有少量Fe(OH)3,请补充完整由NiCO3·Ni(OH)2固体制备NiCl2·6H2O的实验方案:向NiCO3·Ni(OH)2固体中加入盐酸,边加边搅拌,___________ 。
[NiCl2的溶解度曲线如图所示。实验中须选用的仪器和试剂:pH计、盐酸、乙醇等]

已知:①Fe(OH)3完全沉淀pH为3.2;Ni(OH)2开始沉淀pH为7.2,完全沉淀pH为9.2。
②NiCl2易水解,从溶液中获取NiCl2·6H2O须控制pH<2。
(1)在三颈烧瓶中(装置见图)加入一定量Ni粉和水,通入空气,滴入稀硝酸和稀硫酸的混酸,至反应结束,过滤,制得NiSO4溶液。

①反应过程中,为提高稀硝酸的利用率,在不改变投料比的情况下,可采取的合理措施有
②向A装置中通入空气的作用是搅拌、
③若镍粉过量,判断反应完成的现象是
(2)将所得NiSO4溶液与NaHCO3溶液混合反应得到NiCO3·Ni(OH)2沉淀,过滤,洗涤。
①沉淀反应的离子方程式为
②检验NiCO3·Ni(OH)2沉淀是否洗涤完全的方法是
(3)在NiCO3·Ni(OH)2固体中混有少量Fe(OH)3,请补充完整由NiCO3·Ni(OH)2固体制备NiCl2·6H2O的实验方案:向NiCO3·Ni(OH)2固体中加入盐酸,边加边搅拌,
[NiCl2的溶解度曲线如图所示。实验中须选用的仪器和试剂:pH计、盐酸、乙醇等]

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】研究物质的合成或制备是有机化学、无机化学的重要任务之一。
(1)某实验小组探究实验室制备无水氯化镁的方法,设计了图1装置。
①分液漏斗中的A物质是______________ (填试剂名称)。
②利用中学常见的仪器,空白方框内补充完整实验装置。___________
可选择的试剂有:A.稀NaOH溶液 B.无水氯化钙 C.稀硫酸 D.浓硫酸
③假设实验过程中MgCl2·6H2O未水解,不用任何试剂用最简单的方法检验MgCl2·6H2O是否完全转化为MgCl2。写出实验方法___________ 。
(2)实验室制备并收集纯净乙烯。
①有的同学通过乙醇制备乙烯,写出相关化学方程式____________ ;该实验除乙醇外,所需的试剂或用品(不包括仪器)有___________________ 。
②有的同学探究其它制备乙烯的方法,他设计了图2装置制备乙烯。实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体。请分析气体产率很低的原因主要是_________ 。为增大气体产率,在右图装置的基础上,提出一点改进措施:_____ 。
(1)某实验小组探究实验室制备无水氯化镁的方法,设计了图1装置。
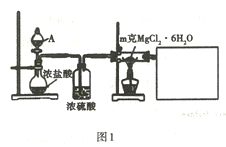
①分液漏斗中的A物质是
②利用中学常见的仪器,空白方框内补充完整实验装置。
可选择的试剂有:A.稀NaOH溶液 B.无水氯化钙 C.稀硫酸 D.浓硫酸
③假设实验过程中MgCl2·6H2O未水解,不用任何试剂用最简单的方法检验MgCl2·6H2O是否完全转化为MgCl2。写出实验方法
(2)实验室制备并收集纯净乙烯。
①有的同学通过乙醇制备乙烯,写出相关化学方程式
②有的同学探究其它制备乙烯的方法,他设计了图2装置制备乙烯。实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体。请分析气体产率很低的原因主要是
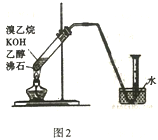
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】二硫化钼是重要的固体润滑剂,被誉为“高级固体润滑油之王”。利用低品相的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如图:
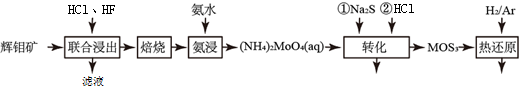
(1)(NH4)2MoO4中Mo的化合价为___________ 。
(2)“转化”中第一步加入Na2S后,(NH4)2MoO4转化为(NH4)2MoS4,写出第二步(NH4)2MoS4与盐酸生成MoS3的离子方程式为___________ 。
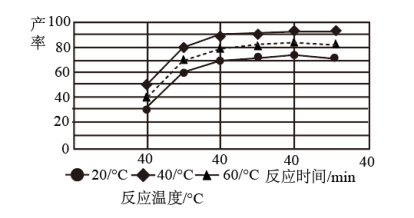
(3)由图分析可知产生MoS3沉淀的流程中选择的最优温度和时间是___________ ,利用化学平衡原理 分析低于或高于最优温度时,MoS3的产率均下降的原因___________ 。
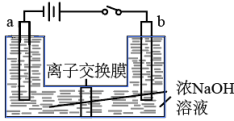
(4)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如图所示。b电极的材料为___________ (填“镍”或“钼”),电极反应为___________ 。
(5)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,若溶液中某离子浓度≤1×10-5mol/L时可认为该离子已完全沉淀。不纯的Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO (忽略溶液体积变化),则当SO
(忽略溶液体积变化),则当SO 完全沉淀时,溶液中c(MoO
完全沉淀时,溶液中c(MoO )<
)<___________ mol/L(保留2位有效数字)。

(1)(NH4)2MoO4中Mo的化合价为
(2)“转化”中第一步加入Na2S后,(NH4)2MoO4转化为(NH4)2MoS4,写出第二步(NH4)2MoS4与盐酸生成MoS3的离子方程式为
(3)由图分析可知产生MoS3沉淀的流程中选择的最优温度和时间是

(4)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如图所示。b电极的材料为

(5)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,若溶液中某离子浓度≤1×10-5mol/L时可认为该离子已完全沉淀。不纯的Na2MoO4溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO
 (忽略溶液体积变化),则当SO
(忽略溶液体积变化),则当SO 完全沉淀时,溶液中c(MoO
完全沉淀时,溶液中c(MoO )<
)<
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】过氧化钙可以用于改善地表水质,处理含重金属粒子的废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:

已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是_____________________________ 。
(2)检验“水洗”是否合格的方法是_______________________________________ 。
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是_________________ 。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
[已知:I2+2S2O32-===2I-+S4O62-]
①第一步发生反应的化学方程式为___________________________________________ ;
CaO2的质量分数为____________ (用字母表示)。
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________ (填“不受影响”、“偏低”或“偏高”),原因是__________________ 。

已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是
(2)检验“水洗”是否合格的方法是
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
[已知:I2+2S2O32-===2I-+S4O62-]
①第一步发生反应的化学方程式为
CaO2的质量分数为
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】已知铁生锈的过程为:Fe→Fe(OH)2→Fe(OH)3→Fe2O3•xH2O.又知草酸(H2C2O4)分解的化学方程式为 H2C2O4 CO↑+CO2↑+H2O,某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3•xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑+CO2↑+H2O,某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3•xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲同学利用草酸分解产生的混合气体和如所示装置测定其中一种锈铁的组成。
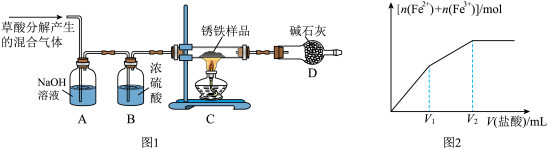
主要操作为:取锈铁样品12.6g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4g,装置D增重8.4g。
①钢铁在潮湿空气中发生电化学腐蚀时,其负极的电极反应式为______ 。
②装置A的作用是______ ,装置B的作用是 ______ 。
③根据以上数据能否测定出锈铁的组成?答:______ (填“能”或“不能”)。
④该装置还存在的一个明显的缺陷是______ 。
(2)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4g,而装置E增重1.8g,则x=______ ;m(Fe):m (Fe2O3•xH2O)= ______ 。
(3)丙同学取少量的另外一种锈铁片放在烧杯中,然后逐滴加入稀盐酸,实验测知所得溶液中Fe2+、Fe3+的物质的量之和与加入稀盐酸的体积关系如图2示,此锈铁中n(Fe):n(Fe2O3•xH2O)的取值范围是______ 。(填字母)
a.大于1 b.等于1 c.小于1
 CO↑+CO2↑+H2O,某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3•xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑+CO2↑+H2O,某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3•xH2O),进行了以下探究,请你参与并完成对有关问题的解答。 (1)甲同学利用草酸分解产生的混合气体和如所示装置测定其中一种锈铁的组成。

主要操作为:取锈铁样品12.6g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4g,装置D增重8.4g。
①钢铁在潮湿空气中发生电化学腐蚀时,其负极的电极反应式为
②装置A的作用是
③根据以上数据能否测定出锈铁的组成?答:
④该装置还存在的一个明显的缺陷是
(2)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4g,而装置E增重1.8g,则x=
(3)丙同学取少量的另外一种锈铁片放在烧杯中,然后逐滴加入稀盐酸,实验测知所得溶液中Fe2+、Fe3+的物质的量之和与加入稀盐酸的体积关系如图2示,此锈铁中n(Fe):n(Fe2O3•xH2O)的取值范围是
a.大于1 b.等于1 c.小于1
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硫酸铁铵[NH4Fe(SO4)2•xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如图所示:

回答下列问题:
(1)步骤②需要加热的目的是________ ,温度保持80-95℃,采用的合适加热方式是________ 。
(2)步骤③中选用足量的H2O2,理由是______________________ 。
(3)步骤⑤的具体实验操作有________ ,经干燥得到硫酸铁铵晶体样品。
(4)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为________________ 。

回答下列问题:
(1)步骤②需要加热的目的是
(2)步骤③中选用足量的H2O2,理由是
(3)步骤⑤的具体实验操作有
(4)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】莫尔盐[(NH4)2Fe(SO4)2·6H2O]在定量分析中常用作标定高锰酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。回答下列问题:
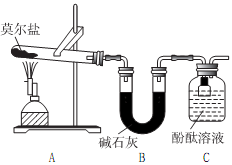
(1)甲组同学按照如图所示的装置,通过实验检验莫尔盐晶体强热时的分解产物。装置C中可观察到的现象是__________ ,由此可知莫尔盐晶体分解的产物中有__________ 。装置B的主要作用是__________ 。
(2)乙组同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。
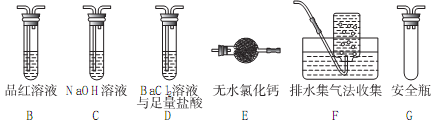
①乙组同学的实验中,装置依次连接的合理顺序为A→________ →________ →________ →________ →________ 。
②装置D中足量盐酸的作用是__________ ;含有SO3的实验现象是__________ ;含有SO2的实验现象是__________ 。
(3)称取1.96g莫尔盐晶体,制成溶液,用未知浓度的KMnO4酸性溶液进行滴定。
①滴定时,将KMnO4酸性溶液装在__________ (填“酸式”或“碱式”)滴定管。试写出该滴定过程中的离子方程式:__________ ;
②判断该反应到达滴定终点的现象为__________ ;
(4)设计实验证明:莫尔盐是否已氧化变质__________ 。

(1)甲组同学按照如图所示的装置,通过实验检验莫尔盐晶体强热时的分解产物。装置C中可观察到的现象是
(2)乙组同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。

①乙组同学的实验中,装置依次连接的合理顺序为A→
②装置D中足量盐酸的作用是
(3)称取1.96g莫尔盐晶体,制成溶液,用未知浓度的KMnO4酸性溶液进行滴定。
①滴定时,将KMnO4酸性溶液装在
②判断该反应到达滴定终点的现象为
(4)设计实验证明:莫尔盐是否已氧化变质
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某化学兴趣小组为了探究SO2的性质,按下图所示装置进行实验。
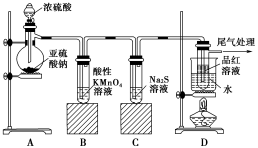
请回答下列问题:
(1)装置A中发生反应的化学方程式为_______ 。
(2)实验过程中,装置B、C中产生的现象分别是_______ 、_______ ,这些现象分别说明SO2具有的性质是_______ 和_______ 。
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_______ 。
(4)尾气可采用_______ 溶液吸收。

请回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)实验过程中,装置B、C中产生的现象分别是
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象
(4)尾气可采用
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】(1)某学生用实验室常见的酸、碱、盐和金属作为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成图甲所示的气体简易发生器,该装置中装有铜丝隔板,利用该装置可制取的气体有(写两种)_____________________ 。
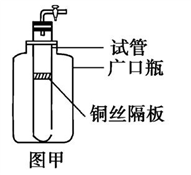
(2)若将铜丝隔板改为铁丝隔板,则该装置可制取的气体是__________ ,写出反应的离子方程式:____________________________ 。
(3)用图乙所示(夹持仪器省略)装置进行实验,将液体A逐滴加入固体B中,回答下列问题:
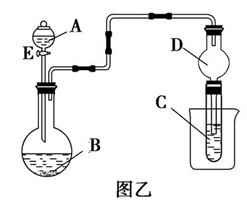
①图乙中D装置在实验中的作用是_____________________ ;
②若A为浓盐酸,B为KMnO4,C为淀粉−碘化钾溶液,旋开E后,C中的现象为________________ ,反应的化学方程式是__________________ ;
③若A为浓硫酸(70%),B为Na2SO3,C为酸性KMnO4溶液,旋开E后,C中的现象为______ ,反应的化学方程式是________________________ ;
④若A为30%的H2O2溶液,B为MnO2,C为饱和H2S溶液,旋开E后,C中的现象为_____________ ,反应的化学方程式是______________________ ;
⑤若A为稀盐酸,B为大理石,C为Na2SiO3溶液,旋开E后,C中的现象为________________ ,反应的化学方程式是_________________________ 。

(2)若将铜丝隔板改为铁丝隔板,则该装置可制取的气体是
(3)用图乙所示(夹持仪器省略)装置进行实验,将液体A逐滴加入固体B中,回答下列问题:

①图乙中D装置在实验中的作用是
②若A为浓盐酸,B为KMnO4,C为淀粉−碘化钾溶液,旋开E后,C中的现象为
③若A为浓硫酸(70%),B为Na2SO3,C为酸性KMnO4溶液,旋开E后,C中的现象为
④若A为30%的H2O2溶液,B为MnO2,C为饱和H2S溶液,旋开E后,C中的现象为
⑤若A为稀盐酸,B为大理石,C为Na2SiO3溶液,旋开E后,C中的现象为
您最近一年使用:0次



