25℃时,0.01 mol/L盐酸溶液的pH是
| A.2 | B.5 | C.9 | D.12 |
更新时间:2020-12-22 10:35:11
|
【知识点】 酸碱混合时的定性判断及计算解读
相似题推荐
单选题
|
容易
(0.94)
【推荐1】常温下,将0.1 mol·L-1 NaOH溶液与0.04 mol·L-1硫酸溶液等体积混合,所得溶液的pH等于
| A.2.0 | B.4.0 | C.10.0 | D.12.0 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】某温度下,在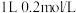 的氨水中存在
的氨水中存在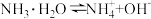 ,当达到电离能平衡时,已电离的
,当达到电离能平衡时,已电离的 为
为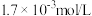 ,下列说法正确的是
,下列说法正确的是
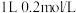 的氨水中存在
的氨水中存在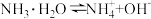 ,当达到电离能平衡时,已电离的
,当达到电离能平衡时,已电离的 为
为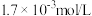 ,下列说法正确的是
,下列说法正确的是A.该溶液中 的粒子数为 的粒子数为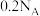 |
B.该温度下 的电离常数 的电离常数 约为 约为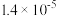 |
C.加水稀释后电离平衡正向移动,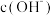 增大 增大 |
D.与同浓度同体积的盐酸混合后,混合溶液的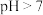 |
您最近一年使用:0次



