碳酸锂广泛应用于陶瓷和医药等领域。已 -锂辉石(主要成分为Li2O
-锂辉石(主要成分为Li2O Al2O3
Al2O3 4SiO2)为原材料制备Li2CO3的工艺流程如下:
4SiO2)为原材料制备Li2CO3的工艺流程如下:
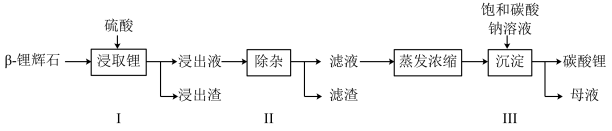
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)步骤Ⅰ前,B-锂辉石要粉碎成细颗粒的目的是_____________ .
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________ (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤II中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂技金属离子有
_________________ 。
(4)步骤III中,生成沉淀的离子方程式为________________ 。
(5)从母液中可回收的主要物质是__________________ 。
 -锂辉石(主要成分为Li2O
-锂辉石(主要成分为Li2O Al2O3
Al2O3 4SiO2)为原材料制备Li2CO3的工艺流程如下:
4SiO2)为原材料制备Li2CO3的工艺流程如下:
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)步骤Ⅰ前,B-锂辉石要粉碎成细颗粒的目的是
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入
(3)步骤II中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂技金属离子有
(4)步骤III中,生成沉淀的离子方程式为
(5)从母液中可回收的主要物质是
2010·广东·高考真题 查看更多[6]
更新时间:2016-12-09 00:34:51
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】铁红(主要成分为Fe2O3)是一种用途广泛的颜料,用废铁屑制备铁红的流程如下:
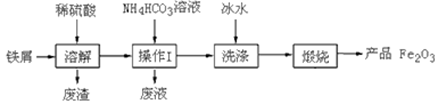
(1)操作Ⅰ的名称是__________________________ 。
(2)检验FeCO3沉淀是否洗净的实验方法是__________________________ 。
(3)在空气中煅烧FeCO3的化学方程式是____________________________ 。
(4)称取3.0 g 产品,用稀硫酸溶解,逐滴加入0.10 mol·L-1 KMnO4溶液20.00 mL,二者恰好反应完全。若此产品中只含有FeO、Fe2O3,求算产品中Fe2O3的质量分数,写出计算过程。(已知:10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O)________________

(1)操作Ⅰ的名称是
(2)检验FeCO3沉淀是否洗净的实验方法是
(3)在空气中煅烧FeCO3的化学方程式是
(4)称取3.0 g 产品,用稀硫酸溶解,逐滴加入0.10 mol·L-1 KMnO4溶液20.00 mL,二者恰好反应完全。若此产品中只含有FeO、Fe2O3,求算产品中Fe2O3的质量分数,写出计算过程。(已知:10FeSO4+2KMnO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】铜及其化合物在生产、生活中有广泛的应用。印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路铜板制备CuCl2•2H2O,实验室模拟回收过程如图:

(1)证明步骤1所加FeCl3溶液过量的方法是____ 。
(2)步骤2中所加的氧化剂较适宜的有____ 。
(3)步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的试剂1是___ 。
A.NH3•H2O B.NaOH C.Cu(OH)2
(4)蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是____ (写出离子反应方程式并结合简要的文字说明),再经____ (某实验操作方法)、过滤得到CuCl2•2H2O。
方法一:用FeCl3溶液浸泡印刷电路铜板制备CuCl2•2H2O,实验室模拟回收过程如图:

(1)证明步骤1所加FeCl3溶液过量的方法是
(2)步骤2中所加的氧化剂较适宜的有
| A.HNO3 | B.H2O2 | C.KMnO4 | D.氯水 |
A.NH3•H2O B.NaOH C.Cu(OH)2
(4)蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】实验室由铁泥(主要成分为铁的氧化物)制备软磁性材料α-Fe2O3。其主要实验流程如下:

(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有_________ (填序号)。
A.适当升高酸浸温度 B.适当缩短酸浸时间 C.适当加快搅拌速度
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成_______ (填化学式);检验Fe3+是否还原完全的实验操作是_______ 。
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是_________ 。[Ksp(CaF2)=5.3×10-9、Ka(HF)=6.3×10-4]
(4)沉铁。将提纯后的FeSO4溶液与NH3·H2O-NH4HCO3混合溶液反应,生成FeCO3沉淀。生成FeCO3沉淀的离子方程式为____________________________________ 。

(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有
A.适当升高酸浸温度 B.适当缩短酸浸时间 C.适当加快搅拌速度
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是
(4)沉铁。将提纯后的FeSO4溶液与NH3·H2O-NH4HCO3混合溶液反应,生成FeCO3沉淀。生成FeCO3沉淀的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某兴趣小组模拟侯氏制碱法的实验流程如下:
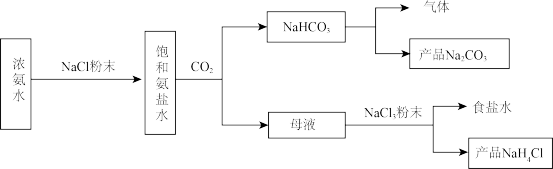
(1)二氧化碳通入饱和氨盐水的装置如图所示。
①图A装置制备二氧化碳气体,该装置主要玻璃仪器名称是_______ 。
②用图B装置对二氧化碳气体进行净化,在图中方框内补齐净化装置和净化试剂_______ 。

(2)母液中加入NaCl固体并通入 ,在
,在_______ (填温度范围)下析出 。
。
(3)验证产品纯碱中是否含有杂质NaCl的方法:取少量试样溶于水后,_______ 。
(4)由实验流程分析可知,可以循环利用的物质是_______ (用化学式表示)。
(5)称取制得的 (杂质NaCl)5.20g,配制成100mL溶液,取出20mL,用0.6000mol/L标准盐酸滴定(甲基橙做指示剂),消耗盐酸溶液体积为20.20mL。
(杂质NaCl)5.20g,配制成100mL溶液,取出20mL,用0.6000mol/L标准盐酸滴定(甲基橙做指示剂),消耗盐酸溶液体积为20.20mL。
①滴定终点颜色变化_______ 。
②制得的 纯度
纯度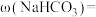
_______ 。
③若滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测定的 含量
含量_______ (填“偏高”、“偏低”或“无影响”)。
(6)图为实验测得0.1 mol/L 溶液在升温过程中(不考虑水挥发)的pH变化曲线,分析:
溶液在升温过程中(不考虑水挥发)的pH变化曲线,分析:
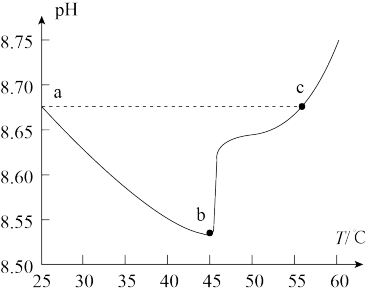
①a、c两点的溶液中由水电离出来的 a
a_______ c(填“>”、“<”或“=”)。
②bc段,随着温度升高pH增大,其原因是:_______ 。

(1)二氧化碳通入饱和氨盐水的装置如图所示。
①图A装置制备二氧化碳气体,该装置主要玻璃仪器名称是
②用图B装置对二氧化碳气体进行净化,在图中方框内补齐净化装置和净化试剂

(2)母液中加入NaCl固体并通入
 ,在
,在 。
。| 温度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl溶解度(g/100g水) | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
 溶解度(g/100g水) 溶解度(g/100g水) | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 |
(4)由实验流程分析可知,可以循环利用的物质是
(5)称取制得的
 (杂质NaCl)5.20g,配制成100mL溶液,取出20mL,用0.6000mol/L标准盐酸滴定(甲基橙做指示剂),消耗盐酸溶液体积为20.20mL。
(杂质NaCl)5.20g,配制成100mL溶液,取出20mL,用0.6000mol/L标准盐酸滴定(甲基橙做指示剂),消耗盐酸溶液体积为20.20mL。①滴定终点颜色变化
②制得的
 纯度
纯度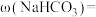
③若滴定管用蒸馏水洗涤后,直接注入标准盐酸溶液进行滴定,则测定的
 含量
含量(6)图为实验测得0.1 mol/L
 溶液在升温过程中(不考虑水挥发)的pH变化曲线,分析:
溶液在升温过程中(不考虑水挥发)的pH变化曲线,分析:
①a、c两点的溶液中由水电离出来的
 a
a②bc段,随着温度升高pH增大,其原因是:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】将工业副产品石膏(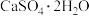 )转化为
)转化为 肥料和氯化钙水合物储热材料,是资源综合利用、环境保护的典范之一,过程如图:
肥料和氯化钙水合物储热材料,是资源综合利用、环境保护的典范之一,过程如图:
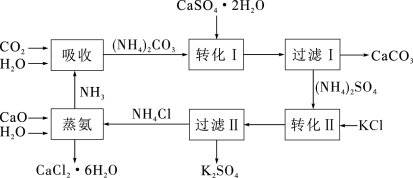
请回答下列问题:
(1)本工艺中所用的原料除 外,还需要的两种原料分别是
外,还需要的两种原料分别是______ 、______ (填化学式,不考虑损耗)。
(2)已知: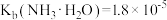 ,室温下,
,室温下, 溶液的
溶液的
______ 7(填“>”、“<”或=”),该溶液中离子浓度由小到大的顺序为______ 。
(3)转化I是将滩溶的 转化为更难溶的
转化为更难溶的 ,将一定量的
,将一定量的 加入过量的
加入过量的 悬浊液中,充分反应后,测得溶液中
悬浊液中,充分反应后,测得溶液中 ,此时溶液中的
,此时溶液中的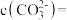
______  。[已知:
。[已知: ]
]
(4)已知不同温度下 在
在 水中达到饱和时溶解的量如下表:
水中达到饱和时溶解的量如下表:
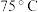 的
的 饱和溶液
饱和溶液 冷却到
冷却到 ,可析出
,可析出 晶体
晶体______ g。
(5)写出“蒸氨”过程中的化学方程式:______ 。
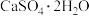 )转化为
)转化为 肥料和氯化钙水合物储热材料,是资源综合利用、环境保护的典范之一,过程如图:
肥料和氯化钙水合物储热材料,是资源综合利用、环境保护的典范之一,过程如图:
请回答下列问题:
(1)本工艺中所用的原料除
 外,还需要的两种原料分别是
外,还需要的两种原料分别是(2)已知:
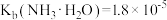 ,室温下,
,室温下, 溶液的
溶液的
(3)转化I是将滩溶的
 转化为更难溶的
转化为更难溶的 ,将一定量的
,将一定量的 加入过量的
加入过量的 悬浊液中,充分反应后,测得溶液中
悬浊液中,充分反应后,测得溶液中 ,此时溶液中的
,此时溶液中的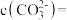
 。[已知:
。[已知: ]
](4)已知不同温度下
 在
在 水中达到饱和时溶解的量如下表:
水中达到饱和时溶解的量如下表:温度/ | 0 | 20 | 40 | 60 | 75 |
 溶解的量/g 溶解的量/g | 7.7 | 11.1 | 14.7 | 18.1 | 20.5 |
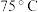 的
的 饱和溶液
饱和溶液 冷却到
冷却到 ,可析出
,可析出 晶体
晶体(5)写出“蒸氨”过程中的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】金属钼具有高强度、高熔点、耐腐蚀、耐研磨等优点,主要作为钢的添加剂。工业上常用钼精矿(主要成分是 ,含有钙、硅等元素)制备金属钼,其中用氧化焙烧法提取钼的工艺流程如图:
,含有钙、硅等元素)制备金属钼,其中用氧化焙烧法提取钼的工艺流程如图:

已知:①焙烧后得到 、
、 、
、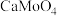 的混合物。
的混合物。
② 溶于氨水,钼酸钙(
溶于氨水,钼酸钙(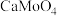 )不溶于氨水。
)不溶于氨水。
回答下列问题:
(1)“焙烧”产物中Mo元素的化合价为___________ 。尾气的主要成分为___________ 。
(2)“氨浸”过程中相关反应的离子方程式为___________ 。
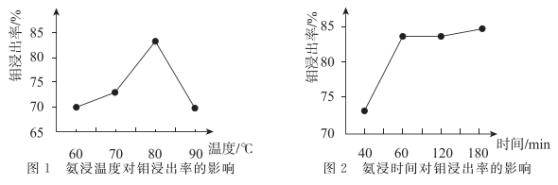
(3)“氨浸”操作中,温度不宜过高,原因在于___________ 。其他条件一定时,钼的浸出率与氨浸温度、时间的关系如下图所示。“氨浸”条件宜采用___________ 。
(4)“沉淀转溶”过程所得滤渣②的成分为___________ 。
(5)“沉钼”过程中发生反应的离子方程式为___________ 。
(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如下图。电解过程中阳极上发生的电极反应式为___________ 。

 ,含有钙、硅等元素)制备金属钼,其中用氧化焙烧法提取钼的工艺流程如图:
,含有钙、硅等元素)制备金属钼,其中用氧化焙烧法提取钼的工艺流程如图:
已知:①焙烧后得到
 、
、 、
、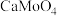 的混合物。
的混合物。②
 溶于氨水,钼酸钙(
溶于氨水,钼酸钙(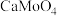 )不溶于氨水。
)不溶于氨水。回答下列问题:
(1)“焙烧”产物中Mo元素的化合价为
(2)“氨浸”过程中相关反应的离子方程式为
(3)“氨浸”操作中,温度不宜过高,原因在于

(4)“沉淀转溶”过程所得滤渣②的成分为
(5)“沉钼”过程中发生反应的离子方程式为
(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如下图。电解过程中阳极上发生的电极反应式为

您最近一年使用:0次



