化学实验的微型化可有效减少污染,实现化学实验的绿色化。某同学按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0. 1 mol/L的KBr、KI(含淀粉)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。[已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O]
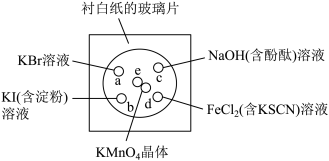
(1)e处发生反应的离子方程式为___________ ,该反应中氧化剂和还原剂的物质的量之比为___________
(2)b处的实验现象为___________ ,d处的实验现象为___________ 。
(3)c处反应的化学方程式为___________ ,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为___________ mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?___________ (填“能”或“不能”),若能,其氧化性由强到弱的顺序是___________ 。

(1)e处发生反应的离子方程式为
(2)b处的实验现象为
(3)c处反应的化学方程式为
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?
更新时间:2020-12-28 22:02:05
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】氧化还原反应原理在研究物质性质和物质转化方面有具有重要的意义。
I.NaNO2易溶于水,外观和食盐相似,有咸味,人误食会中毒。
(1)人体正常的血红蛋白中含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+,而使人体中毒,服用维生素C可解毒。Fe2+转化为Fe3+时,Fe2+在反应中被_______ (填“氧化”或“还原”);服用维生素C可使血液中的Fe3+转为化Fe2+,说明维生素C做_______ (填“氧化剂”或“还原剂”)。
(2)已知NaNO2能发生反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,淀粉遇碘会变蓝色。则鉴别NaNO2和NaCl固体,无须选用的物质为_______ (填标号)。
①水 ②淀粉碘化钾试纸 ③食醋 ④白酒
(3)某厂废液中含有2%-5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是:_______ (填标号)
a.NaCl b.NH4Cl c.HNO3
(4)NaNO2也可作为食品防腐剂,但由于NaNO2具有一定的毒性,因此用量和残留量均有严格规定。可用酸性高锰酸钾测定NaNO2的浓度,配平反应:_______
_______NO +_______MnO
+_______MnO +_______H+=_______NO
+_______H+=_______NO +_______Mn2++_______H2O
+_______Mn2++_______H2O
II.Fe2+既有氧化性又有还原性,铁钉在氯气中被锈蚀成棕褐色含有Fe3+的物质,而在稀硫酸中生成浅绿色溶液(FeSO4)。
(5)FeSO4•7H2O常用作补铁剂,在酸性(常用稀硫酸酸化)条件下,FeSO4能将K2Cr2O7中+6价的Cr转化为+3价的Cr。则反应中氧化剂与还原剂的物质的量比为:_______
(6)已知反应2KMnO4+16HC(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,2FeCl2+Cl2=2FeCl3.则MnO 、Cl2、Fe3+氧化性强弱关系为
、Cl2、Fe3+氧化性强弱关系为_______ ;酸性条件下,KMnO4可被FeSO4还原成Mn2+,试写出该反应的离子方程式:_______ 。
I.NaNO2易溶于水,外观和食盐相似,有咸味,人误食会中毒。
(1)人体正常的血红蛋白中含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+,而使人体中毒,服用维生素C可解毒。Fe2+转化为Fe3+时,Fe2+在反应中被
(2)已知NaNO2能发生反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,淀粉遇碘会变蓝色。则鉴别NaNO2和NaCl固体,无须选用的物质为
①水 ②淀粉碘化钾试纸 ③食醋 ④白酒
(3)某厂废液中含有2%-5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是:
a.NaCl b.NH4Cl c.HNO3
(4)NaNO2也可作为食品防腐剂,但由于NaNO2具有一定的毒性,因此用量和残留量均有严格规定。可用酸性高锰酸钾测定NaNO2的浓度,配平反应:
_______NO
 +_______MnO
+_______MnO +_______H+=_______NO
+_______H+=_______NO +_______Mn2++_______H2O
+_______Mn2++_______H2OII.Fe2+既有氧化性又有还原性,铁钉在氯气中被锈蚀成棕褐色含有Fe3+的物质,而在稀硫酸中生成浅绿色溶液(FeSO4)。
(5)FeSO4•7H2O常用作补铁剂,在酸性(常用稀硫酸酸化)条件下,FeSO4能将K2Cr2O7中+6价的Cr转化为+3价的Cr。则反应中氧化剂与还原剂的物质的量比为:
(6)已知反应2KMnO4+16HC(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,2FeCl2+Cl2=2FeCl3.则MnO
 、Cl2、Fe3+氧化性强弱关系为
、Cl2、Fe3+氧化性强弱关系为
您最近一年使用:0次
填空题
|
适中
(0.64)
【推荐2】氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。它们阴离子的还原性强弱为Cl-<Br-<CN-<SCN-<I-。试写出
①(CN)2与KOH溶液反应的化学方程式:___________ ;
②在NaBr和KSCN的混合溶液中加入(CN)2,反应的离子方程式:___________ 。
①(CN)2与KOH溶液反应的化学方程式:
②在NaBr和KSCN的混合溶液中加入(CN)2,反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】实验室常用KMnO4氧化溶质质量分数为36.5%的盐酸来快速制取氯气。方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)此反应中的氧化剂是___________ ,氧化产物是___________ ,还原性:HCl___________ MnCl2(填“大于”或“小于”)。
(2)若有1molKMnO4参加反应,转移电子的物质的量为___________ mol。
(3)2molKMnO4完全反应,产生的Cl2在标准状况下的体积为___________ L,有___________ molHCl发生反应,有___________ molHCl被氧化。
(4)若此盐酸的密度为1.2g·cm-3,其物质的量浓度为___________ 。HCl的电离方程式是___________ 。
(5)Cl2是一种有毒气体,实验室常用NaOH溶液来处理尾气。已知Cl2通入70℃的NaOH水溶液中,能同时发生两个自身的氧化还原反应(未配平):
NaOH+Cl2→NaCl+NaClO+H2O,NaOH+Cl2→NaCl+NaClO3+H2O。
反应完成后测得溶液中NaClO与NaClO3的数目之比为5∶2,则该溶液中NaCl与NaClO3的数目之比为___________ 。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)此反应中的氧化剂是
(2)若有1molKMnO4参加反应,转移电子的物质的量为
(3)2molKMnO4完全反应,产生的Cl2在标准状况下的体积为
(4)若此盐酸的密度为1.2g·cm-3,其物质的量浓度为
(5)Cl2是一种有毒气体,实验室常用NaOH溶液来处理尾气。已知Cl2通入70℃的NaOH水溶液中,能同时发生两个自身的氧化还原反应(未配平):
NaOH+Cl2→NaCl+NaClO+H2O,NaOH+Cl2→NaCl+NaClO3+H2O。
反应完成后测得溶液中NaClO与NaClO3的数目之比为5∶2,则该溶液中NaCl与NaClO3的数目之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式是____________ ;
(2)在碘和淀粉形成的蓝色溶液中通入 气体,发现蓝色逐渐消失,反应的离子方程式是
气体,发现蓝色逐渐消失,反应的离子方程式是____________ ;
(3)对比(1)和(2)实验所得的结果,将 、
、 、
、 按还原性由强到弱顺序排列为
按还原性由强到弱顺序排列为____________ ;
(2)在碘和淀粉形成的蓝色溶液中通入
 气体,发现蓝色逐渐消失,反应的离子方程式是
气体,发现蓝色逐渐消失,反应的离子方程式是(3)对比(1)和(2)实验所得的结果,将
 、
、 、
、 按还原性由强到弱顺序排列为
按还原性由强到弱顺序排列为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】请写出除去下列物质中括号内的杂质所的试剂或方法:
(1)Cl2(HCl),所用试剂(或方法)_______ (可以不干燥);
(2)Na2CO3固体(NaHCO3),所用试剂(或方法)_______ ;
(3)FeCl3溶液(FeCl2),所用试剂(或方法)_______ ,反应离子方程式_______ ;
(4)FeCl2溶液(CuCl2),所用试剂(或方法)_______ 。
(1)Cl2(HCl),所用试剂(或方法)
(2)Na2CO3固体(NaHCO3),所用试剂(或方法)
(3)FeCl3溶液(FeCl2),所用试剂(或方法)
(4)FeCl2溶液(CuCl2),所用试剂(或方法)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】常温下,某些弱电解质的电离常数如下表:
(1)草酸钠水解的化学方程式是___________ ,下列图像正确且能够说明草酸钠的水解反应达到平衡状态的是___________
(2)向 溶液中加少量
溶液中加少量 溶液,写出反应的离子方程式
溶液,写出反应的离子方程式________
(3)常温下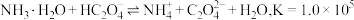 ,则
,则 的电离平衡常数
的电离平衡常数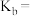
________ (精确到小数点后1位)。
(4)① ②
② ③
③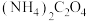 ④
④ 四种溶液中
四种溶液中 相等,则四种溶液的物质的量浓度由大到小的顺序是
相等,则四种溶液的物质的量浓度由大到小的顺序是______ (填序号).
(5) 能氧化
能氧化 ,向
,向 溶液中通入
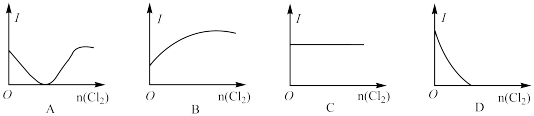
溶液中通入 至过量,下列图像符合溶液导电性(I)变化的是
至过量,下列图像符合溶液导电性(I)变化的是______ 。
| 弱电解质 |  |  |
| 电离常数 | 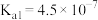 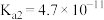 | 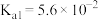  |
| A | B | C | D |
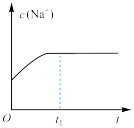 | 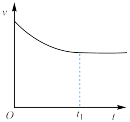 | 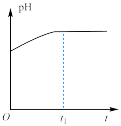 | 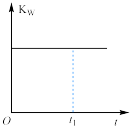 |
溶液中 与反应时间t的关系 与反应时间t的关系 | 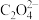 的水解速率与反应时间t的关系 的水解速率与反应时间t的关系 | 溶液的 与反应时间t的关系 与反应时间t的关系 |  与反应时间t的关系 与反应时间t的关系 |
 溶液中加少量
溶液中加少量 溶液,写出反应的离子方程式
溶液,写出反应的离子方程式(3)常温下
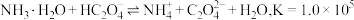 ,则
,则 的电离平衡常数
的电离平衡常数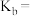
(4)①
 ②
② ③
③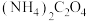 ④
④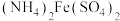 四种溶液中
四种溶液中 相等,则四种溶液的物质的量浓度由大到小的顺序是
相等,则四种溶液的物质的量浓度由大到小的顺序是(5)
 能氧化
能氧化 ,向
,向 溶液中通入
溶液中通入 至过量,下列图像符合溶液导电性(I)变化的是
至过量,下列图像符合溶液导电性(I)变化的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】高铁酸钠 是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为:
是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为: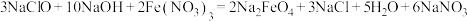 。回答下列问题:
。回答下列问题:
(1)用氯气制备 的反应原理为
的反应原理为___________ (化学方程式)
(2)制备高铁酸钠的反应中 体现了
体现了___________ (填“还原性”、“氧化性”或“氧化性和还原性”)
(3)该反应的离子方程式为___________ 。
(4) 中Fe的价态为
中Fe的价态为___________ 价, 可用于自来水杀菌消毒的原因是
可用于自来水杀菌消毒的原因是___________ 。
(5)该反应中,每消耗 ,生成
,生成 的物质的量
的物质的量___________ mol,转移的电子数目为___________ (用 表示阿伏伽德罗常数的值)
表示阿伏伽德罗常数的值)
 是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为:
是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理为: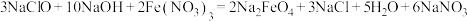 。回答下列问题:
。回答下列问题:(1)用氯气制备
 的反应原理为
的反应原理为(2)制备高铁酸钠的反应中
 体现了
体现了(3)该反应的离子方程式为
(4)
 中Fe的价态为
中Fe的价态为 可用于自来水杀菌消毒的原因是
可用于自来水杀菌消毒的原因是(5)该反应中,每消耗
 ,生成
,生成 的物质的量
的物质的量 表示阿伏伽德罗常数的值)
表示阿伏伽德罗常数的值)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】由氢气和氯气组成的混合气体,经光照充分反应后,通入100mL1molLNaOH溶液中,溶液中某种离子的物质的量(图甲)和溶液的导电性(图乙)随着反应后的混合气体通入体积的变化而变化。
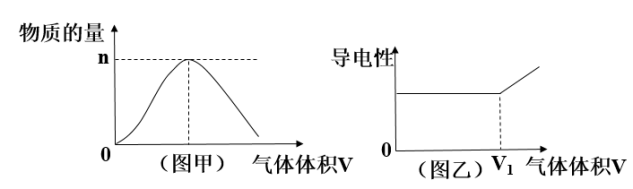
(1)图甲曲线表示溶液中___________ 离子的变化。
(2)对溶液进行导电性实验时,发现当通入的光照反应后的混合气体体积大于V1时,随着混合气体的通入,溶液导电性明显增强,引起导电性增强的主要正、负离子是___________ 。
(3)当图甲中n=0.01mol时,则光照前的混合气体中H2和Cl2的物质的量之比为___________ 。(书写必要步骤)

(1)图甲曲线表示溶液中
(2)对溶液进行导电性实验时,发现当通入的光照反应后的混合气体体积大于V1时,随着混合气体的通入,溶液导电性明显增强,引起导电性增强的主要正、负离子是
(3)当图甲中n=0.01mol时,则光照前的混合气体中H2和Cl2的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】利用如图所示的“价-类”二维图,可以从不同角度认识含氯元素的物质的性质及其转化关系,图中甲~辛均为含氯元素的物质。回答下列问题:
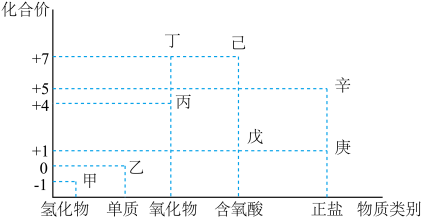
(1)丙的化学式为_____________ ;丁的化学式为_____________ 。
(2)甲、乙、丁、戊中,属于电解质的是__________________________ (填化学式);根据氯元素的化合价判断,乙____________________ (填标号)。
a.只有氧化性 b.既有氧化性又有还原性
c.只有还原性 d.既能作氧化剂又能作还原剂
(3)庚是漂白粉的有效成分,用乙制取漂白粉的化学方程式为____________________________ 。
(4)辛在 催化下受热分解可制备一种常见的气体,这种气体的化学式是
催化下受热分解可制备一种常见的气体,这种气体的化学式是______________ 。

(1)丙的化学式为
(2)甲、乙、丁、戊中,属于电解质的是
a.只有氧化性 b.既有氧化性又有还原性
c.只有还原性 d.既能作氧化剂又能作还原剂
(3)庚是漂白粉的有效成分,用乙制取漂白粉的化学方程式为
(4)辛在
 催化下受热分解可制备一种常见的气体,这种气体的化学式是
催化下受热分解可制备一种常见的气体,这种气体的化学式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列实验。
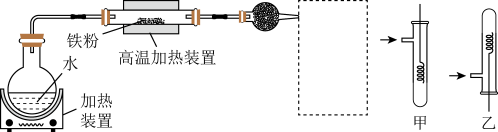
请回答:
(1)虚线框处宜选择的装置是___ (填“甲”或“乙”);实验时应将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是___ 。
(2)硬质玻璃管中铁和水蒸气反应的化学方程式为___ (并用单线桥表示电子转移情况)。取硬质玻璃管中适量的固体,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现血红色,说明该固体中没有+3价的铁,判断结论是否正确并用文字和离子方程式说明理由___ 。

请回答:
(1)虚线框处宜选择的装置是
(2)硬质玻璃管中铁和水蒸气反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】铁是地壳中占比较高的元素,其化合物在自然界十分常见。
(1)某铁原子可表示为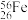 ,其核内中子数是
,其核内中子数是___________ 。
(2)将一个铁球打磨、烧红后放入充满水蒸气的容器中,则发生反应的化学方程式为___________ ;设阿伏加德罗常数的值为 ,当参与反应的
,当参与反应的 的物质的量为
的物质的量为 时,转移的电子数为
时,转移的电子数为___________ 。
(3)服用乳酸亚铁咀嚼片可以缓解缺铁性贫血的症状,其在长期贮存过程中可能因氧化而发生变质,现取少量药片碾碎、溶解、过滤,取滤液加入___________ 溶液并振荡,若滤液变为红色,则药品已变质。
(4)现有甲、乙、丙三名同学分别进行制备 胶体的实验。甲同学向
胶体的实验。甲同学向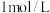 氯化铁溶液中滴入少量的
氯化铁溶液中滴入少量的 溶液;乙同学向
溶液;乙同学向 沸水中逐滴加入
沸水中逐滴加入 饱和溶液;丙同学直接加热
饱和溶液;丙同学直接加热 饱和
饱和 溶液;三人均准备在煮沸至液体呈红褐色后,停止加热。
溶液;三人均准备在煮沸至液体呈红褐色后,停止加热。
①操作正确的同学是___________ 。
②写出制备胶体过程中的离子方程式___________ 。欲除去胶体中混有的 杂质,可以采取的操作方法是
杂质,可以采取的操作方法是___________ 。
③丁同学向所得胶体中逐滴滴加稀硫酸,实验现象为___________ 。
(1)某铁原子可表示为
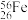 ,其核内中子数是
,其核内中子数是(2)将一个铁球打磨、烧红后放入充满水蒸气的容器中,则发生反应的化学方程式为
 ,当参与反应的
,当参与反应的 的物质的量为
的物质的量为 时,转移的电子数为
时,转移的电子数为(3)服用乳酸亚铁咀嚼片可以缓解缺铁性贫血的症状,其在长期贮存过程中可能因氧化而发生变质,现取少量药片碾碎、溶解、过滤,取滤液加入
(4)现有甲、乙、丙三名同学分别进行制备
 胶体的实验。甲同学向
胶体的实验。甲同学向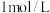 氯化铁溶液中滴入少量的
氯化铁溶液中滴入少量的 溶液;乙同学向
溶液;乙同学向 沸水中逐滴加入
沸水中逐滴加入 饱和溶液;丙同学直接加热
饱和溶液;丙同学直接加热 饱和
饱和 溶液;三人均准备在煮沸至液体呈红褐色后,停止加热。
溶液;三人均准备在煮沸至液体呈红褐色后,停止加热。①操作正确的同学是
②写出制备胶体过程中的离子方程式
 杂质,可以采取的操作方法是
杂质,可以采取的操作方法是③丁同学向所得胶体中逐滴滴加稀硫酸,实验现象为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】如图所示是铁及其化合物的价类二维图。回答下列问题:_____ ,生铁在潮湿空气中主要发生_____ (填“析氢”或“吸氧”)腐蚀。
(2)工业上用赤铁矿(Fe2O3)冶炼Fe常用的方法是_____ (填标号)。
a.电解法 b.热还原法 c.热分解法 d.物理方法
(3)检验FeCl3和FeCl2混合溶液中Fe2+的操作是_____ ;除去FeCl2溶液中的少量FeCl3加入的最佳试剂为_____ 。
(4)Z在空气中很容易变成Y,该反应的化学方程式为_____ 。
(5)FeCl3和KI在水溶液中转化的离子反应有:2Fe3++2I- 2Fe2++I2,为了探究该反应存在一定的限度,某化学兴趣小组取10mL0.5mol·L-1的KI溶液于试管中,再加入10mL0.2mol·L-1的FeCl3溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的_____(填标号)。
2Fe2++I2,为了探究该反应存在一定的限度,某化学兴趣小组取10mL0.5mol·L-1的KI溶液于试管中,再加入10mL0.2mol·L-1的FeCl3溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的_____(填标号)。

(2)工业上用赤铁矿(Fe2O3)冶炼Fe常用的方法是
a.电解法 b.热还原法 c.热分解法 d.物理方法
(3)检验FeCl3和FeCl2混合溶液中Fe2+的操作是
(4)Z在空气中很容易变成Y,该反应的化学方程式为
(5)FeCl3和KI在水溶液中转化的离子反应有:2Fe3++2I-
 2Fe2++I2,为了探究该反应存在一定的限度,某化学兴趣小组取10mL0.5mol·L-1的KI溶液于试管中,再加入10mL0.2mol·L-1的FeCl3溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的_____(填标号)。
2Fe2++I2,为了探究该反应存在一定的限度,某化学兴趣小组取10mL0.5mol·L-1的KI溶液于试管中,再加入10mL0.2mol·L-1的FeCl3溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的_____(填标号)。| A.淀粉溶液 | B.KSCN溶液 |
| C.硝酸银溶液 | D.酸性高锰酸钾溶液 |
您最近一年使用:0次



