A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族元素原子中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)D在周期表中的位置为___ ;B的原子结构示意图为___ 。
(2)E元素形成的最高价氧化物对应水化物的化学式为___ 。
(3)元素C、D、E的原子半径大小关系是___ (用元素符号表示)。
(4)C、D可形成化合物D2C2,D2C2含有的化学键是___ 。
(1)D在周期表中的位置为
(2)E元素形成的最高价氧化物对应水化物的化学式为
(3)元素C、D、E的原子半径大小关系是
(4)C、D可形成化合物D2C2,D2C2含有的化学键是
更新时间:2020-12-29 19:37:08
|
相似题推荐
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Y同主族且Y的单质可用于制造太阳能电池板,Z的族序数等于X的核外电子数。回答下列问题:
(1)Y、Z、W原子半径由大到小的顺序为___________ (用元素符号表示)。
(2)四种元素中,非金属性最强的元素在周期表中的位置是___________ 。
(3)上述四种元素的化合物,含氧酸中酸性最强的是___________ (填化学式),含氧酸中氧化性最强的是___________ (填化学式)。
(4)下列说法正确的是___________
①X的最高价氧化物的分子式为
②X氢化物的稳定性弱于Y氢化物的稳定性
③Z氢化物的水溶液露置在空气中容易变质,溶液变浑浊
④Z的氢化物与它的最高价氧化物水化物可发生反应生成Z单质
⑤上述单质中能与NaOH溶液反应的有2种
(5)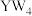 极易水解,生成两种常见的酸,化学方程式为:
极易水解,生成两种常见的酸,化学方程式为:___________ ,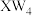 是一种常见的溶剂,将其放入溴水中,充分振荡、静止后,现象是
是一种常见的溶剂,将其放入溴水中,充分振荡、静止后,现象是___________ 。
(1)Y、Z、W原子半径由大到小的顺序为
(2)四种元素中,非金属性最强的元素在周期表中的位置是
(3)上述四种元素的化合物,含氧酸中酸性最强的是
(4)下列说法正确的是
①X的最高价氧化物的分子式为

②X氢化物的稳定性弱于Y氢化物的稳定性
③Z氢化物的水溶液露置在空气中容易变质,溶液变浑浊
④Z的氢化物与它的最高价氧化物水化物可发生反应生成Z单质
⑤上述单质中能与NaOH溶液反应的有2种
(5)
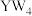 极易水解,生成两种常见的酸,化学方程式为:
极易水解,生成两种常见的酸,化学方程式为: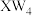 是一种常见的溶剂,将其放入溴水中,充分振荡、静止后,现象是
是一种常见的溶剂,将其放入溴水中,充分振荡、静止后,现象是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐2】下表为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)以上11种元素的最高价氧化物的水化物,碱性最强的是_______ ,酸性最强的是_______ 。
(2)②③⑧元素形成的简单离子半径由大到小的顺序是_______ (填离子符号)。
(3)①和⑨两元素形成化合物的电子式为_______ ,该化合物的溶液与元素⑧的单质反应的离子方程式为_______ 。
(4)元素①最高价氧化物对应的水化物能与⑤的最高价氧化物对应的水化物发生反应,该化学方程式为_______ 。
(5)⑧⑨⑪三种元素形成的气态氢化物中最稳定的是_______ (填化学式),元素的非金属性⑧_______ ⑨(填“>”或“<”),下列事实不能证明上述结论的是_______ 。
A.元素⑧的单质与⑨的氢化物的水溶液反应,溶液变为黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑨的强
C.元素⑧和⑨的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑨的弱
E.元素⑧的对应的离子还原性比元素⑨对应的离子还原性弱
| 组 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ⑪ | |||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
(1)以上11种元素的最高价氧化物的水化物,碱性最强的是
(2)②③⑧元素形成的简单离子半径由大到小的顺序是
(3)①和⑨两元素形成化合物的电子式为
(4)元素①最高价氧化物对应的水化物能与⑤的最高价氧化物对应的水化物发生反应,该化学方程式为
(5)⑧⑨⑪三种元素形成的气态氢化物中最稳定的是
A.元素⑧的单质与⑨的氢化物的水溶液反应,溶液变为黄色
B.元素⑧的最高价氧化物对应水化物的酸性比元素⑨的强
C.元素⑧和⑨的氢化物受热分解,前者的分解温度高
D.元素⑧的氢化物的水溶液的酸性比元素⑨的弱
E.元素⑧的对应的离子还原性比元素⑨对应的离子还原性弱
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】CO2和CH4在一定条件下合成乙酸:CO2+CH4 CH3COOH,完成下列填空:
CH3COOH,完成下列填空:
(1)写出碳原子最外层的电子排布式_______ 。CO2分子的电子式_______ ,其晶体熔沸点比CS2低,原因是_______ 。
(2)上述凡有所涉及的元素原子半径由大到小的顺序是_______ 。比较碳、硅两种元素的非金属性强弱,可以通过_______ (填:化合物性质的差异)来判断。从原子结构角度解释两元素的非金属性强弱关系_______ 。
(3)能使0.1mol/L乙酸溶液的电离程度以及pH都增大的是_______ (选填序号)。
a. 加水稀释 b. 加入少量乙酸钠固体 c. 通氯化氢 d. 加入少量苛性钠固体
(4)一定温度下,将盐酸滴入乙酸钠溶液中至溶液呈中性,此时溶液中c(Cl-)+c(CH3COO-)_______ c(Na+)(填“>”、“<”或“=”)。
(5)0.1mol·L-1的NaHCO3溶液中:c(CO )
)_______ c(H2CO3)(填“>”、“<”或“=”)。
 CH3COOH,完成下列填空:
CH3COOH,完成下列填空:(1)写出碳原子最外层的电子排布式
(2)上述凡有所涉及的元素原子半径由大到小的顺序是
(3)能使0.1mol/L乙酸溶液的电离程度以及pH都增大的是
a. 加水稀释 b. 加入少量乙酸钠固体 c. 通氯化氢 d. 加入少量苛性钠固体
(4)一定温度下,将盐酸滴入乙酸钠溶液中至溶液呈中性,此时溶液中c(Cl-)+c(CH3COO-)
(5)0.1mol·L-1的NaHCO3溶液中:c(CO
 )
)
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】请根据表中的信息回答下列问题
(1)D离子的结构示意图:________ ,B原子的电子式:________ ,E离子的电子式:________ 。
(2)和B元素的氢化物所含电子数相同的分子有多种,写出任意2种:________ ,________ 。
(3)A元素与E元素组成的化合物的电离方程式:_______________________ 。
| 元素 | A | B | C | D | E |
| 有关信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 其原子M层有3个电子 | 食盐中的金属元素 | 单质在常温、常压下是黄绿色的气体 |
(2)和B元素的氢化物所含电子数相同的分子有多种,写出任意2种:
(3)A元素与E元素组成的化合物的电离方程式:
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】A、B、C、D、E为短周期元素,A、B、C在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。D与A同周期,其最高正价与最低负价代数和为零。A、E可形成AE3型分子,分子中只存在极性键。

(1)B元素在元素周期表中的位置是____________________ 。
(2)C的离子结构示意图为__________________ ,用电子式表示AE3的形成过程:_______________________________________ 。
(3)由元素A、C及氢元素形成的化合物中含有的化学键的类型有____________ 。
(4)请设计一个实验来说明D与A的非金属性强弱(写出化学方程式即可)_________________ 在铜锌硫酸原电池中,若负极减少是13g,则正极产生__________ 升气体(标准状况)?

(1)B元素在元素周期表中的位置是
(2)C的离子结构示意图为
(3)由元素A、C及氢元素形成的化合物中含有的化学键的类型有
(4)请设计一个实验来说明D与A的非金属性强弱(写出化学方程式即可)
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐3】已知X、Y、Z、W、Q、P是短周期的主族元素。如图所示,横坐标表示原子半径相对大小,纵坐标表示化合价(最高正价或最低负价)。回答下列问题:

(1)Y在元素周期表中的位置_______ ;Y的单质化学性质稳定,原因是_______ 。
(2)Q的单质与P的最高价氧化物的水化物发生反应的离子方程式为_______ 。
(3)用电子式表示化合物PZ的形成过程_______ 。
(4)将PX投入水中,可得到X的单质,该反应的化学方程式为_______ 。
(5)Z与W相比较,非金属性较强的是_______ (填元素符号),设计实验证明_______ 。

(1)Y在元素周期表中的位置
(2)Q的单质与P的最高价氧化物的水化物发生反应的离子方程式为
(3)用电子式表示化合物PZ的形成过程
(4)将PX投入水中,可得到X的单质,该反应的化学方程式为
(5)Z与W相比较,非金属性较强的是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐1】X、Y、Z、W、R、T都是短周期元素,X的M层有6个电子,Y最外层电子数是次外层电子数的2倍,Z常温下单质为双原子分子,其氢化物M的水溶液呈碱性,W元素最高价为+7价,R单质既能与酸反应,又能与碱反应,T是周期表中原子半径最小的元素。
(1)X、Y、Z、W、R、T的元素符号分别是X:___________ ,Y:___________ ,Z:___________ ,W:___________ ,R:___________ ,T:___________ 。
(2)Y的一种同位素可以测定文物的年代该同位素的符号是___________ ,其与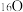 形成的双原子分子含有的中子数为
形成的双原子分子含有的中子数为___________ 。
(3)Z元素与T元素形成一种离子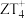 ,写出检验某溶液含有该离子的方法
,写出检验某溶液含有该离子的方法___________ 。
(4)X与W相比,非金属性较强的是W,下列能证明这一事实的是___________ 。
a.常温下W单质与X单质的状态不同
b.W的氢化物比X的氢化物稳定
c.W的最高价氧化物对应的水化物的酸性比X的最高价氧化物对应的水化物酸性强
(1)X、Y、Z、W、R、T的元素符号分别是X:
(2)Y的一种同位素可以测定文物的年代该同位素的符号是
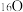 形成的双原子分子含有的中子数为
形成的双原子分子含有的中子数为(3)Z元素与T元素形成一种离子
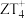 ,写出检验某溶液含有该离子的方法
,写出检验某溶液含有该离子的方法(4)X与W相比,非金属性较强的是W,下列能证明这一事实的是
a.常温下W单质与X单质的状态不同
b.W的氢化物比X的氢化物稳定
c.W的最高价氧化物对应的水化物的酸性比X的最高价氧化物对应的水化物酸性强
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】如图所示是元素周期表的一部分,根据元素在周期表中的位置按题目要求回答:
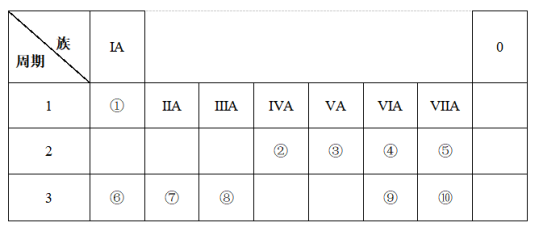
(1)在元素①~⑩中,非金属性最强的元素是___________ (填元素名称)。
(2)在元素⑥~⑩中,离子半径最小的元素的离子结构示意图为___________ 。
(3)元素⑥⑦⑧的最高价氧化物对应的水化物,按碱性从强到弱的顺序排列是___________ (用化学式表示)。
(4)用电子式表示元素①和③形成的化合物甲的形成过程___________ 。
(5)为了检验元素⑥的存在,可采用的方法是___________ 。

(1)在元素①~⑩中,非金属性最强的元素是
(2)在元素⑥~⑩中,离子半径最小的元素的离子结构示意图为
(3)元素⑥⑦⑧的最高价氧化物对应的水化物,按碱性从强到弱的顺序排列是
(4)用电子式表示元素①和③形成的化合物甲的形成过程
(5)为了检验元素⑥的存在,可采用的方法是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】在研究前18号元素时发现,随原子序数递增可以将它们排成如下图所示的蜗牛形状。图中每个点代表一种元素,其中①代表氢元素。
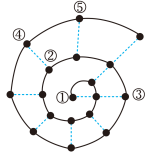
(1)元素①、②形成的化合物中所含的化学键为___________ 键(填“离子”或“共价”,下同);元素③、⑤形成的化合物属于___________ 化合物。元素⑤最高价氧化物对应的水化物化学式___________ 。
(2)Cs元素与元素③同主族,Cs单质与水反应的化学方程式为___________ 。
(3)元素④在元素周期表中位于第三周期___________ 族。
(4)约里奥-居里夫妇在核反应中用 粒子轰击
粒子轰击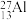 ,得到核素
,得到核素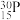 。
。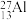 的原子结构示意图为
的原子结构示意图为___________ ,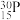 与
与 互称为
互称为___________ 。
(5)把相同大小的一块铝片和镁片分别投入相同浓度的 溶液中,铝溶解有气泡放出;而镁没有任何变化,能否证明铝的金属性比镁强
溶液中,铝溶解有气泡放出;而镁没有任何变化,能否证明铝的金属性比镁强___________ (填“能”或“不能”)。写出铝与NaOH溶液反应化学方程式___________ 。

(1)元素①、②形成的化合物中所含的化学键为
(2)Cs元素与元素③同主族,Cs单质与水反应的化学方程式为
(3)元素④在元素周期表中位于第三周期
(4)约里奥-居里夫妇在核反应中用
 粒子轰击
粒子轰击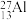 ,得到核素
,得到核素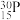 。
。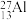 的原子结构示意图为
的原子结构示意图为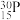 与
与 互称为
互称为(5)把相同大小的一块铝片和镁片分别投入相同浓度的
 溶液中,铝溶解有气泡放出;而镁没有任何变化,能否证明铝的金属性比镁强
溶液中,铝溶解有气泡放出;而镁没有任何变化,能否证明铝的金属性比镁强
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐2】下表列出了9种元素在元素周期表中的位置。

请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_______
(2)画出元素⑧形成的简单离子的结构示意图_______
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_______
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是_______
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______ (填化学式)
(6)写出元素⑥的单质与水反应的离子反应方程式_______
(7)写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式_______

请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是
(2)画出元素⑧形成的简单离子的结构示意图
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是
(6)写出元素⑥的单质与水反应的离子反应方程式
(7)写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
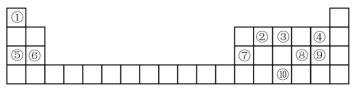
【推荐3】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题:___________ ,⑦原子结构示意图为___________ 。
(2)⑤、⑥、⑦的简单离子半径由大到小的顺序为___________ (用原子符号和“>”表示)。
(3)④⑧⑨的气态氢化物中,最稳定的是___________ (用化学式表示),最高价氧化物对应水化物中,酸性最强的是___________ (用化学式表示)。
(4)由①③⑨组成的盐化学式为___________ ,其中含有的化学键类型是___________
(2)⑤、⑥、⑦的简单离子半径由大到小的顺序为
(3)④⑧⑨的气态氢化物中,最稳定的是
(4)由①③⑨组成的盐化学式为
您最近一年使用:0次



