用氯气对饮用水消毒,会使水中的有机物发生氯化,生成含氯化合物,而含氯化合物对人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用具有强氧化性的高效消毒剂二氧化氯(ClO2)。二氧化氯极易爆炸,生产和使用时尽量用惰性气体稀释,避免光照、震动或加热。
(1)欧洲一些国家用氯酸钠(NaClO3)氧化浓盐酸来制取二氧化氯,同时有氯气生成,且氯气的体积为二氧化氯的一半,这一反应的化学方程式是_________ 。
(2)浓盐酸在上述反应中显示出来的性质是___________ (填字母)。
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
(3)二氧化氯为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是氯气的___________ 倍。
(4)我国广泛采用将经干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得二氧化氯,表示这一反应的化学方程式是___________ 。和欧洲的方法相比,我国这一方法的主要优点是___________ 。
(1)欧洲一些国家用氯酸钠(NaClO3)氧化浓盐酸来制取二氧化氯,同时有氯气生成,且氯气的体积为二氧化氯的一半,这一反应的化学方程式是
(2)浓盐酸在上述反应中显示出来的性质是
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
(3)二氧化氯为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是氯气的
(4)我国广泛采用将经干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得二氧化氯,表示这一反应的化学方程式是
20-21高一上·全国·假期作业 查看更多[1]
(已下线)练习8 微项目 科学使用含氯消毒剂——运用氧化还原反应原理解决实际问题-2020-2021学年【补习教材·寒假作业】高一化学(鲁科版2019)
更新时间:2021-01-16 07:51:14
|
相似题推荐
【推荐1】过氧化氢(H2O2,氧显-1价)俗名双氧水,医疗上利用它杀菌消毒的作用来清洗伤口。

根据下列反应回答问题:
A.Ag2O+H2O2=2Ag+O2↑+H2O
B.2H2O2=2H2O+O2↑
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2分别表现_______ 性质。
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序____ 。
(3)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。写出该反应的离子方程式为____ 。


根据下列反应回答问题:
A.Ag2O+H2O2=2Ag+O2↑+H2O
B.2H2O2=2H2O+O2↑
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)上述反应中,H2O2分别表现
(2)上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序
(3)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:
O2、MnO4-、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。写出该反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】锑在工业上应用价值广泛,它的一种提取工艺流程如下,请回答下列问题:
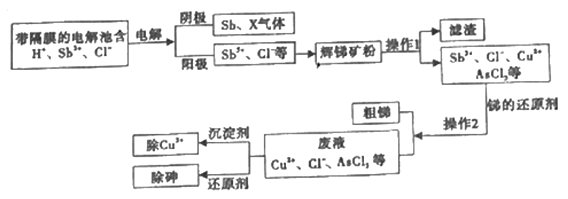
(1)辉锑矿是含锑的重要矿物,其主要成分是Sb2S3其中Sb的化合价是______ 。
(2)写出阳极区产物与辉锑矿粉主要成分发生反应的化学方程式______ 。
(3)电解池所用的“隔膜”宜采用______ 交换膜(填“阳离子”、“阴离子”或“质子”)。为促使Sb3+向阳极迁移加快反应,通常要进行的操作是_________ 。“电解” 中阴极反应的产物之一X是______ 。(填化学式)。
(4)为除去操作I所得滤液中的Cu2+,可加入Na2S。若滤液中c(Cu2+)= 0.01mol/L,当溶液中Cu2+恰好完全沉淀时,c(S2-)=______ mol/L。 [已知Ksp(CuS)= 8×10-45]
(5)除去废液中的 AsCl3,是用次磷酸钠( NaH2PO2)还原AsCl3,产生了棕色单质砷沉淀和H3PO3。该反应中氧化剂和还原剂的物质的量之比为______ ,氧化产物是_____________ 。
(6)若电解池阴极得到1mol X气体,同时电路中转移6mole-,阴极生成的m( Sb)=____ g。

(1)辉锑矿是含锑的重要矿物,其主要成分是Sb2S3其中Sb的化合价是
(2)写出阳极区产物与辉锑矿粉主要成分发生反应的化学方程式
(3)电解池所用的“隔膜”宜采用
(4)为除去操作I所得滤液中的Cu2+,可加入Na2S。若滤液中c(Cu2+)= 0.01mol/L,当溶液中Cu2+恰好完全沉淀时,c(S2-)=
(5)除去废液中的 AsCl3,是用次磷酸钠( NaH2PO2)还原AsCl3,产生了棕色单质砷沉淀和H3PO3。该反应中氧化剂和还原剂的物质的量之比为
(6)若电解池阴极得到1mol X气体,同时电路中转移6mole-,阴极生成的m( Sb)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】磷元素是生产生活中重要的元素之一,请回答下列问题。
(1)磷及部分重要化合物的相互转化如下图所示。
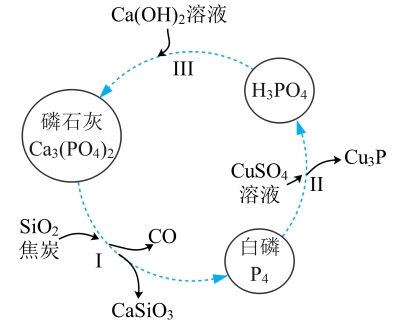
①骤I为白磷的工业生产方法之一,反应在1300℃的高温炉中进行, 的作用是用于造渣(
的作用是用于造渣(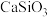 ),其中焦炭的发生反应
),其中焦炭的发生反应___________ (填“氧化”或“还原”)。
②白磷有剧毒,若不慎将白磷沾到皮肤上,可用 溶液冲洗,根据步骤II可判断,被16g
溶液冲洗,根据步骤II可判断,被16g 氧化的白磷(
氧化的白磷( )质量为
)质量为___________ g。
③步骤III中,反应物的比例不同可获得不同的产物,除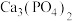 外可能的产物还有
外可能的产物还有___________ 、___________ 。
(2) 是一元中强酸
是一元中强酸 及
及 均可将溶液中的
均可将溶液中的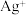 还原为银,从而可用于化学镀银。
还原为银,从而可用于化学镀银。
① 中,P元素的化合价为
中,P元素的化合价为___________ 。
②酸与碱能发生中和反应,请写出 与NaOH反应的离子方程式
与NaOH反应的离子方程式_____ 。
(3)金属单质可以与酸反应,某些非金属单质也能与碱反应,请配平方程_____ 。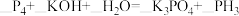
(1)磷及部分重要化合物的相互转化如下图所示。

①骤I为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,
 的作用是用于造渣(
的作用是用于造渣(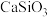 ),其中焦炭的发生反应
),其中焦炭的发生反应②白磷有剧毒,若不慎将白磷沾到皮肤上,可用
 溶液冲洗,根据步骤II可判断,被16g
溶液冲洗,根据步骤II可判断,被16g 氧化的白磷(
氧化的白磷( )质量为
)质量为③步骤III中,反应物的比例不同可获得不同的产物,除
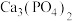 外可能的产物还有
外可能的产物还有(2)
 是一元中强酸
是一元中强酸 及
及 均可将溶液中的
均可将溶液中的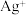 还原为银,从而可用于化学镀银。
还原为银,从而可用于化学镀银。①
 中,P元素的化合价为
中,P元素的化合价为②酸与碱能发生中和反应,请写出
 与NaOH反应的离子方程式
与NaOH反应的离子方程式(3)金属单质可以与酸反应,某些非金属单质也能与碱反应,请配平方程
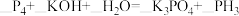
您最近一年使用:0次
【推荐1】某地有一池塘,之前生长着丰富的水生生物。近来,由于化工厂将大量污水排入池塘中,使水质恶化,各种水生生物先后死亡。根据题意回答下列问题:
(1)从生态平衡角度看,池塘的这种变化说明了__________________________________ ,造成这种变化的原因是_____________________________________________________________________ 。
(2)经检测,污水中溴单质的浓度为 ,可用
,可用 除去污水中的溴,发生反应的化学方程式为
除去污水中的溴,发生反应的化学方程式为________________ 。处理5L这种污水,需加入________ L 的
的 溶液才能将溴全部除去。
溶液才能将溴全部除去。
(3)要使池塘恢复本来面目,首先要解决的问题是____________________________________ 。
(1)从生态平衡角度看,池塘的这种变化说明了
(2)经检测,污水中溴单质的浓度为
 ,可用
,可用 除去污水中的溴,发生反应的化学方程式为
除去污水中的溴,发生反应的化学方程式为 的
的 溶液才能将溴全部除去。
溶液才能将溴全部除去。(3)要使池塘恢复本来面目,首先要解决的问题是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】“绿水青山就是金山银山”,生态文明建设依赖于我们每一个人,请回答下列问题。
(1)天然水的处理可用明矾作混凝剂,其含有的铝离子水解生成的_______ (填化学式)胶体能吸附水中的悬浮颗粒并使之沉降。含有油类、氰化物、硫化物等的工业废水可以用_______ (填“中和”、“氧化还原”或“沉淀”)法处理。
(2)生活垃圾的处理与再利用,既可以保护环境又可以节约资源。废纸、塑料、废金属等属于_______ (填“有机垃圾”、“危险废物”或“可回收垃圾”)。生活垃圾常用的三种处理方法是堆肥、卫生填埋和_______ 。
(3)保护环境是每个公民的责任。下列做法有利于环境保护的是_______ 。
①推广使用无磷洗涤剂 ②生活垃圾分类处理 ③推广使用一次性木制筷子 ④推广使用清洁能源 ⑤过量使用化肥、农药 ⑥推广使用无氟冰箱
(1)天然水的处理可用明矾作混凝剂,其含有的铝离子水解生成的
(2)生活垃圾的处理与再利用,既可以保护环境又可以节约资源。废纸、塑料、废金属等属于
(3)保护环境是每个公民的责任。下列做法有利于环境保护的是
①推广使用无磷洗涤剂 ②生活垃圾分类处理 ③推广使用一次性木制筷子 ④推广使用清洁能源 ⑤过量使用化肥、农药 ⑥推广使用无氟冰箱
| A.①②④⑤ | B.②③④⑥ | C.①②④⑥ | D.③④⑤⑥ |
您最近一年使用:0次



