某同学在实验室配制了一瓶500mL浓度约为0.1mol·L-1的 NaOH 溶液。现欲测定其准确浓度,用20.00mL 浓度为 0.1010 mol·L-1 的邻苯二甲酸氢钾(KHC8H4O4)标准溶液与该NaOH溶液反应,测得恰好完全反应时平均消耗该NaOH 溶液的体积为18.50mL。(已知: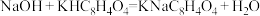 )
)
(1)NaOH 溶液需要经过标准溶液测定后方可确定其准确浓度(排除操作因素),原因可能是_______ 。
(2)经测定,该NaOH溶液的浓度为_______ (保留4位有效数字)。
(3)该实验大约需要80mL 0.1010 mol·L-1 的 KHC8H4O4标准溶液。
①配制 KHC8H4O4溶液时,不需要用到的仪器为_______ 、_______ (选填序号)。
②配制该溶液过程中,下列操作可能引起所配溶液浓度偏高的是_______ (填序号)。
a.容量瓶未干燥,含有少量蒸馏水
b.转移溶液时不慎有少量液体洒到容量瓶外面
c.溶液从烧杯转移到容量瓶后没有洗涤烧杯
d.定容时俯视刻度线
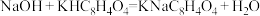 )
) (1)NaOH 溶液需要经过标准溶液测定后方可确定其准确浓度(排除操作因素),原因可能是
(2)经测定,该NaOH溶液的浓度为
(3)该实验大约需要80mL 0.1010 mol·L-1 的 KHC8H4O4标准溶液。
①配制 KHC8H4O4溶液时,不需要用到的仪器为


②配制该溶液过程中,下列操作可能引起所配溶液浓度偏高的是
a.容量瓶未干燥,含有少量蒸馏水
b.转移溶液时不慎有少量液体洒到容量瓶外面
c.溶液从烧杯转移到容量瓶后没有洗涤烧杯
d.定容时俯视刻度线
更新时间:2021-01-30 19:36:54
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】K3[Fe(C2O4)3]·3H2O[三草酸合铁酸钾(M=491 g·mol-1)]易溶于水,难溶于乙醇,常用作有机反应的催化剂。某同学利用下图装置制备FeC2O4·2H2O,然后再制备三草酸合铁酸钾。
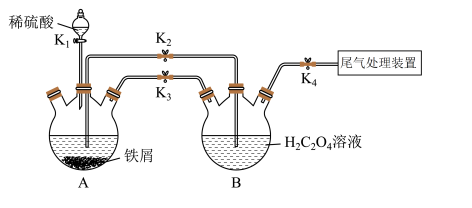
回答下列问题:
I.晶体的制备
(1)三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O,中心离子价层电子轨道表示式______________ 。
(2)打开K1、K3、K4,关闭K2,制备FeSO4。为使生成的FeSO4溶液与H2C2O4溶液接触,应进行的操作为__________________ 。
(3)向制得的FeC2O4(s)中加入过量K2C2O4溶液和H2C2O4溶液,水浴40°C下加热,缓慢滴加H2O2溶液,制得K3[Fe(C2O4)3],该反应的化学方程式为______________________ ;将上述混合物煮沸,加入饱和H2C2O4溶液,充分反应后冷却、结晶;结晶完全后减压抽滤、洗涤、干燥得到目标产物。
i.缓慢滴加H2O2溶液,水浴控温在40°C的原因是___________________ 。
ii.制备K3[Fe(C2O4)3]·3H2O时可能有红褐色沉淀生成,则H2C2O4的作用是_______________ 。
iii.为促进结晶,冷却后可加入_____________ (填试剂名称)。
II.阴离子电荷的测定
准确称取mg三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用R≡N+Cl-表示)的交换柱,发生阴离子(Xz-)交换:zR≡N+Cl-+ Xz- (R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(4)阴离子电荷数为____________ (用含字母的代数式表示);若交换时样品液的流速过快,则会导致测定结果_____ (填“偏高“偏低”或“无影响”)。

回答下列问题:
I.晶体的制备
(1)三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O,中心离子价层电子轨道表示式
(2)打开K1、K3、K4,关闭K2,制备FeSO4。为使生成的FeSO4溶液与H2C2O4溶液接触,应进行的操作为
(3)向制得的FeC2O4(s)中加入过量K2C2O4溶液和H2C2O4溶液,水浴40°C下加热,缓慢滴加H2O2溶液,制得K3[Fe(C2O4)3],该反应的化学方程式为
i.缓慢滴加H2O2溶液,水浴控温在40°C的原因是
ii.制备K3[Fe(C2O4)3]·3H2O时可能有红褐色沉淀生成,则H2C2O4的作用是
iii.为促进结晶,冷却后可加入
II.阴离子电荷的测定
准确称取mg三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用R≡N+Cl-表示)的交换柱,发生阴离子(Xz-)交换:zR≡N+Cl-+ Xz-
 (R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。(4)阴离子电荷数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】上海某一超市销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式并画出电子转移的方向与数目:_____ KIO3+_____ KI+_____ H2SO4=_____ K2SO4+_____ I2+_____ H2O;电子转移情况如下(双线桥表示)__________________________________ ;
(2)上述反应生成的I2可用叫氯化碳萃取,并用分液漏斗分离出两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL CCL4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞上的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗方正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.静置,分层。
a、正确的操作顺序是(用编号字母填写)_____ →_____ →_____ →A→_____ →_____ E→F。
b、下列物质。还能用作从溶液中萃取碘的溶剂是_____ 。
A.苯 B.碘化钾 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。Na2SO3稀溶液与I2反应的主要产物(化学式)是_____ 。
(4)已知:I2+2Na2S2O3=2NaI+Na2S4O6.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液15.00mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_____ 。
②根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_____ mg/kg。
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
(2)上述反应生成的I2可用叫氯化碳萃取,并用分液漏斗分离出两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL CCL4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞上的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗方正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.静置,分层。
a、正确的操作顺序是(用编号字母填写)
b、下列物质。还能用作从溶液中萃取碘的溶剂是
A.苯 B.碘化钾 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。Na2SO3稀溶液与I2反应的主要产物(化学式)是
(4)已知:I2+2Na2S2O3=2NaI+Na2S4O6.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液15.00mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某电镀废水中的铬元素以Cr3+和CrO 存在,其总铬含量的测定方法如下。
存在,其总铬含量的测定方法如下。
步骤一:取100mL废水,加热浓缩成20.00mL溶液,然后加入NaOH溶液将Cr3+转化为 ;
;
步骤二:加入稍过量的H2O2,使 在碱性条件下转化成
在碱性条件下转化成 ;
;
步骤三:加入硫酸酸化并煮沸后,加足量碘化钾将六价铬还原为Cr3+,同时生成单质I2;
步骤四:加入指示剂用0.01mol·L-1Na2S2O3溶液滴定,滴定过程中消耗Na2S2O3溶液30.00mL。已知:I2+2 =
= +2I-,请回答下列问题:
+2I-,请回答下列问题:
(1)“步骤三”中加硫酸酸化时存在反应2 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O,升高溶液的温度会导致溶液黄色加深,则该反应的ΔH
(橙色)+H2O,升高溶液的温度会导致溶液黄色加深,则该反应的ΔH___________ 0(填“>”或“<”)。
(2)若“步骤三”省略加热煮沸操作会导致废水中铬元素含量的测量结果___________ (填“偏高”、“偏低”或“无影响”)。
(3)“步骤四”中加入的指示剂为___________ 。
(4)该废水中铬元素的含量为___________ g/L。
(5)可将电镀废水中的铬元素通过氧化和调节pH全部转化为 ,再利用电化学原理处理含
,再利用电化学原理处理含 废水和含甲醇废水,装置如图所示。
废水和含甲醇废水,装置如图所示。
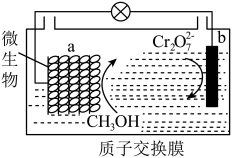
①请写出a极的电极反应式___________ ,b极附近pH___________ (填“升高”、“降低”或“不变”)。
②向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________ 。
 存在,其总铬含量的测定方法如下。
存在,其总铬含量的测定方法如下。步骤一:取100mL废水,加热浓缩成20.00mL溶液,然后加入NaOH溶液将Cr3+转化为
 ;
;步骤二:加入稍过量的H2O2,使
 在碱性条件下转化成
在碱性条件下转化成 ;
;步骤三:加入硫酸酸化并煮沸后,加足量碘化钾将六价铬还原为Cr3+,同时生成单质I2;
步骤四:加入指示剂用0.01mol·L-1Na2S2O3溶液滴定,滴定过程中消耗Na2S2O3溶液30.00mL。已知:I2+2
 =
= +2I-,请回答下列问题:
+2I-,请回答下列问题:(1)“步骤三”中加硫酸酸化时存在反应2
 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O,升高溶液的温度会导致溶液黄色加深,则该反应的ΔH
(橙色)+H2O,升高溶液的温度会导致溶液黄色加深,则该反应的ΔH(2)若“步骤三”省略加热煮沸操作会导致废水中铬元素含量的测量结果
(3)“步骤四”中加入的指示剂为
(4)该废水中铬元素的含量为
(5)可将电镀废水中的铬元素通过氧化和调节pH全部转化为
 ,再利用电化学原理处理含
,再利用电化学原理处理含 废水和含甲醇废水,装置如图所示。
废水和含甲醇废水,装置如图所示。
①请写出a极的电极反应式
②向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】(一)要配制浓度约为2mol/L NaOH溶液100mL,下面的操作正确的是______ (填序号)。
①称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
②称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
③称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
④用100mL量筒量取40mL 5mol/LNaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
(二)下图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度是_______ mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL4.6mol/L的稀硫酸,用该硫酸配制,选取的容量瓶规格为250mL,则需要量取_____ mL的该硫酸。
(3)用上述硫酸配制所需的的稀硫酸时,实验仪器有:
①50mL量筒 ②100mL量筒 ③托盘天平 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦烧杯 ⑧锥形瓶
实验时选用仪器的先后顺序为_____ → ______ →④→______ →______ 。
(4)下列情况导致所配硫酸溶液物质的量浓度偏高的有____________________ 。
①未经冷却趁热将溶液注入容量瓶中
②容量瓶用4mol/L硫酸润洗
③定容时仰视观察液面
④颠倒摇匀后发现液面低于刻度线再加水
⑤用量筒量取浓硫酸后,用蒸馏水洗涤量筒,洗液也转移至容量瓶中
①称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
②称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL
③称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
④用100mL量筒量取40mL 5mol/LNaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
(二)下图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度是
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL4.6mol/L的稀硫酸,用该硫酸配制,选取的容量瓶规格为250mL,则需要量取
(3)用上述硫酸配制所需的的稀硫酸时,实验仪器有:
①50mL量筒 ②100mL量筒 ③托盘天平 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦烧杯 ⑧锥形瓶
实验时选用仪器的先后顺序为
(4)下列情况导致所配硫酸溶液物质的量浓度偏高的有
①未经冷却趁热将溶液注入容量瓶中
②容量瓶用4mol/L硫酸润洗
③定容时仰视观察液面
④颠倒摇匀后发现液面低于刻度线再加水
⑤用量筒量取浓硫酸后,用蒸馏水洗涤量筒,洗液也转移至容量瓶中
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某化学研究性学习小组需配制含有NH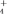 、Cl-、K+、SO42—的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥量筒。请回答下列问题:
、Cl-、K+、SO42—的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥量筒。请回答下列问题:
(1)该植物培养液中,NH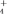 的物质的量浓度为
的物质的量浓度为_____________ 。
(2)该研究小组配制该植物培养液时,还须用到的实验仪器是________ (填字母)。
(3)甲同学用KCl和(NH4)2SO4两种物质进行配制,则需称取m(KCl)=____ g,m[(NH4)2SO4]=___ g。
(4)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是_________ (填选项)。
A.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
C.用胶头滴管向容量瓶中加水时,溶液的凹液面高于容量瓶刻度线
D.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
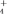 、Cl-、K+、SO42—的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥量筒。请回答下列问题:
、Cl-、K+、SO42—的植物培养液450 mL,且要求该培养液中c(Cl-)=c(K+)=c(SO42—)=0.4 mol·L-1。实验室提供的药品有:NH4Cl、KCl、(NH4)2SO4、K2SO4和蒸馏水;提供的实验仪器有:①药匙 ②托盘天平 ③烧杯 ④玻璃棒 ⑤胶头滴管 ⑥量筒。请回答下列问题:(1)该植物培养液中,NH
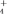 的物质的量浓度为
的物质的量浓度为(2)该研究小组配制该植物培养液时,还须用到的实验仪器是
A.450 mL容量瓶 B.500 mL容量瓶 C.两个250 mL容量瓶
(3)甲同学用KCl和(NH4)2SO4两种物质进行配制,则需称取m(KCl)=
(4)若配制该培养液的其他操作均正确,则下列错误操作将使所配制溶液的浓度偏低的是
A.将溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的溶液向容量瓶中转移时,因操作不当使部分溶液溅出容量瓶
C.用胶头滴管向容量瓶中加水时,溶液的凹液面高于容量瓶刻度线
D.用胶头滴管向容量瓶中加水时,俯视容量瓶刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】现需要0.200mol/LNa2CO3溶液100mL,实验室除蒸馏水外还提供Na2CO3·10H2O晶体及仪器若干。
(1)用Na2CO3·10H2O晶体进行配制,为了保证实验的精度,称量晶体时应选择________ 天平,需称取晶体的质量为_______________ g。
(2)用称量好的晶体配制溶液时,还需以下几个步骤:
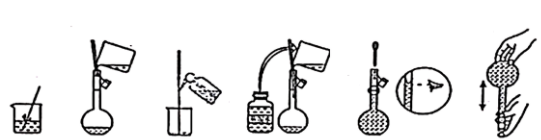
写出步骤②,⑤的操作名称:②________ ,⑤________ 步骤②中用到的仪器除烧杯、玻璃棒外,还用到的一种玻璃仪器是_________ .,该仪器(已洗涤)使用前必须进行的操作是___________ 。
(3)在配制过程中,其他操作都正确,下列操作会引起浓度偏低的是____ (填字母)。
A 容量瓶未干燥,有少量蒸馏水
B 配制过程中,缺少步骤③的操作
C 步骤⑤中,俯视刻度线
D 摇匀后,发现液面低于刻度线,再加水至刻度线
E 取用在干燥空气中久置后的晶体进行称量
(1)用Na2CO3·10H2O晶体进行配制,为了保证实验的精度,称量晶体时应选择
(2)用称量好的晶体配制溶液时,还需以下几个步骤:

写出步骤②,⑤的操作名称:②
(3)在配制过程中,其他操作都正确,下列操作会引起浓度偏低的是
A 容量瓶未干燥,有少量蒸馏水
B 配制过程中,缺少步骤③的操作
C 步骤⑤中,俯视刻度线
D 摇匀后,发现液面低于刻度线,再加水至刻度线
E 取用在干燥空气中久置后的晶体进行称量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】“84”消毒液能有效杀灭新型冠状病毒,某同学购买了一瓶“84”消毒液,其说明中有如下信息:NaClO质量分数25% 、密度1.19g·cm-3、 1000mL,稀释后使用。请根据信息和相关知识回答下列问题:
(1)该“84”消毒液的物质的量浓度为_______ mol·L-1;(保留至小数点后一位)
(2)该同学取10mL该“84”消毒液,加水稀释为200mL溶液,稀释后的溶液中c(Na+)=________ mol·L-1;
(3)现实验室需要480mL0.2mol/L的NaClO溶液,某同学用NaClO固体配制该物质的量浓度的溶液。
①应用托盘天平称取NaClO固体________ g ;
②配制NaClO溶液时需用的主要仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、__________ 、________ ;
③实验时遇下列情况,会导致溶液物质的量浓度偏高的是__________ 。
A.容量瓶内壁附有水珠而未干燥处理
B.称量使用的砝码已生锈
C.溶解时使用的烧杯及玻璃棒未洗涤
D.溶解后没有冷却便进行定容
E.定容时俯视刻度线
F.摇匀后发现液面低于刻度线后未作处理
(1)该“84”消毒液的物质的量浓度为
(2)该同学取10mL该“84”消毒液,加水稀释为200mL溶液,稀释后的溶液中c(Na+)=
(3)现实验室需要480mL0.2mol/L的NaClO溶液,某同学用NaClO固体配制该物质的量浓度的溶液。
①应用托盘天平称取NaClO固体
②配制NaClO溶液时需用的主要仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、
③实验时遇下列情况,会导致溶液物质的量浓度偏高的是
A.容量瓶内壁附有水珠而未干燥处理
B.称量使用的砝码已生锈
C.溶解时使用的烧杯及玻璃棒未洗涤
D.溶解后没有冷却便进行定容
E.定容时俯视刻度线
F.摇匀后发现液面低于刻度线后未作处理
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】小曹同学计划制备白色的Fe(OH)2沉淀,请帮助他完善实验过程:
I.小曹同学准备用NaOH固体配制240mL 的NaOH溶液。
的NaOH溶液。
(1)本实验必须用到的玻璃仪器有:量筒、胶头滴管、烧杯、___________ 。
(2)要配制出此溶液,小曹同学应称出___________ gNaOH。
(3)在配制过程中,小曹同学的其他操作都是正确的,但下列操作中会引起所配制溶液浓度偏高的一项是___________(填字母)。
Ⅱ.配制完成NaOH溶液后,小曹同学准备利用下述装置和配制好的NaOH溶液、铁屑、稀硫酸等试剂制取Fe(OH)2沉淀
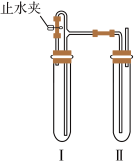
(4)试管I中加入的试剂是___________ 。
(5)小曹同学分别在试管I和Ⅱ中加入试剂,然后迅速打开止水夹,塞紧塞子后检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹,此后试管Ⅱ中可以较长时间看到Fe(OH)2白色沉淀,其原因是___________ ,下列操作中也可以实现相同效果的是___________ (填字母)。
(6)如果Ⅱ中空气未排净,则Fe(OH)2白色沉淀将被氧化为Fe(OH)3,请写出该过程化学方程式_______ 。
I.小曹同学准备用NaOH固体配制240mL
 的NaOH溶液。
的NaOH溶液。(1)本实验必须用到的玻璃仪器有:量筒、胶头滴管、烧杯、
(2)要配制出此溶液,小曹同学应称出
(3)在配制过程中,小曹同学的其他操作都是正确的,但下列操作中会引起所配制溶液浓度偏高的一项是___________(填字母)。
| A.NaOH固体在称量前已部分变质 |
| B.有少量NaOH溶液残留在烧杯里 |
| C.定容时,俯视容量瓶的刻度线 |
| D.定容摇匀后,发现溶液凹液面最低处时低于刻度线,用胶头滴管补水至刻度线 |
Ⅱ.配制完成NaOH溶液后,小曹同学准备利用下述装置和配制好的NaOH溶液、铁屑、稀硫酸等试剂制取Fe(OH)2沉淀

(4)试管I中加入的试剂是
(5)小曹同学分别在试管I和Ⅱ中加入试剂,然后迅速打开止水夹,塞紧塞子后检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹,此后试管Ⅱ中可以较长时间看到Fe(OH)2白色沉淀,其原因是

(6)如果Ⅱ中空气未排净,则Fe(OH)2白色沉淀将被氧化为Fe(OH)3,请写出该过程化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】工业上利用废镍催化剂(主要成分为 ,还含有一定量的
,还含有一定量的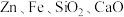 等)制备草酸镍晶体的流程如下:
等)制备草酸镍晶体的流程如下:

(1)请写出一种能提高“酸浸”速率的措施:____________ ;滤渣I的成分是____________ (填化学式)。
(2)除铁时,控制不同的条件可以得到不同的滤渣Ⅱ。已知滤渣Ⅱ的成分与温度、 的关系如图所示:
的关系如图所示:

①若控制温度 、
、 ,则滤渣Ⅱ的主要成分为
,则滤渣Ⅱ的主要成分为________________________ (填化学式)。
②若控制温度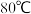 、
、 ,可得到黄铁矾钠
,可得到黄铁矾钠 (图中阴影部分),写出生成黄铁矾钠的离子反应方程式
(图中阴影部分),写出生成黄铁矾钠的离子反应方程式________________________ 。
(3)已知除铁后所得 溶液中
溶液中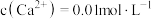 ,加入
,加入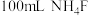 溶液,使
溶液,使 恰好沉淀完全,即溶液中
恰好沉淀完全,即溶液中 ,则所加
,则所加
____________  。[已知
。[已知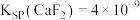 ]
]
(4)加入有机萃取剂的作用是________________________ 。
(5)某化学镀镍试剂的化学式为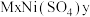 (M为
(M为 价阳离子,
价阳离子, 为
为 价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
I.称量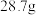 镀镍试剂,配制
镀镍试剂,配制 溶液A;
溶液A;
Ⅱ.准确量取 溶液A,用
溶液A,用 的
的 标准溶液滴定其中的
标准溶液滴定其中的 (离子方程式为
(离子方程式为 ),消耗
),消耗 标准溶液
标准溶液 ;
;
Ⅲ.另取 溶液A,加入足量的
溶液A,加入足量的 溶液,得到白色沉淀
溶液,得到白色沉淀 。
。
IV.取 溶液A,加入足量的
溶液A,加入足量的 溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体
溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体
①配制 镀镍试剂时,除了药匙、天平、玻璃棒、量筒外,还需要仪器有
镀镍试剂时,除了药匙、天平、玻璃棒、量筒外,还需要仪器有____________ 。
②该镀镍试剂的化学式为_____________ 。
 ,还含有一定量的
,还含有一定量的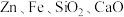 等)制备草酸镍晶体的流程如下:
等)制备草酸镍晶体的流程如下:
(1)请写出一种能提高“酸浸”速率的措施:
(2)除铁时,控制不同的条件可以得到不同的滤渣Ⅱ。已知滤渣Ⅱ的成分与温度、
 的关系如图所示:
的关系如图所示:
①若控制温度
 、
、 ,则滤渣Ⅱ的主要成分为
,则滤渣Ⅱ的主要成分为②若控制温度
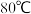 、
、 ,可得到黄铁矾钠
,可得到黄铁矾钠 (图中阴影部分),写出生成黄铁矾钠的离子反应方程式
(图中阴影部分),写出生成黄铁矾钠的离子反应方程式(3)已知除铁后所得
 溶液中
溶液中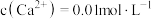 ,加入
,加入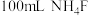 溶液,使
溶液,使 恰好沉淀完全,即溶液中
恰好沉淀完全,即溶液中 ,则所加
,则所加
 。[已知
。[已知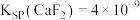 ]
](4)加入有机萃取剂的作用是
(5)某化学镀镍试剂的化学式为
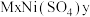 (M为
(M为 价阳离子,
价阳离子, 为
为 价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:I.称量
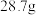 镀镍试剂,配制
镀镍试剂,配制 溶液A;
溶液A;Ⅱ.准确量取
 溶液A,用
溶液A,用 的
的 标准溶液滴定其中的
标准溶液滴定其中的 (离子方程式为
(离子方程式为 ),消耗
),消耗 标准溶液
标准溶液 ;
;Ⅲ.另取
 溶液A,加入足量的
溶液A,加入足量的 溶液,得到白色沉淀
溶液,得到白色沉淀 。
。IV.取
 溶液A,加入足量的
溶液A,加入足量的 溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体
溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体①配制
 镀镍试剂时,除了药匙、天平、玻璃棒、量筒外,还需要仪器有
镀镍试剂时,除了药匙、天平、玻璃棒、量筒外,还需要仪器有②该镀镍试剂的化学式为
您最近一年使用:0次



