硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
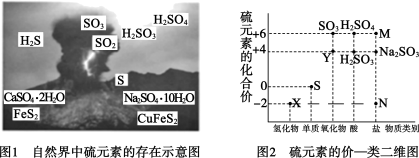
(1)图1中与图2中M、N对应的物质分别是_____ 、______ 。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为______ 。
(3)Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的基本操作是_____ 。
(4)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
①方案甲,中铜和浓硫酸反应的化学方程式是______ 。该反应体现了浓硫酸的______ 性。
②这两种方案,你认为哪一种方案更合理?______ 。理由是______ 。

(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)Na2SO3溶液易变质,实验室检验Na2SO3溶液是否变质的基本操作是
(4)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
①方案甲,中铜和浓硫酸反应的化学方程式是
②这两种方案,你认为哪一种方案更合理?
更新时间:2021-03-05 22:51:17
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,生成有毒气体,反应的化学方程式为8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O。所得混合气体的平均相对分子质量为________ 。
(2)实验室可用软锰矿(主要成分为MnO2)制取KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3 (s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为________ 。
(3)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、 、
、 、
、 。
。
①该反应的离子方程式为________________________ 。在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1 L,测得溶液的pH=2,则在反应中转移电子的物质的量为________ mol。(结果写成小数,保留三位有效数字)
②在测定锰离子浓度的实验中,需要配制250 mL 0.10mol/L KIO4的标准溶液,应用托盘天平称取______ g KIO4固体。
③下列有关配制溶液的操作或判断正确的是( )
A.使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
B.容量瓶用蒸馏水洗净后,没有烘干就用来配制溶液
C.定容摇匀后液面下降再加水到刻度线,不影响所配溶液浓度
D.定容时仰视刻度线会导致所配溶液浓度偏高
E.当容量瓶中的液面距离刻度线2~3cm时改用胶头滴管加水定容
(2)实验室可用软锰矿(主要成分为MnO2)制取KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3 (s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为
(3)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、
 、
、 、
、 。
。①该反应的离子方程式为
②在测定锰离子浓度的实验中,需要配制250 mL 0.10mol/L KIO4的标准溶液,应用托盘天平称取
③下列有关配制溶液的操作或判断正确的是
A.使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
B.容量瓶用蒸馏水洗净后,没有烘干就用来配制溶液
C.定容摇匀后液面下降再加水到刻度线,不影响所配溶液浓度
D.定容时仰视刻度线会导致所配溶液浓度偏高
E.当容量瓶中的液面距离刻度线2~3cm时改用胶头滴管加水定容
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐2】现有下列物质(括号内为对应物质的主要成分):a.熔融NaOH;b.医用酒精;c.蔗糖晶体;d.加碘盐(NaCl和KIO3);e.“84”消毒液(NaClO);f.小苏打(NaHCO3);g.洁厕灵(HCl),回答下列问题:
(1)上述状态下的物质中,属于电解质且能导电的是_______ (填字母,下同);d和f均为厨房中的常用物质,可用于区分两者的物质是________ 。
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:________ 。
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:___________ ;该反应中被氧化的Ⅰ原子与被还原的Ⅰ原子的个数之比为___________ 。
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:_____ ,__NaClO2+__NaHSO4=___ClO2+___NaCl+__Na2SO4+____H2O;若每片泡腾片中NaClO2的质量分数≥17%为合格品,上述所得ClO2溶液的物质的量浓度为0.002mol/L,则所用泡腾片____ (填“属于”或“不属于”)合格品。
(1)上述状态下的物质中,属于电解质且能导电的是
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】零价铁还原性强、活性高,对很多重金属离子及含磷、砷离子都有较好的去除和富集作用。
Ⅰ.零价铁的制备。
(1)富铁矿石经破碎、筛分到微米级后,在氢气氛围下600℃高温还原1h可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式___________ 。
(2)采用 还原铁盐,可以制备出纳米级的零价铁。
还原铁盐,可以制备出纳米级的零价铁。
已知:B的电负性是2.0,H的电负性是2.1
①请写出 的电子式
的电子式___________ 。
②请写出 与硫酸反应的离子方程式
与硫酸反应的离子方程式___________ 。
③补充完整下列离子方程式___________
___________ ___________
___________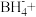 ___________
___________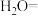 ___________Fe+___________
___________Fe+___________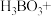 ___________
___________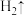
Ⅱ.零价铁的结构和作用机理。
研究发现,纳米级和微米级的零价铁,均具有“核—壳”结构。
已知:①壳层可以导电;
②当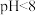 时,铁的氧化物质子化,壳层表面带正电;当
时,铁的氧化物质子化,壳层表面带正电;当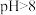 时,铁的氧化物去质子化,壳层表面带负电;
时,铁的氧化物去质子化,壳层表面带负电;
③磷酸盐溶解度一般较小。
(3)去离子水中加入零价铁,pH从6上升到9.5左右。检测壳层物质,发现有 、
、 、
、 、
、 等。导致产生壳层微粒的氧化剂是
等。导致产生壳层微粒的氧化剂是 、
、___________ 。
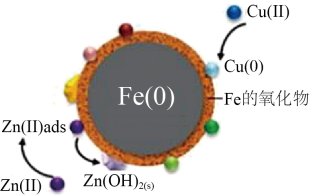
(4)部分金属阳离子去除机理如图所示。纳米零铁去除污水中Cu(Ⅱ)、Zn(Ⅱ)主要机理不同,请简述两者的区别并解释原因___________ 。
(5)去除含磷( )微粒:
)微粒:
①控制pH___________ 8。
②通过形成___________ (填化学式)进一步去除 。
。
(6)综上所述,零价铁去除重金属离子及含磷微粒的主要机理有___________ 。
Ⅰ.零价铁的制备。
(1)富铁矿石经破碎、筛分到微米级后,在氢气氛围下600℃高温还原1h可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式
(2)采用
 还原铁盐,可以制备出纳米级的零价铁。
还原铁盐,可以制备出纳米级的零价铁。已知:B的电负性是2.0,H的电负性是2.1
①请写出
 的电子式
的电子式②请写出
 与硫酸反应的离子方程式
与硫酸反应的离子方程式③补充完整下列离子方程式
___________
 ___________
___________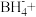 ___________
___________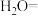 ___________Fe+___________
___________Fe+___________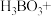 ___________
___________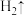
Ⅱ.零价铁的结构和作用机理。
研究发现,纳米级和微米级的零价铁,均具有“核—壳”结构。
已知:①壳层可以导电;
②当
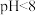 时,铁的氧化物质子化,壳层表面带正电;当
时,铁的氧化物质子化,壳层表面带正电;当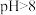 时,铁的氧化物去质子化,壳层表面带负电;
时,铁的氧化物去质子化,壳层表面带负电;③磷酸盐溶解度一般较小。
(3)去离子水中加入零价铁,pH从6上升到9.5左右。检测壳层物质,发现有
 、
、 、
、 、
、 等。导致产生壳层微粒的氧化剂是
等。导致产生壳层微粒的氧化剂是 、
、(4)部分金属阳离子去除机理如图所示。纳米零铁去除污水中Cu(Ⅱ)、Zn(Ⅱ)主要机理不同,请简述两者的区别并解释原因

(5)去除含磷(
 )微粒:
)微粒:①控制pH
②通过形成
 。
。(6)综上所述,零价铁去除重金属离子及含磷微粒的主要机理有
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐1】硫代硫酸钠(Na2S2O3)俗名为大苏打或海波,在碱性条件下稳定,遇酸易分解。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,同时生成CO2。
已知:①SO2+2H2S=3S↓+2H2O;②CuSO4+H2S=CuS↓(黑色)+H2SO4。请回答下列问题:
(1)Na2S2O3中S元素的化合价为______ 价。
(2)Na2S2O3与稀H2SO4反应的离子方程式为__________ 。
(3)制备Na2S2O3的化学方程式为_________________ ,在制备过程中通入的SO2不能过量,原因为__________ 。
(4)在配制混合溶液前先将蒸馏水加热煮沸一段时间后再用,其目的是__________________ 。
(5)制得的Na2S2O3晶体中常混有Na2S杂质,某同学取少量制得的晶体溶于足量稀H2SO4中,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此该同学认为制得的晶体中不含Na2S杂质。你认为其结论是否合理?_____ (填“合理”或“不合理"),理由为__________________ 。
已知:①SO2+2H2S=3S↓+2H2O;②CuSO4+H2S=CuS↓(黑色)+H2SO4。请回答下列问题:
(1)Na2S2O3中S元素的化合价为
(2)Na2S2O3与稀H2SO4反应的离子方程式为
(3)制备Na2S2O3的化学方程式为
(4)在配制混合溶液前先将蒸馏水加热煮沸一段时间后再用,其目的是
(5)制得的Na2S2O3晶体中常混有Na2S杂质,某同学取少量制得的晶体溶于足量稀H2SO4中,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此该同学认为制得的晶体中不含Na2S杂质。你认为其结论是否合理?
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。___________ 、___________ 。
(2) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
(3)已知 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与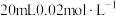 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:___________ 。
(4)过二硫酸钠( )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为___________ 。
(5)雌黄( )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。
① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
② 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若 参加反应时,转移
参加反应时,转移 电子,则物质a为
电子,则物质a为___________ 。

(2)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(3)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与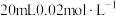 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(4)过二硫酸钠(
 )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(5)雌黄(
 )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。①
 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为②
 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若 参加反应时,转移
参加反应时,转移 电子,则物质a为
电子,则物质a为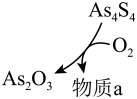
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
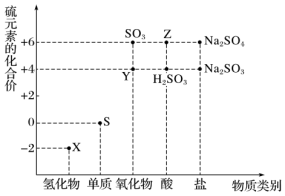
(1)S在周期表中的位置是_______ ;非金属性S_______ Cl(填“>”或“<”),S与Cl的最高价氧化物对应的水化物相比,酸性更强的是_______ (填化学式)。
(2)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______ (填化学式)。
(3)写出X的电子式_______ ;若将X与Y混合可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______ 。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。

(1)S在周期表中的位置是
(2)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(3)写出X的电子式
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近半年使用:0次



