已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4.试回答:
(1)该化合物中是否存在氢键(填“是”或“否”)___________ ,分子为___________ (填“极性分子”或“非极性分子”)。
(2)该化合物在常温下为液体,该液体微粒间的作用力是___________ 。
(3)该化合物的沸点与SiCl4比较:___________ (填化学式)的高,原因是___________ 。
(1)该化合物中是否存在氢键(填“是”或“否”)
(2)该化合物在常温下为液体,该液体微粒间的作用力是
(3)该化合物的沸点与SiCl4比较:
更新时间:2021-03-18 16:24:34
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】水是地球上最常见的物质之一,是所有生命生存的重要资源。
(1) 键和
键和 键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为
键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为________ ;水溶液中存在H3O+离子,写出该微粒的结构式________ (标出配位键)。
(2)科学家发现在特殊条件下,水能表现出许多种有趣的结构和性质
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下:

使水结成“热冰”采用“弱电场”的条件,说明水分子是______ 分子。下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用力类型完全相同的是______ 。
A.固态氨 B.食盐 C.干冰 D.金刚石
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。产生的阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式__________ ;该阳离子还能与水作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式____________________ 。
(3)水的性质中的一些特殊现象对于生命的存在意义非凡,请解释水的分解温度远高于其沸点的原因______________________ ;试从结构的角度分析固态水(冰)的密度小于液态水的密度的原因是___________________________ 。
(4)甲烷的气体水合物晶体称为可燃冰,存在于海底和冰川底部,是巨大的潜在能源。在可燃冰晶体中,甲烷分子装在水分子构成的笼内,假设可燃冰晶体中的水笼里装的都是甲烷,理想的可燃冰晶胞组成为8CH4·46H2O,X-射线衍射分析表明,可燃冰晶体属于立方晶体,晶胞参数a=1200pm。则该晶体的密度为________ g/cm3(计算结果保留两位有效数字)
(1)
 键和
键和 键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为
键是共价键的两种基本类型,则H2O分子中含有的共价键数目和类型为(2)科学家发现在特殊条件下,水能表现出许多种有趣的结构和性质
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下:

使水结成“热冰”采用“弱电场”的条件,说明水分子是
A.固态氨 B.食盐 C.干冰 D.金刚石
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。产生的阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式
(3)水的性质中的一些特殊现象对于生命的存在意义非凡,请解释水的分解温度远高于其沸点的原因
(4)甲烷的气体水合物晶体称为可燃冰,存在于海底和冰川底部,是巨大的潜在能源。在可燃冰晶体中,甲烷分子装在水分子构成的笼内,假设可燃冰晶体中的水笼里装的都是甲烷,理想的可燃冰晶胞组成为8CH4·46H2O,X-射线衍射分析表明,可燃冰晶体属于立方晶体,晶胞参数a=1200pm。则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的电负性由小到大的顺序为________________ 。
(2)C的最高价氧化物分子是________ (填“极性”或“非极性”)分子。
(3)与B同主族元素X,其气态氢化物是同主族元素的氢化物中沸点最高的,解释X的气态氢化物极易溶于水的原因:①_______________ ②_______________
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为____ ;E(CO)5在一定条件下发生分解反应:E(CO)5===E(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是________________ 。
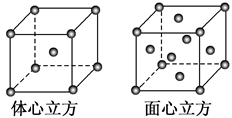
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。
体心立方晶胞和面心立方晶胞中E原子的配位数之比为________________ 。
(1)A、B、C、D的电负性由小到大的顺序为
(2)C的最高价氧化物分子是
(3)与B同主族元素X,其气态氢化物是同主族元素的氢化物中沸点最高的,解释X的气态氢化物极易溶于水的原因:①
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。
体心立方晶胞和面心立方晶胞中E原子的配位数之比为

您最近一年使用:0次
【推荐3】近日,以色列魏茨曼科学研究所提出了一种新颖的模块化催化剂框架,通过简单的合成发现,三铜取代的化合物[SiCu3W9]在CO2还原为CO过程具有最佳活性,FeNi2取代的化合物[SiFeNi2W9]在CO氧化为CO2过程具有最佳活性。请回答下列问题:
(1)Ni在周期表中的位置为_______ ;同周期与Ni具有相同的未成对电子数目的元素有_______ (写出相应元素符号);Ni、Cu原子的第一电离能更大的是_______ 。
(2)Ni与CO形成配合物Ni(CO)4,配体是_______ ,提供孤对电子的原子是_______ ;常温时Ni(CO)4为无色液体,难溶于水,易溶于有机溶剂,推测Ni(CO)4是_______ 分子(填“极性”或“非极性”)。
(3)Cu元素可以形成配合物Cu(NH3)4(NO3)2,1 mol该配合物含有_______ mol σ键。铜可以形成多种合金,钙铜合金晶体结构图C可看作由图A、B两种原子层交替堆积排列而成。

钙铜合金的化学式:_______ ;在这结构中,NA表示阿伏加德罗常数,钙铜合金的密度为_______ g/cm3(用a、b、NA的代数式表示)。
(1)Ni在周期表中的位置为
(2)Ni与CO形成配合物Ni(CO)4,配体是
(3)Cu元素可以形成配合物Cu(NH3)4(NO3)2,1 mol该配合物含有

钙铜合金的化学式:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态O原子的电子排布图为_______ ,基态O原子电子占据最高能级的电子云轮廓图为____ 形,O原子最外层电子的运动状态有_____ 种。
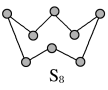
(2)下图为S8的结构,该分子中S原子的杂化轨道类型为______________ 。其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_____________ 。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为_____ 形;固体三氧化硫中存在如下图所示的三聚分子,该分子中S原子的价层电子数___________ 。
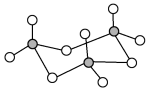
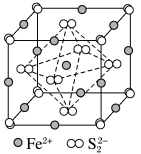
(4)FeS2晶体的晶胞如图所示。晶胞中有Fe2+_____ 个,有S22-_____ 个,晶胞中Fe2+位于S22-所形成的____ (填空隙名称)的体心。晶胞边长为a nm、FeS2相对分子质量为M,阿伏伽德罗常数的值为NA,其晶体密度的计算表达式为___________ g•cm﹣3。
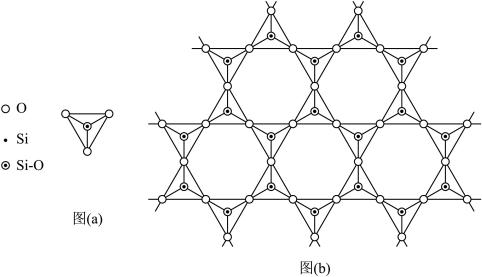
(5)在硅酸盐中,SiO44﹣四面体(如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长层状结构的多硅酸根;其中Si原子的杂化形式为____ 。该多硅酸根的化学式为_____ 。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | −85.5 | 115.2 | >600(分解) | −75.5 | 16.8 | 10.3 |
| 沸点/℃ | −60.3 | 444.6 | −10.0 | 45.0 | 337.0 |
(1)基态O原子的电子排布图为
(2)下图为S8的结构,该分子中S原子的杂化轨道类型为

(3)气态三氧化硫以单分子形式存在,其分子的立体构型为

(4)FeS2晶体的晶胞如图所示。晶胞中有Fe2+

(5)在硅酸盐中,SiO44﹣四面体(如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长层状结构的多硅酸根;其中Si原子的杂化形式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】凉山州是矿产资源“聚宝盆”,下辖的会东、金阳、雷波等县磷矿资源丰富,磷化工产业比较发达。请回答下列问题:
(1)基态磷原子的价电子排布图为:___________ ;其基态原子核外有___________ 种不同能量的电子。
(2)含磷药物磷酸氯喹对治疗新冠肺炎有一定效果,其结构如下图。
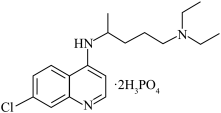
磷酸氯喹中所含第二周期元素第一电离能由大到小的顺序为:___________ ,其中碳原子的轨道杂化类型为:___________ 。
(3)卤化磷通常有三卤化磷和五卤化磷。三卤化磷的熔点见下表,试解释PF3、PCl3、PBr3、PI3熔点逐渐升高的原因是___________ 。
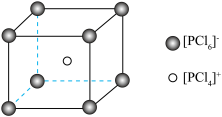
(4)已知PCl5晶体中含有等量的[PCl4]+和[PCl6]-。
①PCl5晶体中的化学键有___________ ,其中[PCl4]+的空间构型为___________ 。
②PCl5晶胞结构如下图,晶胞中含有的P原子的个数为___________ ,已知晶胞边长为apm,阿伏加德罗常数为NA,则该晶体密度为___________ g/cm3(列出计算式即可)。
(1)基态磷原子的价电子排布图为:
(2)含磷药物磷酸氯喹对治疗新冠肺炎有一定效果,其结构如下图。

磷酸氯喹中所含第二周期元素第一电离能由大到小的顺序为:
(3)卤化磷通常有三卤化磷和五卤化磷。三卤化磷的熔点见下表,试解释PF3、PCl3、PBr3、PI3熔点逐渐升高的原因是
| 三卤化磷 | PF3 | PCl3 | PBr3 | PI3 |
| 熔点/℃ | -151.5 | -93.6 | -41.5 | 61.2 |
①PCl5晶体中的化学键有
②PCl5晶胞结构如下图,晶胞中含有的P原子的个数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】I.含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
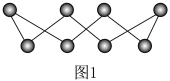
(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是_____ 。
(2)H2SeO4比H2SeO3酸性强的原因:_________ 。
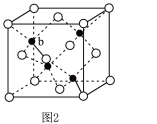
(3)ZnS在光导体材料、荧光体、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图2所示,其晶胞边长为a pm,密度为______ g⋅cm−3。(用含a和NA的表达式填空)
II.氮及其化合物与人类生产、生活息息相关。化肥(NH4)2SO4中会含有N4H4(SO4)2,该物质在水中电离出SO42-和N4H44+,N4H44+遇到碱性溶液会生成一种形似白磷(P4)的N4分子。请回答下列问题:
(4)N4分子中的氮氮键的键角为____ ,1molN4分子中含有的氮氮键的数目为____ 。
(5)N4比P4的沸点____ (填“高”或“低”),原因为________ 。
(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是

(2)H2SeO4比H2SeO3酸性强的原因:
(3)ZnS在光导体材料、荧光体、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图2所示,其晶胞边长为a pm,密度为

II.氮及其化合物与人类生产、生活息息相关。化肥(NH4)2SO4中会含有N4H4(SO4)2,该物质在水中电离出SO42-和N4H44+,N4H44+遇到碱性溶液会生成一种形似白磷(P4)的N4分子。请回答下列问题:
(4)N4分子中的氮氮键的键角为
(5)N4比P4的沸点
您最近一年使用:0次



