下列叙述错误的是
①溶质为同一弱电解质的溶液,当温度不同时,其导电能力也不相同
②强电解质在液态时,有的导电,有的不导电
③取等体积等c(H+)的醋酸和盐酸两种溶液分别中和相同浓度的NaOH溶液,盐酸消耗NaOH的物质的量比醋酸多
④CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
⑤取等体积等浓度的醋酸和盐酸两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率:盐酸大于醋酸
⑥0.10mol/LCH3COOH加水稀释,醋酸电离程度增大,溶液的c(H+)增大
⑦0.10mol/LCH3COOH加水稀释过程中, 不断增大
不断增大
①溶质为同一弱电解质的溶液,当温度不同时,其导电能力也不相同
②强电解质在液态时,有的导电,有的不导电
③取等体积等c(H+)的醋酸和盐酸两种溶液分别中和相同浓度的NaOH溶液,盐酸消耗NaOH的物质的量比醋酸多
④CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
⑤取等体积等浓度的醋酸和盐酸两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率:盐酸大于醋酸
⑥0.10mol/LCH3COOH加水稀释,醋酸电离程度增大,溶液的c(H+)增大
⑦0.10mol/LCH3COOH加水稀释过程中,
 不断增大
不断增大| A.①③ | B.④⑤ | C.②⑦ | D.③⑥ |
更新时间:2021-04-01 17:11:13
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】25 ℃时,下列有关电解质溶液的说法正确的是
A.加水稀释0.1 mol·L-1氨水,溶液中c(H+)·c(OH-)和 均保持不变 均保持不变 |
B.向CH3COONa溶液中加入少量CH3COONa,溶液中 的值增大 的值增大 |
C.等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合: < <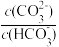 |
D.将浓度为0.1 mol·L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变, 始终增大 始终增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知,25℃时有关弱酸的电离平衡常数如下表:
下列有关说法正确的是
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7,K2=5.6×l0-11 |
| A.将0.1mol/L的醋酸溶液加水稀释,则c(H+)/c(OH-)会减小 |
| B.冰醋酸中逐滴加水,溶液的导电性和pH、醋酸的电离程度均先增大后减小 |
C.向NaCN溶液中通入少量CO2:2CN-+CO2+H2O=2HCN+CO |
| D.测得50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液混合时放出28.65kJ的热量,则稀醋酸和稀NaOH溶液反应的ΔH=-57.3kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】某温度下,等体积、等浓度的 和
和 加水稀释时,
加水稀释时, 变化如图所示。下列叙述正确的是
变化如图所示。下列叙述正确的是

 和
和 加水稀释时,
加水稀释时, 变化如图所示。下列叙述正确的是
变化如图所示。下列叙述正确的是
A. |
B.a,b两点溶液与 溶液中和,恰好完全反应时前者消耗 溶液中和,恰好完全反应时前者消耗 多 多 |
C.对a点溶液加热, 增大 增大 |
D.点b至点c, 增大 增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列说法不正确 的是
A.测定0.1 醋酸溶液的 醋酸溶液的 可证明醋酸是弱电解质 可证明醋酸是弱电解质 |
| B.稀释氨水,溶液中c(OH-)减小 |
C.常温下,将1  的盐酸稀释至1L, 的盐酸稀释至1L, 约为 约为 |
D.相同温度下,中和相同 、相同体积的盐酸和醋酸溶液,消耗 、相同体积的盐酸和醋酸溶液,消耗 物质的量不同 物质的量不同 |
您最近一年使用:0次



