下图为元素周期表的一部分,根据元素①~⑧在表中的位置回答下列问题。
(1)元素⑧的最高价氧化物对应水化物的分子式为___________ ;
(2)元素①与④形成的18电子的化合物的结构式为___________ ;
(3)用电子式表示元素⑤与⑧形成化合物的过程___________ ;
(4)假设元素⑧的对应元素符号为X,若在一定条件下,X单质能够与硫反应生成一种用途广泛的硫化剂S2X2.该硫化剂S2X2与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液褪色的无色气体,则该反应的化学方程式是___________ (元素X请用具体元素符号表示)。
(5)元素①与③形成的简单化合物是___________ 分子(填极性或非极性)
(6)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)ΔH=-akJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g)ΔH=+bkJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)ΔH=-ckJ/mol
2H2(g)+O2(g)=2H2O(l)ΔH=-dkJ/mol(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量___________ (填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
族 周期 | Ⅰ | 0 | ||||||
| 1 | ① | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)元素①与④形成的18电子的化合物的结构式为
(3)用电子式表示元素⑤与⑧形成化合物的过程
(4)假设元素⑧的对应元素符号为X,若在一定条件下,X单质能够与硫反应生成一种用途广泛的硫化剂S2X2.该硫化剂S2X2与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液褪色的无色气体,则该反应的化学方程式是
(5)元素①与③形成的简单化合物是
(6)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)ΔH=-akJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g)ΔH=+bkJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)ΔH=-ckJ/mol
2H2(g)+O2(g)=2H2O(l)ΔH=-dkJ/mol(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量
更新时间:2021-04-02 19:36:23
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】合成氨反应[N2(g)+3H2(g)⇌2NH3(g)]是人工固氮的主要手段,对人类生存、社会进步和经济发展都有着重大意义。
回答下列问题:
(1)合成氨反应的反应历程和能量变化如图所示:
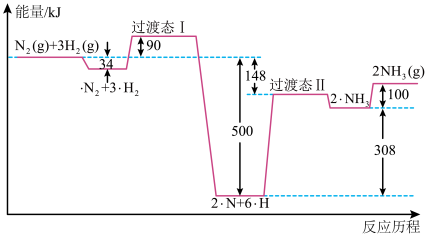
①N2(g)+3H2(g)⇌2NH3(g) △H=____________ 。
②对总反应速率影响较小的步骤的能垒(活化能)为_______ kJ/mol,该步骤的化学方程式为______________ 。
(2)一定温度下,向10 L恒容密闭容器中充入1 mol N2(g)和3 mol H2(g),发生合成氨反应。10 min末达到平衡,测得NH3的体积分数为60%。
①N2的平衡体积分数为___________ 。
②0~10 min内,用H2的浓度变化表示的平均反应速率v(H2)=_____________ 。
(3)合成氨反应中,正反应速率v正=k正●c(N2)●c3(H2),逆反应速率v逆=k逆●c2(NH3),k正、k逆为速率常数。正反应和逆反应的平衡常数与温度的关系如图所示:
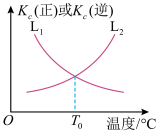
①表示逆反应的平衡常数与温度变化关系的曲线为_____ (填“L1”或 “L2"),理由为_________________ 。
②T0°C时,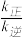 =
= _________________ 。
回答下列问题:
(1)合成氨反应的反应历程和能量变化如图所示:

①N2(g)+3H2(g)⇌2NH3(g) △H=
②对总反应速率影响较小的步骤的能垒(活化能)为
(2)一定温度下,向10 L恒容密闭容器中充入1 mol N2(g)和3 mol H2(g),发生合成氨反应。10 min末达到平衡,测得NH3的体积分数为60%。
①N2的平衡体积分数为
②0~10 min内,用H2的浓度变化表示的平均反应速率v(H2)=
(3)合成氨反应中,正反应速率v正=k正●c(N2)●c3(H2),逆反应速率v逆=k逆●c2(NH3),k正、k逆为速率常数。正反应和逆反应的平衡常数与温度的关系如图所示:

①表示逆反应的平衡常数与温度变化关系的曲线为
②T0°C时,
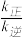 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】硫及其化合物之间的转化具有重要意义。回答下列问题:
(1) 分子可形成单斜硫和斜方硫,其转化过程为
分子可形成单斜硫和斜方硫,其转化过程为 ,这是一个正反应放热的可逆反应。则
,这是一个正反应放热的可逆反应。则 、
、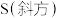 相比,较稳定的是
相比,较稳定的是___________ [填“ ”或“
”或“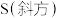 ”]。
”]。
(2)硫酸工业的一步重要反应是 的催化氧化
的催化氧化 。向一恒压密闭容器中充入一定量的
。向一恒压密闭容器中充入一定量的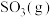 发生上述反应,能判断反应已达平衡状态的叙述是___________(填标号)。
发生上述反应,能判断反应已达平衡状态的叙述是___________(填标号)。
(3)某实验小组通过铁块与稀硫酸反应的实验,研究化学反应速率的影响因素,并绘制出如下图示:
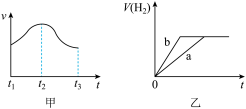
①图甲中, 到
到 速率明显加快的主要原因是
速率明显加快的主要原因是___________ 。
②图乙中,曲线a为铁块与足量稀硫酸反应生成 的体积随时间变化关系。能将曲线a转化为b的实验措施有
的体积随时间变化关系。能将曲线a转化为b的实验措施有___________ (填标号)。
A.将铁块换成铁粉
B.加 固体
固体
C.加 固体
固体
D.将稀硫酸换成98%的硫酸溶液
E.滴入几滴硫酸铜溶液
(4)硫氧化菌电池在废水处理和新能源开发域有广阔的应用前景,其工作原理如图所示。
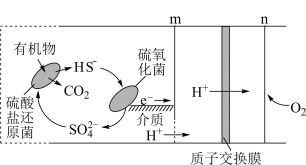
① 在硫氧化菌作用下转化为
在硫氧化菌作用下转化为 的电极反应式为
的电极反应式为___________ 。
②处理0.05mol 时,从质子交换膜左侧迁移至右侧的
时,从质子交换膜左侧迁移至右侧的
___________ mol。
(5)将 与空气的混合气体通入到
与空气的混合气体通入到 、
、 和
和 的混合溶液中,转化过程如图所示:
的混合溶液中,转化过程如图所示:
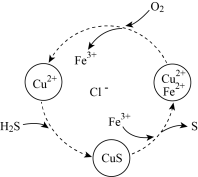
总过程的化学方程式为___________ 。
(1)
 分子可形成单斜硫和斜方硫,其转化过程为
分子可形成单斜硫和斜方硫,其转化过程为 ,这是一个正反应放热的可逆反应。则
,这是一个正反应放热的可逆反应。则 、
、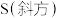 相比,较稳定的是
相比,较稳定的是 ”或“
”或“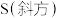 ”]。
”]。(2)硫酸工业的一步重要反应是
 的催化氧化
的催化氧化 。向一恒压密闭容器中充入一定量的
。向一恒压密闭容器中充入一定量的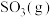 发生上述反应,能判断反应已达平衡状态的叙述是___________(填标号)。
发生上述反应,能判断反应已达平衡状态的叙述是___________(填标号)。| A.混合气体的密度不再改变 |
B.混合气体中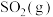 和 和 的分压之比不再改变 的分压之比不再改变 |
C. |
| D.混合气体的平均相对分子质量不再改变 |

①图甲中,
 到
到 速率明显加快的主要原因是
速率明显加快的主要原因是②图乙中,曲线a为铁块与足量稀硫酸反应生成
 的体积随时间变化关系。能将曲线a转化为b的实验措施有
的体积随时间变化关系。能将曲线a转化为b的实验措施有A.将铁块换成铁粉
B.加
 固体
固体C.加
 固体
固体D.将稀硫酸换成98%的硫酸溶液
E.滴入几滴硫酸铜溶液
(4)硫氧化菌电池在废水处理和新能源开发域有广阔的应用前景,其工作原理如图所示。

①
 在硫氧化菌作用下转化为
在硫氧化菌作用下转化为 的电极反应式为
的电极反应式为②处理0.05mol
 时,从质子交换膜左侧迁移至右侧的
时,从质子交换膜左侧迁移至右侧的
(5)将
 与空气的混合气体通入到
与空气的混合气体通入到 、
、 和
和 的混合溶液中,转化过程如图所示:
的混合溶液中,转化过程如图所示:
总过程的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氮的氧化物既是常见的大气污染物,也是重要的化工原料,它们在工农业生产、生活中都发挥着重要作用。
(1)在其他条件相同时,分别测得反应 中NO的平衡转化率在不同压强(
中NO的平衡转化率在不同压强( 、
、 )下温度变化的曲线如图:
)下温度变化的曲线如图:
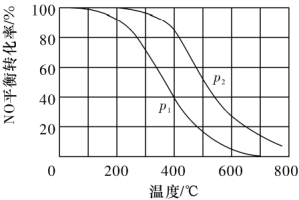
①则
_______  (填“>”“<”或“=”,下同),400℃和500℃时的平衡常数分别为
(填“>”“<”或“=”,下同),400℃和500℃时的平衡常数分别为 和
和 ,则
,则
_______  。
。
②已知 的反应历程分两步:
的反应历程分两步:
Ⅰ:

Ⅱ: (慢)
(慢) 
反应 的△H=
的△H=_______ (用含 和
和 的式子表示)。反应Ⅰ的活化能
的式子表示)。反应Ⅰ的活化能 ,与反应Ⅱ的活化能
,与反应Ⅱ的活化能 的大小关系为
的大小关系为
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)在373K时,向体积为2L的恒容真空容器中通入0.40mol ,发生反应:
,发生反应:
 的体积分数[
的体积分数[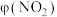 ]与反应时间(t)的关系如下表:
]与反应时间(t)的关系如下表:
①0~20min内,
_______  。
。
②上述反应中, ,
,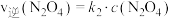 ,其中
,其中 、
、 为速率常数,则373K时
为速率常数,则373K时 、
、 的数学关系式为
的数学关系式为_______ 。
(3) 催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:
催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:
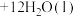 △H,向容积为2L的恒容密闭容器中,充入
△H,向容积为2L的恒容密闭容器中,充入 和
和 的混合气体0.14mol充分反应。不同投料比[投料比
的混合气体0.14mol充分反应。不同投料比[投料比 ]时,
]时, 的平衡转化率与温度的关系如下图中曲线所示:
的平衡转化率与温度的关系如下图中曲线所示:

①x_______ 3:4(填“>”“<”或“=”,下同),投料比为3:4时,Q点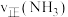
_______ P点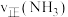 。
。
②利用反应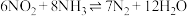 构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。写出电极A的电极反应:
构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。写出电极A的电极反应:_______ 。

(1)在其他条件相同时,分别测得反应
 中NO的平衡转化率在不同压强(
中NO的平衡转化率在不同压强( 、
、 )下温度变化的曲线如图:
)下温度变化的曲线如图:
①则

 (填“>”“<”或“=”,下同),400℃和500℃时的平衡常数分别为
(填“>”“<”或“=”,下同),400℃和500℃时的平衡常数分别为 和
和 ,则
,则
 。
。②已知
 的反应历程分两步:
的反应历程分两步:Ⅰ:


Ⅱ:
 (慢)
(慢) 
反应
 的△H=
的△H= 和
和 的式子表示)。反应Ⅰ的活化能
的式子表示)。反应Ⅰ的活化能 ,与反应Ⅱ的活化能
,与反应Ⅱ的活化能 的大小关系为
的大小关系为
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)在373K时,向体积为2L的恒容真空容器中通入0.40mol
 ,发生反应:
,发生反应:
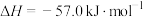 的体积分数[
的体积分数[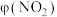 ]与反应时间(t)的关系如下表:
]与反应时间(t)的关系如下表:| t/min | 0 | 20 | 40 | 60 | 80 |
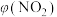 | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |

 。
。②上述反应中,
 ,
,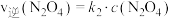 ,其中
,其中 、
、 为速率常数,则373K时
为速率常数,则373K时 、
、 的数学关系式为
的数学关系式为(3)
 催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:
催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:
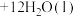 △H,向容积为2L的恒容密闭容器中,充入
△H,向容积为2L的恒容密闭容器中,充入 和
和 的混合气体0.14mol充分反应。不同投料比[投料比
的混合气体0.14mol充分反应。不同投料比[投料比 ]时,
]时, 的平衡转化率与温度的关系如下图中曲线所示:
的平衡转化率与温度的关系如下图中曲线所示:
①x
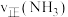
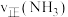 。
。②利用反应
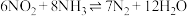 构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。写出电极A的电极反应:
构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。写出电极A的电极反应:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下表是元素周期表的一部分,据表回答下列有关问题(除特殊要求外用化学用语作答):
(1)画出元素⑥的离子结构示意图___________ 。元素②在周期表中的位置是___________ 。
(2)以上元素中,最高价氧化物对应的水化物中酸性最强的是___________ 。
(3)在③、④、⑧三种元素各自形成的氢化物中,最不稳定的氢化物是___________ 。在元素③与元素⑧形成的氢化物中,沸点高的是___________ ,请用文字简述原因_____________ 。
(4)请用电子式表示元素⑥与元素⑨形成化合物的过程___________ 。
(5)除元素⑩外原子半径最小的是______________ ,第三周期元素的单核离子中半径最小的是___________ 。
(6)元素②与元素⑤形成的化合物与水反应生成两种碱,写出该化合物与水反应的化学方程式___________________ 。
| 周期 族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||
| 四 | ⑪ | ⑫ |
(2)以上元素中,最高价氧化物对应的水化物中酸性最强的是
(3)在③、④、⑧三种元素各自形成的氢化物中,最不稳定的氢化物是
(4)请用电子式表示元素⑥与元素⑨形成化合物的过程
(5)除元素⑩外原子半径最小的是
(6)元素②与元素⑤形成的化合物与水反应生成两种碱,写出该化合物与水反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)⑨的原子结构示意图为____ .
(2)②、③的最高价含氧酸的酸性由强到弱的顺序是____ .(填化学式)
(3)⑤、⑥元素的金属性强弱依次____ .(填“增大”、“减小”或“不变”)
(4)④、⑤、⑥形成的简单离子半径依次____ .(填“增大”、“减小”或“不变”)
(5)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式____ .
(6)⑤、⑥、⑨的最高价氧化物对应水化物两两均能反应,写出其反应的离子方程式.______ 、_____ 、_____ .

(1)⑨的原子结构示意图为
(2)②、③的最高价含氧酸的酸性由强到弱的顺序是
(3)⑤、⑥元素的金属性强弱依次
(4)④、⑤、⑥形成的简单离子半径依次
(5)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式
(6)⑤、⑥、⑨的最高价氧化物对应水化物两两均能反应,写出其反应的离子方程式.
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了a~e5种元素在周期表中的位置。
(1)a的元素符号是______ 。
(2)金属性b强于c,用原子结构解释原因:______ ,失电子能力b大于c。
(3)d、e的最高价氧化物对应的水化物中,酸性较强的的是______ 。
(4)已知硒(Se)与d同主族,且位于d下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是______ 。
①其单质在常温下呈固态
②SeO2既有氧化性又有还原性
③最高价氧化物对应的水化物的化学式为H2SeO3
④非金属性比e元素的强
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | a | |||||||
| 3 | b | c | d | e |
(2)金属性b强于c,用原子结构解释原因:
(3)d、e的最高价氧化物对应的水化物中,酸性较强的的是
(4)已知硒(Se)与d同主族,且位于d下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是
①其单质在常温下呈固态
②SeO2既有氧化性又有还原性
③最高价氧化物对应的水化物的化学式为H2SeO3
④非金属性比e元素的强
您最近一年使用:0次



