利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
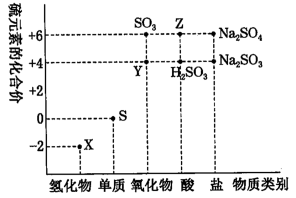
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(3) Z的浓溶液与铜单质在一定条件 下可以发生化学反应,该反应的化学方程式为___________ 。
(4) Na2S2O3是重要的化工原料。从氧化还原反应的角度分析, 下列制备Na2S2O3的方案理论上可行的
是___________ (填字母)。
a.Na2S+S b. Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+ Na2SO4
(5) 2SO2(g) +O2(g) 2SO3(g),是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。一定条件下, 在2L的密闭容器中加入4molSO2(g)、6molO2(g)和 2molSO3(g),在2min末达到平衡,测得n(SO3)=4mol。
2SO3(g),是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。一定条件下, 在2L的密闭容器中加入4molSO2(g)、6molO2(g)和 2molSO3(g),在2min末达到平衡,测得n(SO3)=4mol。
①0~2min时间段的化学反应速率为v(SO2)=___________ 。
②2min末c(O2)=___________ mol/L。
③关于2SO2(g) +O2(g) 2SO3(g)反应,下列说法正确的是
2SO3(g)反应,下列说法正确的是 ___________ 。
A.增大氧气的浓度可提高反应速率
B.升高温度可提高反应速率
C.使用催化剂能显著增大反应速率
D.通入过量的氧气可以实现SO2的完全转化

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3) Z的浓溶液与铜单质在一定条件 下可以发生化学反应,该反应的化学方程式为
(4) Na2S2O3是重要的化工原料。从氧化还原反应的角度分析, 下列制备Na2S2O3的方案理论上可行的
是
a.Na2S+S b. Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+ Na2SO4
(5) 2SO2(g) +O2(g)
 2SO3(g),是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。一定条件下, 在2L的密闭容器中加入4molSO2(g)、6molO2(g)和 2molSO3(g),在2min末达到平衡,测得n(SO3)=4mol。
2SO3(g),是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。一定条件下, 在2L的密闭容器中加入4molSO2(g)、6molO2(g)和 2molSO3(g),在2min末达到平衡,测得n(SO3)=4mol。①0~2min时间段的化学反应速率为v(SO2)=
②2min末c(O2)=
③关于2SO2(g) +O2(g)
 2SO3(g)反应,下列说法正确的是
2SO3(g)反应,下列说法正确的是 A.增大氧气的浓度可提高反应速率
B.升高温度可提高反应速率
C.使用催化剂能显著增大反应速率
D.通入过量的氧气可以实现SO2的完全转化
20-21高一下·浙江·阶段练习 查看更多[2]
更新时间:2021-04-21 19:30:17
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】油画的白色燃料中曾含二价铅盐,二价铅盐经过长时间空气(含有微量 )的侵蚀,生成
)的侵蚀,生成 而变黑。可用一定量的
而变黑。可用一定量的 溶液擦洗修复,完成下列填空:
溶液擦洗修复,完成下列填空:
(1) 与
与 反应生成
反应生成 的和
的和 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。
(2)在 的悬浊液中滴加一定量的
的悬浊液中滴加一定量的 溶液,发生复分解反应,溶液变为澄清,有弱电解质生成,写出该反应的离子反应方程式
溶液,发生复分解反应,溶液变为澄清,有弱电解质生成,写出该反应的离子反应方程式_______ 。上述反应之所以发生,其本质原因是_______ 。
(3) 为二元弱酸,向
为二元弱酸,向 溶液中通入过量
溶液中通入过量 气体,离子反应方程式为
气体,离子反应方程式为_______ 。 溶液又称臭碱,其中加入
溶液又称臭碱,其中加入 溶液,生成黑色
溶液,生成黑色 沉淀,还可能生成白色沉淀,其化学式为
沉淀,还可能生成白色沉淀,其化学式为_______ ,该物质在空气中很快变为红褐色。
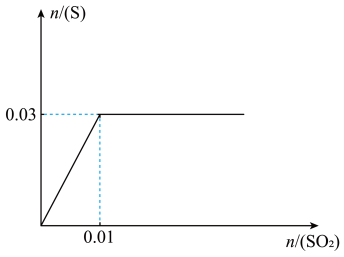
(4)向 溶液中缓慢通入
溶液中缓慢通入 ,发生反应
,发生反应 ,生成
,生成 的物质的量与通入
的物质的量与通入 的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中
的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中 的物质的量浓度为
的物质的量浓度为_______ 。从开始通 至饱和,再继续通一段时间,整个过程中
至饱和,再继续通一段时间,整个过程中 的变化情况为
的变化情况为_______ 。
 )的侵蚀,生成
)的侵蚀,生成 而变黑。可用一定量的
而变黑。可用一定量的 溶液擦洗修复,完成下列填空:
溶液擦洗修复,完成下列填空:(1)
 与
与 反应生成
反应生成 的和
的和 ,写出该反应的化学方程式
,写出该反应的化学方程式(2)在
 的悬浊液中滴加一定量的
的悬浊液中滴加一定量的 溶液,发生复分解反应,溶液变为澄清,有弱电解质生成,写出该反应的离子反应方程式
溶液,发生复分解反应,溶液变为澄清,有弱电解质生成,写出该反应的离子反应方程式(3)
 为二元弱酸,向
为二元弱酸,向 溶液中通入过量
溶液中通入过量 气体,离子反应方程式为
气体,离子反应方程式为 溶液又称臭碱,其中加入
溶液又称臭碱,其中加入 溶液,生成黑色
溶液,生成黑色 沉淀,还可能生成白色沉淀,其化学式为
沉淀,还可能生成白色沉淀,其化学式为(4)向
 溶液中缓慢通入
溶液中缓慢通入 ,发生反应
,发生反应 ,生成
,生成 的物质的量与通入
的物质的量与通入 的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中
的物质的量的关系如图(溶液体积变化忽略不计),由此可知原溶液中 的物质的量浓度为
的物质的量浓度为 至饱和,再继续通一段时间,整个过程中
至饱和,再继续通一段时间,整个过程中 的变化情况为
的变化情况为
您最近一年使用:0次
【推荐2】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)氧化剂的氧化性强弱顺序为____ ,还原剂的还原性强弱顺序为____ 。
(2)反应①中氧化剂是_____ 氧化产物是________ 。氧化产物和还原产物质量之比为____ 。
(3)反应②中氯化氢表现出的性质是____ 。
A.还原性 B.酸性
C.氧化性
(4)用单线桥法表示反应①的电子转移情况___
(5)用双线桥法表示反应②的电子转移情况___
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)氧化剂的氧化性强弱顺序为
(2)反应①中氧化剂是
(3)反应②中氯化氢表现出的性质是
A.还原性 B.酸性
C.氧化性
(4)用单线桥法表示反应①的电子转移情况
(5)用双线桥法表示反应②的电子转移情况
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。现有以下物质①液氯;②Cu;③ ;④澄清石灰水;⑤
;④澄清石灰水;⑤ 溶液;⑥干冰;⑦氢氧化钠溶液;⑧熔融氯化钠;⑨碳酸氢钠固体;⑩
溶液;⑥干冰;⑦氢氧化钠溶液;⑧熔融氯化钠;⑨碳酸氢钠固体;⑩ 胶体。
胶体。
(1)以上物质中属于电解质的是_______ (填序号),能导电的化合物是_______ (填序号)。
(2)向25mL沸水中逐滴加入5~6滴 饱和溶液,继续煮沸至溶液呈红褐色,停止加热,发生反应的化学方程式:
饱和溶液,继续煮沸至溶液呈红褐色,停止加热,发生反应的化学方程式:_______ 。
(3)曾多次出现因误食 而中毒事件,其原因是
而中毒事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有_______ 性(填“氧化”或“还原”)。
(4)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的 能治疗胃酸过多,是因为发生了离子反应:
能治疗胃酸过多,是因为发生了离子反应:_______ 。
(5)“84消毒液”是一种家用消毒剂,原因是NaClO具有强_______ 性,但不能与洁厕灵(含盐酸)混用,否则会生成有毒物质。发生的离子反应为:_______ 。
 ;④澄清石灰水;⑤
;④澄清石灰水;⑤ 溶液;⑥干冰;⑦氢氧化钠溶液;⑧熔融氯化钠;⑨碳酸氢钠固体;⑩
溶液;⑥干冰;⑦氢氧化钠溶液;⑧熔融氯化钠;⑨碳酸氢钠固体;⑩ 胶体。
胶体。(1)以上物质中属于电解质的是
(2)向25mL沸水中逐滴加入5~6滴
 饱和溶液,继续煮沸至溶液呈红褐色,停止加热,发生反应的化学方程式:
饱和溶液,继续煮沸至溶液呈红褐色,停止加热,发生反应的化学方程式:(3)曾多次出现因误食
 而中毒事件,其原因是
而中毒事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有(4)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的
 能治疗胃酸过多,是因为发生了离子反应:
能治疗胃酸过多,是因为发生了离子反应:(5)“84消毒液”是一种家用消毒剂,原因是NaClO具有强
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】如图是自然界不同价态的硫元素之间的转化关系图,利用有关知识回答下列问题:

(1)石膏的化学式为__ ;芒硝在浓硫酸中失水的过程是___ (填“化学”或“物理”)变化。
(2)由图示及有关知识可以推知,FeS2中Fe的化合价为___ ;雄黄和雌黄中S的含量较高的是:____ (填名称)。
(3)框中物质中属于电解质的是__ ,属于非电解质的是__ 。
(4)利用凝聚法,将SO2气体通入稀H2S溶液中能够得到S胶体,该反应的化学方程式为__ ;验证得到胶体的常用方法为___ 。

(1)石膏的化学式为
(2)由图示及有关知识可以推知,FeS2中Fe的化合价为
(3)框中物质中属于电解质的是
(4)利用凝聚法,将SO2气体通入稀H2S溶液中能够得到S胶体,该反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】实验设计
设计实验实现不同价态硫转化,遵循的原则是科学性、可行性、安全性和绿色化。
(1)实验设计方案
(2)不同价态含硫物质的价类二维图

写出下列转化的化学方程式:
①H2S→S:____ 。
②SO2→S:____ 。
③SO2→H2SO4:____ 。
④H2SO4→SO2:____ 。
设计实验实现不同价态硫转化,遵循的原则是科学性、可行性、安全性和绿色化。
(1)实验设计方案
| 预期转化 | 选择试剂 | 实验操作和现象 | 实验结论 |
H2 → → | 二氧化硫、硫化氢、蒸馏水 | 将H2S和SO2通入水中,生成 | SO2与H2S反应生成 |
 O2→ O2→ | |||
 O2→H2 O2→H2 O4 O4 | 二氧化硫、新制氯水、BaCl2溶液 | 将SO2通入新制氯水中,溶液 | 二氧化硫在水中能被强氧化剂氧化为 |
H2 O4→ O4→ O2 O2 | 浓硫酸、铜片 | 加热铜片和浓硫酸的混合物,有 | 浓硫酸被金属铜还原为 |

写出下列转化的化学方程式:
①H2S→S:
②SO2→S:
③SO2→H2SO4:
④H2SO4→SO2:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】硫及其主要的化合物在化学研究及生产生活中都有重要的应用。
I.探究一:认识硫化钠
工业污水中含有的重金属离子(例如Cu2+、Pb2+)可以形成硫化物沉淀而除去,这种方法叫硫化钠沉淀法。(提示:CuS是一种不溶于酸也不溶于水的黑色固体)
(1)利用Na2S处理污水中的铜离子,该反应过程的离子方程式为_______
(2)从硫元素化合价的角度,Na2S具有什么性质_______ 。小荟同学预测硫化钠溶液可以与氯气发生氧化还原反应。他将不同浓度的硫化钠溶液分别注入两支盛有氯气的采集管中,振荡混合反应,发现其中一支试管中产生淡黄色沉淀物。据此写出发生反应的化学方程式_______ 得出的结论是Cl-的还原性_______ S2-(填“强于”或“弱于”)。另一支试管中无明显现象,小荟推测生成物可能为亚硫酸钠或硫酸钠。
(3)在Na2SO4和Na2SO3可能存在的体系中,如何检验 ?请用文字将检验过程描述完整,取少量反应后的混合溶液,
?请用文字将检验过程描述完整,取少量反应后的混合溶液,_______
II.探究二:认识亚硫酸钠
化学课上并未系统学习过亚硫酸钠,所以小荟针对亚硫酸钠的性质展开了归纳和探究。
(4)从元素化合价角度思考,Na2SO3应具有氧化性和还原性。据此预测亚硫酸钠与酸性高锰酸钾溶液反应的现象为_______
(5)她还预测亚硫酸钠与硫化钠溶液混合,应产生淡黄色沉淀,做实验时却观察到并无明显现象,你能推测原因或提出解决办法吗?_______
(6)取3.5g长期存放的Na2SO3粉末(可能部分氧化为Na2SO4),加入过量的100mL某浓度的盐酸中,加热使生成的气体全部逸出,测得该气体在标准状况下的体积为560mL,然后向溶液中渐渐加入0.5mol/L的Ba(OH)2溶液50mL,有沉淀生成,此时溶液呈中性。求Na2SO3的纯度_______ ;
I.探究一:认识硫化钠
工业污水中含有的重金属离子(例如Cu2+、Pb2+)可以形成硫化物沉淀而除去,这种方法叫硫化钠沉淀法。(提示:CuS是一种不溶于酸也不溶于水的黑色固体)
(1)利用Na2S处理污水中的铜离子,该反应过程的离子方程式为
(2)从硫元素化合价的角度,Na2S具有什么性质
(3)在Na2SO4和Na2SO3可能存在的体系中,如何检验
 ?请用文字将检验过程描述完整,取少量反应后的混合溶液,
?请用文字将检验过程描述完整,取少量反应后的混合溶液,II.探究二:认识亚硫酸钠
化学课上并未系统学习过亚硫酸钠,所以小荟针对亚硫酸钠的性质展开了归纳和探究。
(4)从元素化合价角度思考,Na2SO3应具有氧化性和还原性。据此预测亚硫酸钠与酸性高锰酸钾溶液反应的现象为
(5)她还预测亚硫酸钠与硫化钠溶液混合,应产生淡黄色沉淀,做实验时却观察到并无明显现象,你能推测原因或提出解决办法吗?
(6)取3.5g长期存放的Na2SO3粉末(可能部分氧化为Na2SO4),加入过量的100mL某浓度的盐酸中,加热使生成的气体全部逸出,测得该气体在标准状况下的体积为560mL,然后向溶液中渐渐加入0.5mol/L的Ba(OH)2溶液50mL,有沉淀生成,此时溶液呈中性。求Na2SO3的纯度
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】2 L密闭容器中进行反应:pZ(g)+qQ(g)  mX(g)+nY(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
mX(g)+nY(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
已知:2 min内v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
请回答下列问题:
(1)2 min内X的反应速率v(X)=__________ 。
(2)起始时n(Y)=__________ 。
(3) 3 min末是否达到平衡_______ (填是或否)。
(4)对于该反应,能增大正反应速率的措施是________ (填序号,下同)。
A.缩小容器体积 B.移走部分Q
C.通入大量He气 D.升高温度
 mX(g)+nY(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:
mX(g)+nY(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质的物质的量的变化如下表所示:| 物质 | X | Y | Z | Q |
| 起始/mol | 0.7 | 1 | ||
| 2 min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3 min末/mol | 0.8 |
请回答下列问题:
(1)2 min内X的反应速率v(X)=
(2)起始时n(Y)=
(3) 3 min末是否达到平衡
(4)对于该反应,能增大正反应速率的措施是
A.缩小容器体积 B.移走部分Q
C.通入大量He气 D.升高温度
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法: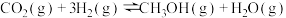 。某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图中曲线Ⅱ所示。a、b、c、d、e括号内数据表示坐标。
。某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图中曲线Ⅱ所示。a、b、c、d、e括号内数据表示坐标。

(1)a~b、b~c、c~d,d~e四段中,平均反应速率最大的是___________ ,该时间段内CO2的平均反应速率是___________ 。
(2)若在反应中加入了催化剂,则反应过程将变为图中的曲线___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(3)平衡时CO2的转化率是___________ ;反应前后容器内的压强之比是___________ 。
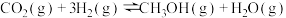 。某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图中曲线Ⅱ所示。a、b、c、d、e括号内数据表示坐标。
。某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图中曲线Ⅱ所示。a、b、c、d、e括号内数据表示坐标。
(1)a~b、b~c、c~d,d~e四段中,平均反应速率最大的是
(2)若在反应中加入了催化剂,则反应过程将变为图中的曲线
(3)平衡时CO2的转化率是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为________________ ;
(2)从开始至2min,B的平均反应速率为_______________ ;平衡时,C的浓度为_____________ ,A的转化率为________________ ;
(3)反应达平衡时体系的压强是开始时的________________ 倍;
(4)下列叙述能说明该反应已达到化学平衡状态的是(填标号)________________ ;
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗3n mol A,同时消耗n mol的B
A,同时消耗n mol的B
D.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(5)在某一时刻采取下列措施能使该反应速率减小的是______________ 。
A.加催化剂 B.降低温度
C.体积不变 ,充入A D.体积不变,从容器中分离出A
,充入A D.体积不变,从容器中分离出A

(1)该反应的化学方程式为
(2)从开始至2min,B的平均反应速率为
(3)反应达平衡时体系的压强是开始时的
(4)下列叙述能说明该反应已达到化学平衡状态的是(填标号)
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗3n mol
 A,同时消耗n mol的B
A,同时消耗n mol的BD.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(5)在某一时刻采取下列措施能使该反应速率减小的是
A.加催化剂 B.降低温度
C.体积不变
 ,充入A D.体积不变,从容器中分离出A
,充入A D.体积不变,从容器中分离出A
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】在固定容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:

(1)反应的ΔH________ (填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为______________________________ 。
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10 s又达到平衡。
①T________ (填“大于”或“小于”)100 ℃,判断理由是_____________________ ;
②100 ℃时达到平衡后,向容器中再充入0.20 mol NO2气体,新平衡建立后,NO2的体积分数________ (填“增大”“不变”或“减小”)。
(3)温度T时反应达平衡后,将反应容器的容积减小一半,平衡向________ (填“正反应”或“逆反应”)方向移动,判断理由是_____________________________________________ 。
 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10 s又达到平衡。
①T
②100 ℃时达到平衡后,向容器中再充入0.20 mol NO2气体,新平衡建立后,NO2的体积分数
(3)温度T时反应达平衡后,将反应容器的容积减小一半,平衡向
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】向体积为10 L的恒容密闭容器中通入3 mol X,在一定温度下发生如下反应:2X(g)  Y(g)+aZ(g),经5 min后反应达到反应限度(即达到平衡状态)。
Y(g)+aZ(g),经5 min后反应达到反应限度(即达到平衡状态)。
(1)平衡时,测得容器内的压强为起始时的1.2倍,此时X的物质的量浓度为0.24mol·L-1,则方程式中a=_____ ;用Y表示的反应速率为_____ mol·L-1·min-1。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得容器内的反应速率如下表所示:
若四个容器中仅反应温度不同,则反应温度最低的是_____ (填序号,下同);若四个容器中仅有一个加入了催化剂,则该容器是______ 。
 Y(g)+aZ(g),经5 min后反应达到反应限度(即达到平衡状态)。
Y(g)+aZ(g),经5 min后反应达到反应限度(即达到平衡状态)。(1)平衡时,测得容器内的压强为起始时的1.2倍,此时X的物质的量浓度为0.24mol·L-1,则方程式中a=
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得容器内的反应速率如下表所示:
| 容器 | 反应速率 |
| ① | v(X)=3.5mol·L-1·min-1 |
| ② | v(Y)=2mol·L-1·min-1 |
| ③ | v(Z)=4.5mol·L-1·min-1 |
| ④ | v(X)=0.075mol·L-1·s-1 |
若四个容器中仅反应温度不同,则反应温度最低的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】在2L密闭容器中,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如表:
(1)如图表示各物质浓度的变化曲线,A点处,v(正)____ v(逆),A点正反应速率____ B点正反应速率。(用“大于”“小于”或“等于”填空)。

(2)图中表示O2变化的曲线是____ 。用NO2表示从0~2s内该反应的平均速率v=____ 。
(3)能说明该反应已经达到平衡状态的是____ 。
a.容器内颜色保持不变 b.v(NO)=2v(O2)
c.容器内的密度保持不变 d.NO的质量百分数不变
(4)能使该反应的反应速率增大的是____ 。
a.适当升高温度 b.选择高效的催化剂
c.减小O2的浓度 d.及时分离出NO2气体
(5)平衡后,若改变下列条件,生成NO2的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度____ ;②增大O2的浓度____ ;③恒容下充入氖气____ 。
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线,A点处,v(正)

(2)图中表示O2变化的曲线是
(3)能说明该反应已经达到平衡状态的是
a.容器内颜色保持不变 b.v(NO)=2v(O2)
c.容器内的密度保持不变 d.NO的质量百分数不变
(4)能使该反应的反应速率增大的是
a.适当升高温度 b.选择高效的催化剂
c.减小O2的浓度 d.及时分离出NO2气体
(5)平衡后,若改变下列条件,生成NO2的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度
您最近一年使用:0次



