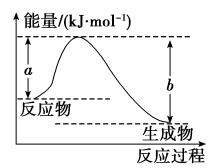
(1)如图表示某反应的能量变化关系,则此反应ΔH=___________ (用含有a、b的关系式表示)。
(2) NaBH4(s)与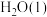 反应生成
反应生成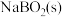 和
和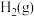 。在25℃,101kPa下,已知每消耗
。在25℃,101kPa下,已知每消耗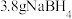
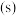 放热
放热 ,该反应的热化学方程式是
,该反应的热化学方程式是___________ 。
(3)微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是 和Zn,电解质溶液为KOH溶液,总反应式为
和Zn,电解质溶液为KOH溶液,总反应式为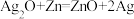 。回答下列问题:
。回答下列问题:
①Zn极发生___________ 反应,该电池的正极反应式为___________ 。
②当电池外电路中有1mol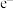 通过时,负极消耗的物质的质量是
通过时,负极消耗的物质的质量是___________ g。
③在使用过程中,电解质溶液中KOH的物质的量___________ (填“增大”“减小”或“不变”)。

(2) NaBH4(s)与
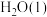 反应生成
反应生成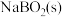 和
和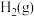 。在25℃,101kPa下,已知每消耗
。在25℃,101kPa下,已知每消耗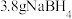
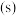 放热
放热 ,该反应的热化学方程式是
,该反应的热化学方程式是(3)微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是
 和Zn,电解质溶液为KOH溶液,总反应式为
和Zn,电解质溶液为KOH溶液,总反应式为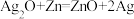 。回答下列问题:
。回答下列问题:①Zn极发生
②当电池外电路中有1mol
 通过时,负极消耗的物质的质量是
通过时,负极消耗的物质的质量是③在使用过程中,电解质溶液中KOH的物质的量
更新时间:2021-04-21 22:00:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】研究CO2的回收利用既可变废为宝,又可减少碳的排放。回答下列问题;
二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H1=-49.8 kJ•mol-1
CH3OH(g)+H2O(g) ∆H1=-49.8 kJ•mol-1
反应II:CH3OCH3(g)+H2O(g) 2CH3OH(g) ∆H2= +23.4 kJ•mol-1
2CH3OH(g) ∆H2= +23.4 kJ•mol-1
反应III:2CO2(g)+ 6H2(g) CH3OCH3(g)+3H2O(g) ∆H3
CH3OCH3(g)+3H2O(g) ∆H3
(1)△H3=___________ kJ•mol-1,据此判断该反应在___________ (填“低温”、高温或“任意温度”)条件下能自发进行。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2发生反应I能说明反应I达到平衡状态的是___________ (填字母序号)。
a.容器内混合气体的密度保持不变 b.消耗3molH2的同时生成1 mol H2O
c.反应体系总压强保持不变 d. CH3OH和CO2的物质的量之比保持不变
(3) T1K时,将1 mol二甲醚充入某恒容容器中,发生如下分解反应:
CH3OCH3(g) CH4(g)+ H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+ H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
由表中数据计算:反应达平衡时,二甲醚的分解率为___________ ,该温度下的平衡常数Kp=___________ (kPa)2. (Kp为用气体平衡分压代替气体平衡浓度表示的平衡常数,分压=总压×气体的物质的量分数)
(4)恒压下将CO2和氢气按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。

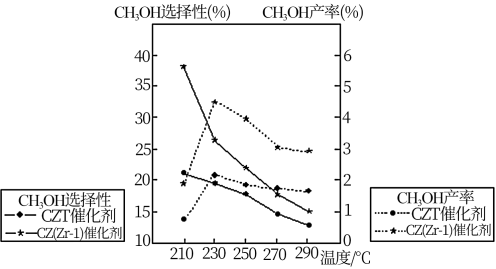
①温度高于230°C,CH3OH产率随温度升高而下降的原因是___________ 。
②在上述条件下合成甲醇的工业条件是___________ 。
a.230℃催化剂CZT b.210℃催化剂CZT
c.230℃催化剂 CZ(Zr-1)T d. 210℃催化剂CZ(Zr-1)T
二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,由CO2和H2制备二甲醚的反应原理如下:
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H1=-49.8 kJ•mol-1
CH3OH(g)+H2O(g) ∆H1=-49.8 kJ•mol-1反应II:CH3OCH3(g)+H2O(g)
 2CH3OH(g) ∆H2= +23.4 kJ•mol-1
2CH3OH(g) ∆H2= +23.4 kJ•mol-1反应III:2CO2(g)+ 6H2(g)
 CH3OCH3(g)+3H2O(g) ∆H3
CH3OCH3(g)+3H2O(g) ∆H3(1)△H3=
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2发生反应I能说明反应I达到平衡状态的是
a.容器内混合气体的密度保持不变 b.消耗3molH2的同时生成1 mol H2O
c.反应体系总压强保持不变 d. CH3OH和CO2的物质的量之比保持不变
(3) T1K时,将1 mol二甲醚充入某恒容容器中,发生如下分解反应:
CH3OCH3(g)
 CH4(g)+ H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+ H2(g)+CO(g),在不同时间测定容器内的总压,所得数据见下表:| 反应时间t/min | 0 | 5 | 10 | 15 | 20 | ∞ |
| 气体总压p总/kPa | 10.0 | 13.6 | 15.8 | 17.7 | 18.9 | 20.0 |
(4)恒压下将CO2和氢气按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如下图。


①温度高于230°C,CH3OH产率随温度升高而下降的原因是
②在上述条件下合成甲醇的工业条件是
a.230℃催化剂CZT b.210℃催化剂CZT
c.230℃催化剂 CZ(Zr-1)T d. 210℃催化剂CZ(Zr-1)T
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮及其化合物的利用是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。
(1)已知:2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=+181kJ·mol-1
若某反应的平衡常数表达式为K= ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:_______ 。
(2)汽车尾气中的NO和CO在一定条件下可发生反应生成无毒的N2和CO2。将NO和CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测得的脱氮率(脱氮率即NO的转化率)如图所示。M点_______ (填“是”或“不是”)对应温度下的平衡脱氮率,理由是_______ 。

(3)通过NOx传感器可监测NOx的含量,其工作原理如图。

①Pt电极上发生的是_______ 反应(填“氧化”或“还原”)。
②写出NiO电极上的电极反应式:_______ 。
(4)某温度下,在一密闭容器中充入一定量NO(g)发生反应4NO(g)⇌N2(g)+2NO2(g) ΔH<0,其正反应速率表达式为v正=k正·cn(NO)(k正为速率常数,只与温度有关),测得反应速率和NO浓度的数据如表所示。
则k正=_______ mol-3·L3·s-1;下列对于该反应的说法正确的是_______ (填标号)。
A.当混合气体颜色保持不变时,反应达到化学平衡状态
B.当 的比值保持不变时,反应达到化学平衡状态
的比值保持不变时,反应达到化学平衡状态
C.反应达到化学平衡状态时,每消耗0.1molNO就会消耗0.05molNO2
D.反应达到平衡状态后,若降低温度,则混合气体的颜色变浅
E.反应达到平衡状态后,若减小压强,则混合气体的平均相对分子质量减小
(1)已知:2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=+181kJ·mol-1
若某反应的平衡常数表达式为K=
 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:(2)汽车尾气中的NO和CO在一定条件下可发生反应生成无毒的N2和CO2。将NO和CO以一定的流速通过两种不同的催化剂(cat1、cat2)进行反应,相同时间内测得的脱氮率(脱氮率即NO的转化率)如图所示。M点

(3)通过NOx传感器可监测NOx的含量,其工作原理如图。

①Pt电极上发生的是
②写出NiO电极上的电极反应式:
(4)某温度下,在一密闭容器中充入一定量NO(g)发生反应4NO(g)⇌N2(g)+2NO2(g) ΔH<0,其正反应速率表达式为v正=k正·cn(NO)(k正为速率常数,只与温度有关),测得反应速率和NO浓度的数据如表所示。
| 序号 | c(NO)/(mol·L-1) | v正/(mol·L-1·s-1) |
| ① | 0.10 | 4.00×10-9 |
| ② | 0.20 | 6.40×10-8 |
| ③ | 0.30 | 3.24×10-7 |
A.当混合气体颜色保持不变时,反应达到化学平衡状态
B.当
 的比值保持不变时,反应达到化学平衡状态
的比值保持不变时,反应达到化学平衡状态C.反应达到化学平衡状态时,每消耗0.1molNO就会消耗0.05molNO2
D.反应达到平衡状态后,若降低温度,则混合气体的颜色变浅
E.反应达到平衡状态后,若减小压强,则混合气体的平均相对分子质量减小
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】Mn3O4可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。以软锰矿(主要含MnO2,还含有Fe2O3、SiO2、Al2O3、CaO和MgO等)为原料经过下列过程可以制得Mn3O4。
(1)酸浸、还原:向软锰矿中加入硫酸、同时加入铁屑,充分反应后,过滤,所得溶液中主要含有Mn2+、Fe3+、Al3+、Mg2+、H+和SO 。写出酸浸、还原过程中MnO2发生反应的离子方程式:
。写出酸浸、还原过程中MnO2发生反应的离子方程式:_______ 。
(2)调pH:向酸浸、还原所得滤液中加入MnCO3固体,调节溶液的pH,过滤。若要使Fe3+和Al3+沉淀完全,则需调节溶液的pH最小值为_______ 。(已知溶液中金属离子的物质的量浓度≤10-5 mol·L-1时可以看成沉淀完全,Ksp[Fe(OH)3]=1×10-37.4,Ksp[Al(OH)3]=1×10-33)

(3)沉锰:向调pH后所得滤液中加入一定量的氨水,可以得到Mn(OH)2沉淀。其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。50 ℃后,溶液温度越高,锰离子的沉淀率越低的原因是_______ 。
(4)氧化:向沉锰所得Mn(OH)2中加入H2O2溶液,可以得到Mn3O4.写出该反应的化学方程式:_______ 。
(1)酸浸、还原:向软锰矿中加入硫酸、同时加入铁屑,充分反应后,过滤,所得溶液中主要含有Mn2+、Fe3+、Al3+、Mg2+、H+和SO
 。写出酸浸、还原过程中MnO2发生反应的离子方程式:
。写出酸浸、还原过程中MnO2发生反应的离子方程式:(2)调pH:向酸浸、还原所得滤液中加入MnCO3固体,调节溶液的pH,过滤。若要使Fe3+和Al3+沉淀完全,则需调节溶液的pH最小值为

(3)沉锰:向调pH后所得滤液中加入一定量的氨水,可以得到Mn(OH)2沉淀。其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。50 ℃后,溶液温度越高,锰离子的沉淀率越低的原因是
(4)氧化:向沉锰所得Mn(OH)2中加入H2O2溶液,可以得到Mn3O4.写出该反应的化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】
(1)顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如右转化:

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
已知:t1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应达平衡时,c(反-1,2-二甲基环丙烷):c(顺-1,2-二甲基环丙烷)=_____________ ;
该反应的活化能Ea(正)小于Ea(逆),则
________ 0(填“小于”“等于”或“大于”)。
(2)催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g)⇌ CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g) ⇌ CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比;
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):反应II的ΔH2=__________ kJ·mol-1。
在右图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的曲线):__________

(1)顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如右转化:

该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题:
已知:t1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应达平衡时,c(反-1,2-二甲基环丙烷):c(顺-1,2-二甲基环丙烷)=
该反应的活化能Ea(正)小于Ea(逆),则

(2)催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3 H2(g)⇌ CH3OH(g)+H2O(g)ΔH1=-53.7kJ·mol-1 I
CO2(g)+ H2(g) ⇌ CO(g)+H2O(g)ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比;
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g) ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):反应II的ΔH2=
在右图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图(在图中标注出相应的曲线):

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】化学反应伴随能量变化,获取化学反应中的能量有多条途径。
(1)下列反应中,属于放热反应且是氧化还原反应的是___________(填字母)。
(2)如图为反应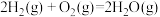 的能量变化示意图。
的能量变化示意图。
①由 和
和 变成
变成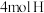 、
、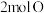 需要
需要___________ (“放出”或“吸收”)能量。
② 和
和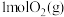 反应生成
反应生成 ,共放出
,共放出___________  能量。
能量。
(3)用 和
和 组合形成的质子交换膜燃料电池的结构如图所示。
组合形成的质子交换膜燃料电池的结构如图所示。

①电极M是___________ (填“正极”或“负极”),电极N的电极反应式为___________ 。
②若该燃料电池消耗11.2L(标准状况下)O2,则理论上电路中转移___________ mol电子。
(1)下列反应中,属于放热反应且是氧化还原反应的是___________(填字母)。
A. 与 与 反应 反应 | B. 的燃烧反应 的燃烧反应 |
C.高温煅烧 | D. 与 与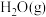 反应 反应 |
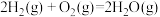 的能量变化示意图。
的能量变化示意图。
①由
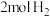 和
和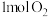 变成
变成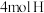 、
、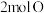 需要
需要②
 和
和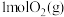 反应生成
反应生成 ,共放出
,共放出 能量。
能量。(3)用
 和
和 组合形成的质子交换膜燃料电池的结构如图所示。
组合形成的质子交换膜燃料电池的结构如图所示。
①电极M是
②若该燃料电池消耗11.2L(标准状况下)O2,则理论上电路中转移
您最近一年使用:0次
【推荐3】Ⅰ氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题。
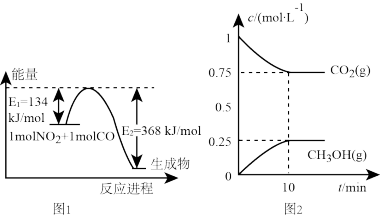
(1)图1是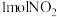 和
和 反应生成
反应生成 和NO过程中能量变化示意图
和NO过程中能量变化示意图 图中涉及物质为气态
图中涉及物质为气态 ,请写出
,请写出 和CO反应的热化学方程式
和CO反应的热化学方程式 _______ 。
(2)在一定温度下,向2L固定容积的密闭容器中通入 、
、 ,发生反应
,发生反应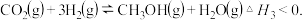 测得
测得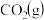 和
和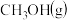 的浓度随时间变化如图2所示,
的浓度随时间变化如图2所示,
①计算该温度下此反应的平衡常数K=_______ ;若使K的值变为1,则应采取的措施是 _______ 。
A.增大压强使平衡正移 B.恒压加入一定量 C.降低温度 D.升高温度
C.降低温度 D.升高温度
②下列措施能使 增大的是
增大的是 _______ 。
A.升高温度 B.恒温恒容充入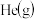
C.恒温恒容下,再充入1mol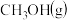 D.恒温恒容下,再充入
D.恒温恒容下,再充入 、
、
(3)在体积为3L的恒容密闭容器中,投入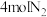 和
和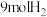 ,在一定条件下合成氨,不同温度下测得的数据如表所示。
,在一定条件下合成氨,不同温度下测得的数据如表所示。
已知: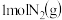 和
和 的的总能量大于
的的总能量大于 的总能量。
的总能量。
①则
_______  。
。 填“
填“ ”“
”“ ”或“
”或“ ”
”
②在T2、K下,经过5min达化学平衡状态,则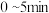 内
内 的平均速率
的平均速率
_______ 。
Ⅱ①三氧化钼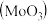 是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿
是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿 主要成分为
主要成分为 通过一定条件来制备。回答下列相关问题:
通过一定条件来制备。回答下列相关问题:
已知:①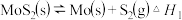
②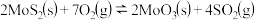
(1)若在恒温恒容条件下,发生反应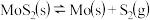 ,下列说法正确的是
,下列说法正确的是_______  填字母
填字母 。
。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加 的量,平衡正向移动
的量,平衡正向移动
(2)在恒容密闭容器中,加入足量的 和
和 ,仅发生反应:
,仅发生反应: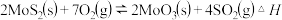 测得氧气的平衡转化率与起始压强、温度的关系如图所示。
测得氧气的平衡转化率与起始压强、温度的关系如图所示。
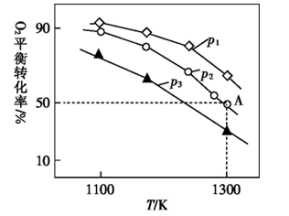
①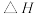
_______ (填“ ”“
”“ ”或“
”或“ ”)
”) ;比较
;比较 、
、 、
、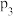 的大小:
的大小:_______ 。
②若初始时通入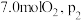 为
为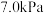 ,则A点平衡常数
,则A点平衡常数
__________ (用气体平衡分压代替气体平衡浓度计算,分压 总压
总压 气体的物质的量分数)
气体的物质的量分数)

(1)图1是
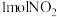 和
和 反应生成
反应生成 和NO过程中能量变化示意图
和NO过程中能量变化示意图 图中涉及物质为气态
图中涉及物质为气态 ,请写出
,请写出 和CO反应的热化学方程式
和CO反应的热化学方程式 (2)在一定温度下,向2L固定容积的密闭容器中通入
 、
、 ,发生反应
,发生反应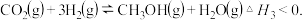 测得
测得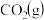 和
和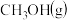 的浓度随时间变化如图2所示,
的浓度随时间变化如图2所示,①计算该温度下此反应的平衡常数K=
A.增大压强使平衡正移 B.恒压加入一定量
 C.降低温度 D.升高温度
C.降低温度 D.升高温度 ②下列措施能使
 增大的是
增大的是 A.升高温度 B.恒温恒容充入
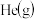
C.恒温恒容下,再充入1mol
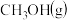 D.恒温恒容下,再充入
D.恒温恒容下,再充入 、
、
(3)在体积为3L的恒容密闭容器中,投入
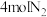 和
和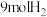 ,在一定条件下合成氨,不同温度下测得的数据如表所示。
,在一定条件下合成氨,不同温度下测得的数据如表所示。 温度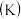 | 平衡时 |
 |  的产率30% 的产率30% |
 |  的物质的量2mol 的物质的量2mol |
已知:
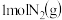 和
和 的的总能量大于
的的总能量大于 的总能量。
的总能量。 ①则

 。
。 填“
填“ ”“
”“ ”或“
”或“ ”
”
②在T2、K下,经过5min达化学平衡状态,则
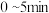 内
内 的平均速率
的平均速率
Ⅱ①三氧化钼
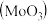 是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿
是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿 主要成分为
主要成分为 通过一定条件来制备。回答下列相关问题:
通过一定条件来制备。回答下列相关问题:已知:①
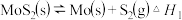
②
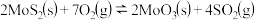
(1)若在恒温恒容条件下,发生反应
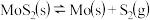 ,下列说法正确的是
,下列说法正确的是 填字母
填字母 。
。a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加
 的量,平衡正向移动
的量,平衡正向移动(2)在恒容密闭容器中,加入足量的
 和
和 ,仅发生反应:
,仅发生反应: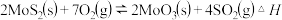 测得氧气的平衡转化率与起始压强、温度的关系如图所示。
测得氧气的平衡转化率与起始压强、温度的关系如图所示。
①
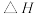
 ”“
”“ ”或“
”或“ ”)
”) ;比较
;比较 、
、 、
、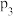 的大小:
的大小:②若初始时通入
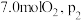 为
为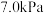 ,则A点平衡常数
,则A点平衡常数
 总压
总压 气体的物质的量分数)
气体的物质的量分数)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
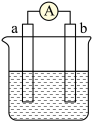
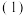 当电极a为Zn,电极b为Cu,且两极板质量相等。电解质溶液为CuSO4溶液时,正极的电极反应式为
当电极a为Zn,电极b为Cu,且两极板质量相等。电解质溶液为CuSO4溶液时,正极的电极反应式为___________ 。当电路中有1moL e-通过时,两极板的质量差为___________ g
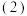 当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的负极反应式为
当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的负极反应式为___________ 。当反应中收集到标准状况下336mL气体时,消耗的电极的物质的量为___________ moL。
 燃料电池的工作原理是将燃料和氧化剂
燃料电池的工作原理是将燃料和氧化剂 如
如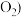 反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,CO为燃料,采用氢氧化钠溶液为电解液,则CO应通入
反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,CO为燃料,采用氢氧化钠溶液为电解液,则CO应通入___________ 极 填“a”或“b”
填“a”或“b” ,该电极反应式为
,该电极反应式为___________ ,电解质溶液中 向
向___________ 极移动(填“a”或“b”)。
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Fe + 2Fe3+=3Fe2+”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液___________ 。


 当电极a为Zn,电极b为Cu,且两极板质量相等。电解质溶液为CuSO4溶液时,正极的电极反应式为
当电极a为Zn,电极b为Cu,且两极板质量相等。电解质溶液为CuSO4溶液时,正极的电极反应式为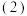 当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的负极反应式为
当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的负极反应式为 燃料电池的工作原理是将燃料和氧化剂
燃料电池的工作原理是将燃料和氧化剂 如
如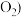 反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,CO为燃料,采用氢氧化钠溶液为电解液,则CO应通入
反应所产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,CO为燃料,采用氢氧化钠溶液为电解液,则CO应通入 填“a”或“b”
填“a”或“b” ,该电极反应式为
,该电极反应式为 向
向(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Fe + 2Fe3+=3Fe2+”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】氢氧燃料电池是符合绿色化学理念的新型电池。电池装置如图所示,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。
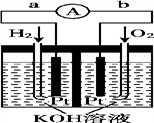
请回答下列问题:
(1)在导线中电子流动方向为______________ (用a、b表示)。
(2)负极反应式为__________________ 。
(3)电极表面镀铂粉的原因是__________________________________ 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断地提供电能。因此大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2=2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是__________ ,反应Ⅱ中的氧化剂是__________ 。
②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积之比为________ 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为__________ mol。

请回答下列问题:
(1)在导线中电子流动方向为
(2)负极反应式为
(3)电极表面镀铂粉的原因是
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断地提供电能。因此大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2=2LiH
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是
②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积之比为
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某化学兴趣小组为了探索Zn电极在原电池中的作用,设计并进行了以下一系列实验。
已知:Zn与Al的化学性质基本相似,Zn+2NaOH=Na2ZnO2+H2↑。回答下列问题:
(1)实验1:电极材料为Mg和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Zn。
①正极的电极反应式为______ 。
②每转移0.2mol电子,此时负极材料减少的质量为_____ g。
(2)实验2:电极材料为Cu和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Cu。
由实验1和实验2可知,电流表指针偏向原电池的_____ (填“正极”、或“负极”),Mg、Zn、Cu三种金属活动性由强到弱的顺序为______ 。
(3)实验3:电极材料为石墨和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的pH将_____ (填“变大”、“变小”或“不变”)。
②石墨电极上发生_____ (填“氧化”或“还原”)反应。
(4)实验4:电极材料为Mg和Zn,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向Mg。
①负极的电极反应式为______ 。
②外电路中电子的流动方向为______ 。
(5)根据实验1、实验2、实验3和实验4,可总结出影响Zn电极在原电池中得到或失去电子的因素是:______ 。
已知:Zn与Al的化学性质基本相似,Zn+2NaOH=Na2ZnO2+H2↑。回答下列问题:
(1)实验1:电极材料为Mg和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Zn。
①正极的电极反应式为
②每转移0.2mol电子,此时负极材料减少的质量为
(2)实验2:电极材料为Cu和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向Cu。
由实验1和实验2可知,电流表指针偏向原电池的
(3)实验3:电极材料为石墨和Zn,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的pH将
②石墨电极上发生
(4)实验4:电极材料为Mg和Zn,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向Mg。
①负极的电极反应式为
②外电路中电子的流动方向为
(5)根据实验1、实验2、实验3和实验4,可总结出影响Zn电极在原电池中得到或失去电子的因素是:
您最近一年使用:0次



