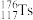应用元素周期律的有关知识,可以预测我们不熟悉的一些元素的单质及其化合物的性质。下列预测中正确的是
①Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
②第二周期非金属元素的气态氢化物溶于水后,水溶液可能为碱性
③砹(At)单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④硫酸锶(SrSO4)是难溶于水的白色固体
⑤硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
①Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
②第二周期非金属元素的气态氢化物溶于水后,水溶液可能为碱性
③砹(At)单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④硫酸锶(SrSO4)是难溶于水的白色固体
⑤硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
| A.②③④ | B.①②④ | C.①③⑤ | D.②④⑤ |
更新时间:2021-04-25 22:35:43
|
相似题推荐
【推荐1】最早提出科学的原子概念的科学家是
| A.道尔顿 | B.阿伏加德罗 |
| C.门捷列夫 | D.卢瑟福 |
您最近半年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】元素周期表中位置靠近的元素性质相近,在一定区域内寻找元素、发现物质的新用途被视为一种相当有效的方法。下列说法正确的是
| A.在周期表中金属与非金属的分界处可以找到催化剂材料 |
| B.对氟、氯、硫、磷、砷等元素的研究,有助于制造出新品种的农药 |
| C.在过渡元素中可寻找制造半导体的元素 |
| D.可在第I、IIA族元素中寻找制造耐高温、耐腐蚀合金的元素 |
您最近半年使用:0次
单选题
|
较易
(0.85)
【推荐3】应用元素周期律的有关知识,可以预测我们未知的一些元素及其化合物的性质。下列预测正确的是:
| A.硒(Se)是第ⅥA族元素,其氢化物的熔沸点:H2Se>H2S>H2O |
| B.铋(Bi)与氮同主族,其最高价氧化物的水化物为强酸 |
| C.Ts(117号元素)与氯同主族,其主要化合价有-1和+7 |
| D.锶(Sr)是第ⅡA族元素,其最高价氧化物对应的水化物一定是强碱 |
您最近半年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】下列说法不正确的是
| A.酸性:HClO4>HBrO4>HIO4 | B.微粒半径:O2-<Al3+<Mg2+<Na+ |
| C.稳定性:HF>HCl>H2S>PH3 | D.沸点:GeH4>SiH4>CH4 |
您最近半年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列叙述中正确的是
| A.最外层有2个电子的原子都是金属原子 |
| B.除短周期外,其他周期均有18个元素 |
| C.副族元素中没有非金属元素 |
| D.碱金属元素是指IA族的所有元素 |
您最近半年使用:0次
单选题
|
较易
(0.85)
【推荐3】如图是部分短周期元素的原子序数与常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是


| A.31d和33d属于同种核素 |
| B.原子半径:d>e |
| C.气态氢化物的稳定性:a>d>e |
| D.a和b形成的化合物不可能含共价键 |
您最近半年使用:0次
单选题
|
较易
(0.85)
【推荐1】按钠、钾、铷、铯的顺序,下列有关叙述正确的是
| A.其氢氧化物中碱性最强的是NaOH | B.单质还原能力最强的是铯 |
| C.单质熔点最低的是钠 | D.原子半径逐渐减少 |
您最近半年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】有关单质钾的说法如下:①在 中燃烧生成
中燃烧生成 并能产生紫色火焰;②与
并能产生紫色火焰;②与 溶液反应时能产生蓝色沉淀;③少量单质钾可保存在煤油中;④熔点、沸点均比钠的高。下列组合正确的是
溶液反应时能产生蓝色沉淀;③少量单质钾可保存在煤油中;④熔点、沸点均比钠的高。下列组合正确的是
 中燃烧生成
中燃烧生成 并能产生紫色火焰;②与
并能产生紫色火焰;②与 溶液反应时能产生蓝色沉淀;③少量单质钾可保存在煤油中;④熔点、沸点均比钠的高。下列组合正确的是
溶液反应时能产生蓝色沉淀;③少量单质钾可保存在煤油中;④熔点、沸点均比钠的高。下列组合正确的是| A.②③ | B.①④ | C.③④ | D.①③ |
您最近半年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】居里夫人发现的镭是主族元素,它的最外层电子数是2个,共有7个电子层。下列关于它的描述错误的是
| A.在化合物中呈+2价 | B.氢氧化物呈两性 |
| C.单质与水反应能放出氢气 | D.碳酸盐难溶于水 |
您最近半年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】下列有关碱金属元素、卤素结构和性质的描述正确的有
①卤素按F、Cl、Br、I的顺序,其非金属性逐渐减弱的主要原因是随着核电荷数增加,电子层数增多,原子半径增大
②F、Cl、Br、I的最外层电子数都是7,次外层电子数都是8
③碱金属单质的金属性很强,均易与氧气发生反应,加热时生成的氧化物为R2O
④根据同族元素性质的递变规律推测,At2与H2化合较难,砹化银也难溶于水
⑤根据Cl、Br、I的非金属性递减,可推出HCl、HBr、HI的酸性依次增强,而热稳定性依次减弱
⑥碱金属都应保存在煤油中
①卤素按F、Cl、Br、I的顺序,其非金属性逐渐减弱的主要原因是随着核电荷数增加,电子层数增多,原子半径增大
②F、Cl、Br、I的最外层电子数都是7,次外层电子数都是8
③碱金属单质的金属性很强,均易与氧气发生反应,加热时生成的氧化物为R2O
④根据同族元素性质的递变规律推测,At2与H2化合较难,砹化银也难溶于水
⑤根据Cl、Br、I的非金属性递减,可推出HCl、HBr、HI的酸性依次增强,而热稳定性依次减弱
⑥碱金属都应保存在煤油中
| A.1个 | B.2个 | C.3个 | D.4个 |
您最近半年使用:0次

 的中文名称为“
的中文名称为“ ”,
”,