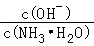在0.1mol·L-1NH3·H2O溶液中,加入少量NH4Cl晶体后,引起的变化是
| A.溶液中c(OH-)增大 | B.NH3·H2O电离度增大 |
| C.溶液的导电能力不变 | D.溶液的pH减小 |
更新时间:2021-04-21 22:48:01
|
【知识点】 同离子效应对电离的影响解读
相似题推荐
单选题
|
较易
(0.85)
【推荐1】室温下,对于1L0.1mol•L-1醋酸溶液。下列判断正确的是
| A.该溶液中CH3COO-的粒子数为6.02×1022 |
| B.加入少量CH3COONa固体后,溶液的pH降低 |
| C.滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1mol |
D.醋酸与Na2CO3溶液反应的离子方程式为CO +2H+=H2O+CO2↑ +2H+=H2O+CO2↑ |
您最近半年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】已知:亚硝酸( )是一种弱酸,亚硝酸钠(
)是一种弱酸,亚硝酸钠( )是一种常用的食品防腐剂。常温下,将0.1mol⋅L-1
)是一种常用的食品防腐剂。常温下,将0.1mol⋅L-1 溶液加水稀释或加入少量
溶液加水稀释或加入少量 晶体时,下列观点正确的是
晶体时,下列观点正确的是
 )是一种弱酸,亚硝酸钠(
)是一种弱酸,亚硝酸钠( )是一种常用的食品防腐剂。常温下,将0.1mol⋅L-1
)是一种常用的食品防腐剂。常温下,将0.1mol⋅L-1 溶液加水稀释或加入少量
溶液加水稀释或加入少量 晶体时,下列观点正确的是
晶体时,下列观点正确的是A.加水稀释时,电离平衡正向移动,溶液中 增大 增大 |
B.加 晶体时,电离平衡逆向移动,溶液导电能力增强 晶体时,电离平衡逆向移动,溶液导电能力增强 |
C.加水稀释时, 的电离程度增大,电离常数也增大 的电离程度增大,电离常数也增大 |
D.加 晶体时,溶液的pH增大,与 晶体时,溶液的pH增大,与 增大有关 增大有关 |
您最近半年使用:0次