原电池是直接把化学能转化为电能的装置。
(1)如图所示:按照构成原电池的基本要素来看,Zn的作用是(填字母,下同)____ ;稀硫酸的作用是________ 。
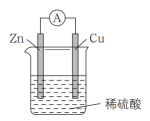
a.负极反应物 b.负极材料 c.正极反应物
d.正极材料 e.离子导体 f.电子导体
(2) ①在Cu-Zn原电池中,Zn片上发生________ 反应(填“氧化”或“还原”)。Cu片上发生的电极反应为________ 。
②外电路中电子流向_____ 极;内电路溶液中SO 移向
移向___ 极。
③能证明化学能转化为电能的实验现象为________ 。
(3)某原电池的总反应为Zn+Cu2+=Cu+Zn2+,该原电池正确的组成是__ 。

(4)从化学的角度分析,原电池装置产生电流的原因是:原电池可将________ ,并通过能导电的物质形成闭合回路,产生电流。
(1)如图所示:按照构成原电池的基本要素来看,Zn的作用是(填字母,下同)

a.负极反应物 b.负极材料 c.正极反应物
d.正极材料 e.离子导体 f.电子导体
(2) ①在Cu-Zn原电池中,Zn片上发生
②外电路中电子流向
 移向
移向③能证明化学能转化为电能的实验现象为
(3)某原电池的总反应为Zn+Cu2+=Cu+Zn2+,该原电池正确的组成是

(4)从化学的角度分析,原电池装置产生电流的原因是:原电池可将
20-21高一下·北京丰台·期中 查看更多[2]
更新时间:2021-04-29 08:45:47
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】同学们在“简易电池的设计与制作”的实验中,对影响自制电池效果的因素进行了实验探究。
【提出问题】影响自制电池效果的因素有哪些?
【查阅资源】电极材料,电极间距,水果种类对自制水果电池的效果可能有影响。
【实验探究】
Ⅰ.按如图连接水果电池。

Ⅱ.实验记录如表:
【解释与结论】
(1)实验①②③的目的是____ 。对比实验①②③得出结论是____ 。
(2)欲得出“水果种类对电池效果有影响”的结论,需要对比实验____ (填序号)。对比④⑤得出结论是____ 。
【反思与探讨】
(3)水果电池中,水果的作用是____ 。
(4)对比实验①②③可知构成水果电池的电极必须具备的条件为____ ,构成水果电池的其他要素还有___ 、___ 、____ 。
(5)水果电池是利用水果中的化学物质和金属发生化学反应而产生电能的一种装置,如将实验①中的西红柿换成硫酸铜溶液,进行实验,电流表示数不为零,Cu片和Al片上发生的电极反应式分别为____ 、____ ,总离子方程式为___ 。
【提出问题】影响自制电池效果的因素有哪些?
【查阅资源】电极材料,电极间距,水果种类对自制水果电池的效果可能有影响。
【实验探究】
Ⅰ.按如图连接水果电池。

Ⅱ.实验记录如表:
| 序号 | 电极 | 电极间距 | 水果种类 | 电流表示数(μA) |
| ① | Cu—Al | 2.0cm | 西红柿 | 78.5 |
| ② | Cu—Fe | 2.0cm | 西红柿 | 70.3 |
| ③ | Al—Al | 2.0cm | 西红柿 | 0 |
| ④ | Cu—Al | 2.0cm | 柠檬 | 45.7 |
| ⑤ | Cu—Al | 1.0cm | 柠檬 | 98.4 |
| ⑥ | 石墨棒—Al | 1.0cm | 柠檬 | 104.5 |
(1)实验①②③的目的是
(2)欲得出“水果种类对电池效果有影响”的结论,需要对比实验
【反思与探讨】
(3)水果电池中,水果的作用是
(4)对比实验①②③可知构成水果电池的电极必须具备的条件为
(5)水果电池是利用水果中的化学物质和金属发生化学反应而产生电能的一种装置,如将实验①中的西红柿换成硫酸铜溶液,进行实验,电流表示数不为零,Cu片和Al片上发生的电极反应式分别为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】(1)①25℃时,NaHCO3溶液呈碱性,原因是___________ 水解引起的(填“Na+”或“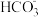 ”);
”);
②常温下,0.0100mol/L 盐酸的pH=___________ ;
③用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为___________ (填“蓝色”或“无色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1mol H2O(g)时放出241.8kJ 的热量,请完成该反应的热化学方程式:2H2(g) +O2(g)=2H2O(g) △H=___________ kJ/mol;
②已知:C(石墨,s)=C(金刚石,s) △H>0,则稳定性: 石墨___________ 金刚石 (填“>”、“<”或“=”)。
(3)在某密闭容器中进行可逆反应:FeO(s)+CO(g) Fe(s)+CO2(g) △H>0,平衡常数表达式为K=
Fe(s)+CO2(g) △H>0,平衡常数表达式为K=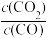 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________ 方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K___________ (填“增大”、“减少”或“不变”);
③查阅资料得知1100℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________ 平衡状态(填“达到”或“未达到”)。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
①根据氧化还原反应:2Ag+(aq)+Cu(s)=2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液时__________ 溶液(填“CuSO4”或“AgNO3”);

②图二装置在铁件上镀铜,铁作阴极,则铜极上的电极反应是___________ 。
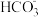 ”);
”);②常温下,0.0100mol/L 盐酸的pH=
③用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为
(2)①已知H2与O2反应生成1mol H2O(g)时放出241.8kJ 的热量,请完成该反应的热化学方程式:2H2(g) +O2(g)=2H2O(g) △H=
②已知:C(石墨,s)=C(金刚石,s) △H>0,则稳定性: 石墨
(3)在某密闭容器中进行可逆反应:FeO(s)+CO(g)
 Fe(s)+CO2(g) △H>0,平衡常数表达式为K=
Fe(s)+CO2(g) △H>0,平衡常数表达式为K=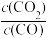 。
。①反应达到平衡后,向容器中通入CO,化学平衡向
②若升高温度,平衡常数K
③查阅资料得知1100℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
①根据氧化还原反应:2Ag+(aq)+Cu(s)=2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液时

②图二装置在铁件上镀铜,铁作阴极,则铜极上的电极反应是
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐3】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。

(1)填充物用60℃温水溶解,目的是____ 。
(2)操作A的名称为____ 。
(3)铜帽溶解时加入H2O2溶液的目___ (用化学方程式表示)。铜帽溶解完全后,可采用___ 方法除去溶液中过量的H2O2溶液。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnOOH+MnO2+2H2C2O4+3H2SO4=3MnSO4+6H2O+4CO2↑
①当1molMnO2参加反应时,共有___ mol电子发生转移。
②MnOOH与浓盐酸在加热条件下也可反应,写出反应的化学方程式:___ 。

(1)填充物用60℃温水溶解,目的是
(2)操作A的名称为
(3)铜帽溶解时加入H2O2溶液的目
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnOOH+MnO2+2H2C2O4+3H2SO4=3MnSO4+6H2O+4CO2↑
①当1molMnO2参加反应时,共有
②MnOOH与浓盐酸在加热条件下也可反应,写出反应的化学方程式:
您最近一年使用:0次
【推荐1】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g) 2CO(g)+2H2(g)ΔH。
2CO(g)+2H2(g)ΔH。
已知:C(s)+2H2(g)=CH4(g)ΔH=-75kJ·mol−1
C(s)+O2(g)=CO2(g)ΔH=-394kJ·mol−1
C(s)+ O2(g)=CO(g)ΔH=-111kJ·mol−1
O2(g)=CO(g)ΔH=-111kJ·mol−1
该催化重整反应的ΔH=________ kJ·mol−1。有利于提高CH4平衡转化率的条件是____ (填标号)。
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为___________________________ 。
素材1:研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。总反应为:2Li+2H2O===2LiOH+H2↑。根据以上素材回答下列问题:
(2)该电池的负极是________ ,负极反应式是_____________________________ 。
(3)正极现象是_______________________________________________ 。
(4)放电时OH-向_____________ (填“正极”或“负极”)移动。
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)
 2CO(g)+2H2(g)ΔH。
2CO(g)+2H2(g)ΔH。已知:C(s)+2H2(g)=CH4(g)ΔH=-75kJ·mol−1
C(s)+O2(g)=CO2(g)ΔH=-394kJ·mol−1
C(s)+
 O2(g)=CO(g)ΔH=-111kJ·mol−1
O2(g)=CO(g)ΔH=-111kJ·mol−1该催化重整反应的ΔH=
A.高温低压B.低温高压C.高温高压D.低温低压
某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为
素材1:研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。总反应为:2Li+2H2O===2LiOH+H2↑。根据以上素材回答下列问题:
(2)该电池的负极是
(3)正极现象是
(4)放电时OH-向
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐2】完成下列问题。
(1)化学反应同时伴随着能量变化,是人类获取能量的重要途径。
A.镁与盐酸的反应 B.氢氧化钠与盐酸的反应 C.水的汽化 D.浓硫酸的稀释
E. 晶体与
晶体与 晶体的反应
晶体的反应
①以上变化过程,能用图a表示其能量变化的是___________ ,此类过程中有能量变化的原因是:断开反应物中的化学键需吸收的总能量___________ (填“大于”或“小于”)形成生成物中的化学键需释放的总能量。___________ 。
③拆开1mol共价键所吸收的能量或形成1mol共价键所释放的能量称为键能。已知H-H键能为436kJ/mol,H-N键能为391kJ/mol,N≡N键能为946kJ/mol。根据键能计算工业合成氨时消耗1molN2能___________ (填“吸收”或“放出”)___________ kJ热量。
(2)如图所示,是原电池的装置图。请回答: 设计成如图所示的原电池装置,则A极(负极)材料为
设计成如图所示的原电池装置,则A极(负极)材料为___________ ,B极电极反应式为___________ 。
②若C为 溶液,两电极材料分别为Zn和Cu,则Cu电极发生
溶液,两电极材料分别为Zn和Cu,则Cu电极发生___________ 反应,(填“氧化”或者“还原”),反应过程溶液中
___________ (填“变大”“变小”或“不变”)。
(3)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。___________ 。
②在电池反应中,每消耗1mol氧气,理论上生成标准状况下二氧化碳的体积是___________ 。
(1)化学反应同时伴随着能量变化,是人类获取能量的重要途径。
A.镁与盐酸的反应 B.氢氧化钠与盐酸的反应 C.水的汽化 D.浓硫酸的稀释
E.
 晶体与
晶体与 晶体的反应
晶体的反应①以上变化过程,能用图a表示其能量变化的是

③拆开1mol共价键所吸收的能量或形成1mol共价键所释放的能量称为键能。已知H-H键能为436kJ/mol,H-N键能为391kJ/mol,N≡N键能为946kJ/mol。根据键能计算工业合成氨时消耗1molN2能
(2)如图所示,是原电池的装置图。请回答:

 设计成如图所示的原电池装置,则A极(负极)材料为
设计成如图所示的原电池装置,则A极(负极)材料为②若C为
 溶液,两电极材料分别为Zn和Cu,则Cu电极发生
溶液,两电极材料分别为Zn和Cu,则Cu电极发生
(3)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

②在电池反应中,每消耗1mol氧气,理论上生成标准状况下二氧化碳的体积是
您最近一年使用:0次
【推荐3】回答下列问题
I:
(1) 的燃烧热为
的燃烧热为 ,则表示液态甲醇燃烧热的热化学方程式为
,则表示液态甲醇燃烧热的热化学方程式为___________ 。
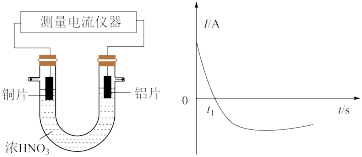
II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(2)利用反应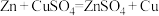 设计成原电池,该原电池的电解质溶液为
设计成原电池,该原电池的电解质溶液为___________ ,若开始时两电极质量相等,当电路中转移0.2mol电子后,两电极的质量差___________ g。
(3)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了下图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中 时刻之前,正极反应式为
时刻之前,正极反应式为___________ , 时刻之后,Cu电极是
时刻之后,Cu电极是___________ (填“正极”或“负极”)。据以上现象,最终得出结论:在原电池中,构成原电池的负极不一定是较活泼的金属材料。
III.现在容积为2L的恒温密闭容器中,充入 和
和 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。
(4)下列说法正确的是___________ 。
A.使用催化剂可以增大反应速率,提高生产效率
B.反应达到平衡后,反应不再进行
C.通过改变反应条件,能改变该反应进行的限度,使 全部转化为
全部转化为
(5)达平衡时, 的转化率为
的转化率为___________ 。
I:
(1)
 的燃烧热为
的燃烧热为 ,则表示液态甲醇燃烧热的热化学方程式为
,则表示液态甲醇燃烧热的热化学方程式为II.如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

(2)利用反应
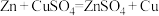 设计成原电池,该原电池的电解质溶液为
设计成原电池,该原电池的电解质溶液为(3)某同学探究原电池原理时,认为“构成原电池的负极总是较活泼的金属材料”。该同学利用打磨过的铜片和铝片设计了下图所示的原电池装置(硝酸过量),并测量和绘制了原电池的电流(I)随时间(t)的变化曲线(极短时间电流反转)。图中
 时刻之前,正极反应式为
时刻之前,正极反应式为 时刻之后,Cu电极是
时刻之后,Cu电极是III.现在容积为2L的恒温密闭容器中,充入
 和
和 ,一定条件下发生反应
,一定条件下发生反应 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。| 时间 | 0min | 3min | 6min | 9min | 12min |
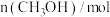 | 0 | 0.50 | 0.65 | 0.75 | 0.75 |
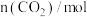 | 1 | 0.50 | 0.35 | A | 0.25 |
A.使用催化剂可以增大反应速率,提高生产效率
B.反应达到平衡后,反应不再进行
C.通过改变反应条件,能改变该反应进行的限度,使
 全部转化为
全部转化为
(5)达平衡时,
 的转化率为
的转化率为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】研究化学反应中能量变化,能更好地利用化学反应为生产和生活服务。
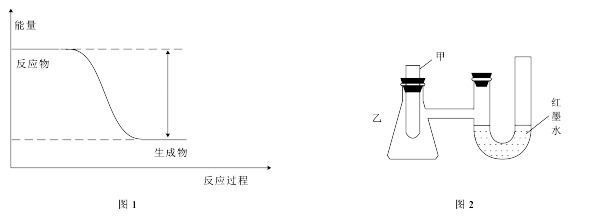
(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为__________ (填“吸热”或“放热”)反应。
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是__________ 。
③若要使该反应的反应速率加快,下列措施可行的是__________ (填字母)。
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。
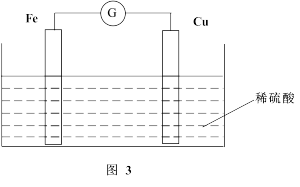
①铜为__________ (填“正”或“负”)极;负极的电极反应式为______ 。
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是__________ L。

(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化如图1所示。
①该反应为
②为了探究化学能与热能的转化,某实验小组设计了图2实验装置,在甲试管里先加入适量铁片,再加入稀硫酸,U形管中可观察到的现象是
③若要使该反应的反应速率加快,下列措施可行的是
A.铁片改为铁粉B.稀硫酸改为98%的浓硫酸C.升高温度
(2)若将上述反应设计成原电池,装置如图3所示。

①铜为
②若该电池反应过程中共转移0.3 mol电子,则生成的H2在标准状况下的体积是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】Ⅰ.下列有关实验操作中,合理的是_____ (填序号)。
E.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸装在滴定管中去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_____________________ 。
(2)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度______________ (选填“偏大”、“偏小”或“无影响”)
Ⅲ、在由锌和石墨作两极材料、硫酸钠与硫酸铜组成的混合溶液作电解质溶液所形成的原电池中,正极上发生的反应的电极反应式是:________________________ 。
| A.用托盘天平称取11.70 g食盐 |
| B.用量筒量取12.36 mL盐酸 |
| C.用酸式滴定管量取21.20 mL 0.10 mol/L H2SO4溶液 |
| D.用200 mL容量瓶配制500 mL 0.1 mol/L NaCl溶液 |
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸装在滴定管中去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是
(2)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度
Ⅲ、在由锌和石墨作两极材料、硫酸钠与硫酸铜组成的混合溶液作电解质溶液所形成的原电池中,正极上发生的反应的电极反应式是:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】现代社会的一切活动都离不开能用为了更好地利用化学反应中的物质和能量变化,需要关注化学反应的快慢和程度。
I.化学变化过程中,均在物用变化与能量变化,某化学兴趣小组进行如图所示实验。以验证此结论,请回答下列问题。
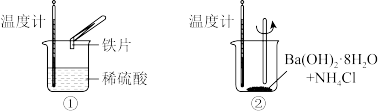
(1)进行实验时,温度计水银柱液面的变化:①升高;②降低。则反应①中,反应物断键吸收的能量_______ 生成物成键释放的能量(填“大于”或“小于”)。反应②中,反应物的总能量_______ 生成物的总能量(填“高于”或“低于”)。
(2)下列化学反应中的能量变化关系与下图相符合的是_______(填字母)。

(3)将上述反应①中涉及的化学反应可设计成如下图所示的原电池,请回答下列问题。

则溶液中 移向
移向_______ 极(填“正”或“负”);负极的电极反应式为_______ ;电极材料X不能是_______ (填字母)。
A.Zn B.Cu C.石墨 D.Ag
II.某化学兴趣小组为了研究外界因素对化学反应速率的影响,进行了如下实验: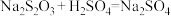
 。实验方案如下:
。实验方案如下:
(4)实验1和2的目的是探究_______ 对反应速率的影响;实验2中,V=_______ ;表格中 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ 。
III.某同学用等质量的锌粉先后与1 盐酸及相同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出气体的体积随反应时间的变化曲线图(如下图所示)。
盐酸及相同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出气体的体积随反应时间的变化曲线图(如下图所示)。

(5)根据图示可判断,该同学所用的盐酸的浓度比1
_______ (填“大”或“小”)。
(6)若用1 硫酸代替上述实验中的1
硫酸代替上述实验中的1 盐酸,请问二者的反应速率是否相同
盐酸,请问二者的反应速率是否相同_______ ;理由是_______ 。
(7)为控制反应速率,防止因反应过快而难以测量 体积,且不改变生成
体积,且不改变生成 的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是_______。
的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是_______。
I.化学变化过程中,均在物用变化与能量变化,某化学兴趣小组进行如图所示实验。以验证此结论,请回答下列问题。
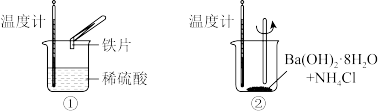
(1)进行实验时,温度计水银柱液面的变化:①升高;②降低。则反应①中,反应物断键吸收的能量
(2)下列化学反应中的能量变化关系与下图相符合的是_______(填字母)。

| A.盐酸与碳酸氢钠的反应 | B.生石灰溶于水 |
| C.灼热的炭与二氧化碳的反应 | D.甲烷在氧气中燃烧 |

则溶液中
 移向
移向A.Zn B.Cu C.石墨 D.Ag
II.某化学兴趣小组为了研究外界因素对化学反应速率的影响,进行了如下实验:
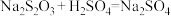
 。实验方案如下:
。实验方案如下:| 实验编号 | 温度/℃ |  |  | 加入 的体积/mL 的体积/mL | 出现浑浊的时间/s | ||
| 体积mL | 浓度mol/L | 体积mL | 浓度mol/L | ||||
| 1 | 20 | 10 | 0.1 | 10 | 0.1 | 0 |  |
| 2 | 20 | 5 | 0.1 | 10 | 0.1 | V |  |
| 3 | 60 | 10 | 0.1 | 10 | 0.1 | 0 |  |
 、
、 、
、 由大到小的顺序为
由大到小的顺序为III.某同学用等质量的锌粉先后与1
 盐酸及相同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出气体的体积随反应时间的变化曲线图(如下图所示)。
盐酸及相同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出气体的体积随反应时间的变化曲线图(如下图所示)。
(5)根据图示可判断,该同学所用的盐酸的浓度比1

(6)若用1
 硫酸代替上述实验中的1
硫酸代替上述实验中的1 盐酸,请问二者的反应速率是否相同
盐酸,请问二者的反应速率是否相同(7)为控制反应速率,防止因反应过快而难以测量
 体积,且不改变生成
体积,且不改变生成 的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是_______。
的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是_______。| A.蒸馏水 | B.KCl溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次



