(1)一定条件下,用Fe2O3、NiO或Cr2O3作催化剂对燃煤烟气进行回收。反应为2CO(g)+SO2(g) 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
2CO2(g)+S(l) ΔH=-270 kJ·mol-1
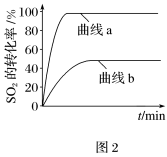
①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是___________ 。
②某科研小组用Fe2O3作催化剂。在380℃时,分别研究了[n(CO)∶n(SO2)]为1∶1、3∶1时SO2转化率的变化情况(图2)。则图2中表示n(CO)∶n(SO2)=3∶1的变化曲线为___________ 。

(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。


①写出该脱硝原理总反应的化学方程式:______________ 。
②为达到最佳脱硝效果,应采取的条件是___________ 。
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。
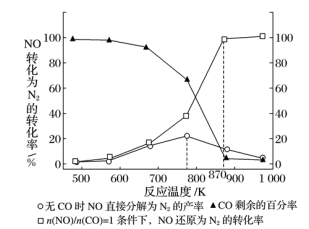
若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因是_______ ;在 的条件下,应控制的最佳温度在
的条件下,应控制的最佳温度在___________ 左右。
 2CO2(g)+S(l) ΔH=-270 kJ·mol-1
2CO2(g)+S(l) ΔH=-270 kJ·mol-1①其他条件相同、催化剂不同,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是
②某科研小组用Fe2O3作催化剂。在380℃时,分别研究了[n(CO)∶n(SO2)]为1∶1、3∶1时SO2转化率的变化情况(图2)。则图2中表示n(CO)∶n(SO2)=3∶1的变化曲线为


(2)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。


①写出该脱硝原理总反应的化学方程式:
②为达到最佳脱硝效果,应采取的条件是
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。

若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因是
 的条件下,应控制的最佳温度在
的条件下,应控制的最佳温度在
2021高三·全国·专题练习 查看更多[3]
(已下线)小题31 化学平衡新情景图像——备战2021年高考化学经典小题考前必刷(全国通用)江苏省苏州市姑苏区苏州中学2020-2021学年高二下学期3月月考化学试题(已下线)周末培优1 化学反应速率与化学平衡图像问题-2021-2022学年高二化学课后培优练(人教版选修4)
更新时间:2021-05-07 21:16:33
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)某温度下,在体积固定为2L的密闭容器中进行反应CO(g)+2H2(g)⇌CH3OH(g)  H1=-90.7kJ.mol-l,将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
H1=-90.7kJ.mol-l,将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
则达到平衡时CO的转化率为_________ 。
(2)在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g),已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如图所示。从图中可得出三条主要规律:

①增大投料比,CO2的转化率增大;②_____________ ;③_______________ 。
(4)反应CO(g)+H2O(g) ⇌CO2(g)+H2(g) H2=-41.2kJ.mol-l的v-t图像如图1所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图像如图2所示。下列说法正确的是
H2=-41.2kJ.mol-l的v-t图像如图1所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图像如图2所示。下列说法正确的是_________

①a1>a2②a1<a2③b1>b2④b1<b2⑤t1>t2⑥t1=t2⑦t1<t2⑧两图中阴影部分面积相等⑨图2阴影部分面积更大⑩图1阴影部分面积更大
A.①③⑦⑧B.①③⑤⑧C.②④⑦⑨D.①③⑦⑩
 H1=-90.7kJ.mol-l,将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
H1=-90.7kJ.mol-l,将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P前/P后) | 1:0.98 | 1:0.90 | 1:0.80 | 1:0.70 | 1:0.70 | 1:0.70 |
(2)在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g),已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如图所示。从图中可得出三条主要规律:

①增大投料比,CO2的转化率增大;②
(4)反应CO(g)+H2O(g) ⇌CO2(g)+H2(g)
 H2=-41.2kJ.mol-l的v-t图像如图1所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图像如图2所示。下列说法正确的是
H2=-41.2kJ.mol-l的v-t图像如图1所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图像如图2所示。下列说法正确的是
①a1>a2②a1<a2③b1>b2④b1<b2⑤t1>t2⑥t1=t2⑦t1<t2⑧两图中阴影部分面积相等⑨图2阴影部分面积更大⑩图1阴影部分面积更大
A.①③⑦⑧B.①③⑤⑧C.②④⑦⑨D.①③⑦⑩
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g) ⇌ CO(g)+ 3H2(g)。
(1)一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl__ P2(填“<”、“>”“=”);A、B、C三点处对应平衡常数(KA、KB、KC)由大到小的顺序为___ 。

(2)100℃时,将1 mol CH4和2 mol H2O通入容积固定为10 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则H2的反应速率v(H2)=____ 。100℃时该反应的平衡常数K =____ 。反应达到平衡的标志是:____ 。
A.容器内气体密度恒定 B.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
C.容器的压强恒定 D.3v正(CH4)= v逆(H2)
(3)为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有____ (填编号)。
A.升高温度 B.缩小容器体积
C.再充入CH4气体 D.使用合适的催化剂
(1)一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl

(2)100℃时,将1 mol CH4和2 mol H2O通入容积固定为10 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则H2的反应速率v(H2)=
A.容器内气体密度恒定 B.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
C.容器的压强恒定 D.3v正(CH4)= v逆(H2)
(3)为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有
A.升高温度 B.缩小容器体积
C.再充入CH4气体 D.使用合适的催化剂
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】“低碳经济”已成为全世界科学家研究的重要课题。中国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将甲烷和二氧化碳一步转化为具有高附加值的液体燃料和化工产品。回答下列问题:
(1)甲烷和二氧化碳一步转化为液体产品的选择性如图甲所示,其中选择性最高的产品是_______ ,反应中应加入的等离子体催化剂是_______ 。

(2)在某一刚性密闭容器中CH4、CO2的分压分别为25kPa、30kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
①能够说明上述可逆反应达到平衡状态的是_______ 。
A.容器内气体密度不再改变
B.平均摩尔质量不再改变
C.CO2和H2的分压相等
D.CH4的分压不再改变
E.v(CO)逆=2v(CO2)正
②研究表明CO的生成速率、v(CO)=1.32×10-2·P(CH4)·P(CO2)mol/(g·s)某时刻测得P(H2)=20kPa,则P(CH4)=_______ kPa,v(CO)=_______ mol/(g·s)。
③温度对产物流量及平衡转化率的影响如图乙所示,可知反应△H_______ 0(填“>”或“<”),原因是_______ 。

(1)甲烷和二氧化碳一步转化为液体产品的选择性如图甲所示,其中选择性最高的产品是

(2)在某一刚性密闭容器中CH4、CO2的分压分别为25kPa、30kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
①能够说明上述可逆反应达到平衡状态的是
A.容器内气体密度不再改变
B.平均摩尔质量不再改变
C.CO2和H2的分压相等
D.CH4的分压不再改变
E.v(CO)逆=2v(CO2)正
②研究表明CO的生成速率、v(CO)=1.32×10-2·P(CH4)·P(CO2)mol/(g·s)某时刻测得P(H2)=20kPa,则P(CH4)=
③温度对产物流量及平衡转化率的影响如图乙所示,可知反应△H

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】一定条件下,将原料气按n(CO2)∶n(H2)=1:4置于密闭容器中发生如下反应:CO2(g)+4H2(g)  CH4(g)+2H2O(g)。测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
CH4(g)+2H2O(g)。测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。

(1)该反应的△H___ 0(选填“>”、“<”)。
(2)温度过低,不利于该反应发生,原因是_____ ,温度过高也不利于该反应的进行,原因是______ 。
(3)200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为________ 。(不必化简。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)下列措施能提高CO2转化效率的是______ 。
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
(5)产物甲烷可以作为燃料电池的原料,写出甲烷-氧气碱性燃料电池的负极电极方程式:__________________ 。
 CH4(g)+2H2O(g)。测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
CH4(g)+2H2O(g)。测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
(1)该反应的△H
(2)温度过低,不利于该反应发生,原因是
(3)200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算式为
(4)下列措施能提高CO2转化效率的是
A.适当减压
B.增大催化剂的比表面积
C.反应器前段加热,后段冷却
D.提高原料气中CO2所占比例
(5)产物甲烷可以作为燃料电池的原料,写出甲烷-氧气碱性燃料电池的负极电极方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
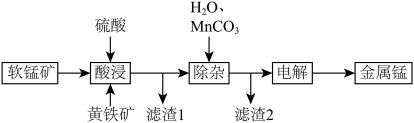
【推荐2】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:
已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
回答下列问题:
除杂步骤中加入的MnCO3的作用是____________________________ ,该过程需调节溶液pH的范围是___________________________ ,若把pH调得过高,其后果是_________________________ 。

已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
| 金属离子 | Fe3+ | Mn2+ | Al3+ |
| 开始沉淀的pH | 2.7 | 8.3 | 3.2 |
| 沉淀完全的pH | 3.7 | 9.8 | 5.0 |
除杂步骤中加入的MnCO3的作用是
您最近一年使用:0次

 +
+ +3H2O
+3H2O


