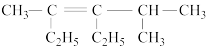按要求填空:
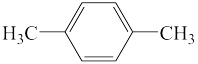
(1)相对分子质量为72的烷烃的分子式为___________ ,结构有___________ 种,分别写出它们的结构简式___________ 。
(2)下列物质熔沸点由高到低的顺序是:①CH4;②C3H8;③CH3CH(CH3)2 ;④CH3CH2CH2CH3;___________ (填序号)
(3)4 g甲烷在氧气中燃烧生成CO2和液态水,放出222.5 kJ热量,写出表示甲烷燃烧热的热化学方程式___________ 。
(4)已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1
O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1
②2Al(s)+ O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1
Al和FeO发生反应的热化学方程式是___________ 。
(1)相对分子质量为72的烷烃的分子式为
(2)下列物质熔沸点由高到低的顺序是:①CH4;②C3H8;③CH3CH(CH3)2 ;④CH3CH2CH2CH3;
(3)4 g甲烷在氧气中燃烧生成CO2和液态水,放出222.5 kJ热量,写出表示甲烷燃烧热的热化学方程式
(4)已知:①Fe(s)+
 O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1
O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1②2Al(s)+
 O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1Al和FeO发生反应的热化学方程式是
更新时间:2021-04-30 21:53:19
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
(1)写出肼(l)和N2O4(l)完全反应生成N2和水蒸气时的热化学方程式:__________ 。
(2)已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,O—H为462,则断裂1 mol N—H键所需的能量是________ kJ。
①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
(1)写出肼(l)和N2O4(l)完全反应生成N2和水蒸气时的热化学方程式:
(2)已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,O—H为462,则断裂1 mol N—H键所需的能量是
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】已知下列热化学方程式:
① H2(g) + O2(g) = H2O(l) △H = -285.8 kJ / mol
O2(g) = H2O(l) △H = -285.8 kJ / mol
② C(s) + O2(g) = CO2(g) △H = -393.5 kJ / mol
③ C(s) + H2O(g) =CO(g) + H2(g) △H= +131.5 kJ/mol
请回答:
(1)上述反应中属于放热反应的是_________ (填序号,下同),属于吸热反应的是_________ 。
(2)1 mol H2完全燃烧生成液态水,放出的热量为________________ 。
(3)碳的燃烧热△H=_______________ 。
(4)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式__________________________________ 。
① H2(g) +
 O2(g) = H2O(l) △H = -285.8 kJ / mol
O2(g) = H2O(l) △H = -285.8 kJ / mol② C(s) + O2(g) = CO2(g) △H = -393.5 kJ / mol
③ C(s) + H2O(g) =CO(g) + H2(g) △H= +131.5 kJ/mol
请回答:
(1)上述反应中属于放热反应的是
(2)1 mol H2完全燃烧生成液态水,放出的热量为
(3)碳的燃烧热△H=
(4)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】研究燃料的燃烧效率和对污染气体产物的无害化处理,对于防止大气污染有重要意义。
(1)将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g) = H2O(g) H= −242.0 kJ/mol
H= −242.0 kJ/mol
C(s)+1/2O2(g) = CO(g) H= −110.0 kJ/mol
H= −110.0 kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式_____________________ 。
②已知在101kPa时,CO、 H2和CH4的燃烧热分别为283kJ/mol、286 kJ/mol和892kJ/mol,H2O(l)= H2O(g) △H= +44.0 kJ/mol,则反应CH4(g)+ H2O(g) CO(g)+3H2(g)△H=
CO(g)+3H2(g)△H=______________ 。
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:CO(g)+2H2(g) CH3OH(g)△H=-91kJ/mol
CH3OH(g)△H=-91kJ/mol
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是_____________ 。
A.2mol CO和4mol H2 B.2mol CO、4mol H2和1mol CH3OH(g)
C.4mol CO和4mol H2 D.4mol CO和6mol H2
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%,反应达到平衡时的热量变化是___ (填“吸收”或“放出”)___ kJ热量。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则 ΔH2=____ 。
(1)将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g) = H2O(g)
 H= −242.0 kJ/mol
H= −242.0 kJ/molC(s)+1/2O2(g) = CO(g)
 H= −110.0 kJ/mol
H= −110.0 kJ/mol①写出焦炭与水蒸气反应制H2和CO的热化学方程式
②已知在101kPa时,CO、 H2和CH4的燃烧热分别为283kJ/mol、286 kJ/mol和892kJ/mol,H2O(l)= H2O(g) △H= +44.0 kJ/mol,则反应CH4(g)+ H2O(g)
 CO(g)+3H2(g)△H=
CO(g)+3H2(g)△H=(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:CO(g)+2H2(g)
 CH3OH(g)△H=-91kJ/mol
CH3OH(g)△H=-91kJ/mol①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是
A.2mol CO和4mol H2 B.2mol CO、4mol H2和1mol CH3OH(g)
C.4mol CO和4mol H2 D.4mol CO和6mol H2
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%,反应达到平衡时的热量变化是
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则 ΔH2=
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐1】已知A(g)+C(g)=D(g)ΔH=-Q1kJ/mol,B(g)+C(g)=E(g)ΔH=-Q2kJ/mol,Q1、Q2均大于0,且Q1>Q2。若A、B组成的混合气体1 mol与足量的C反应,放热为Q3kJ。则原混合气体中A与B的物质的量之比为_____________
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】已知:
2H2(g) + O2(g) =2H2O( l) ΔH= -571.6 kJ·mol-1
CO(g) + O2(g) = CO2(g) △H= -283 kJ·mol-1
O2(g) = CO2(g) △H= -283 kJ·mol-1
某H2和CO的混合气体完全燃烧时放出113.76 kJ热量,同时生成3.6 g液态水,求原混合气体中
H2和CO的物质的量_______ 。
2H2(g) + O2(g) =2H2O( l) ΔH= -571.6 kJ·mol-1
CO(g) +
 O2(g) = CO2(g) △H= -283 kJ·mol-1
O2(g) = CO2(g) △H= -283 kJ·mol-1某H2和CO的混合气体完全燃烧时放出113.76 kJ热量,同时生成3.6 g液态水,求原混合气体中
H2和CO的物质的量
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】已知下列两个热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220kJ·mol-1
根据上面两个热化学方程式,试回答下列问题:
(1)H2的燃烧热是__ 。
(2)1molH2完全燃烧释放的热量为__ 。
(3)1molH2和2molC3H8组成的混合气体完全燃烧释放的热量为__ 。
(4)已知:H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
1molH2O(g)转变为H2O(l)时需要__ (填放出或吸收)__ 的热量。
试写出丙烷燃烧生成CO2和水蒸气时的热化学方程式__ 。
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2220kJ·mol-1
根据上面两个热化学方程式,试回答下列问题:
(1)H2的燃烧热是
(2)1molH2完全燃烧释放的热量为
(3)1molH2和2molC3H8组成的混合气体完全燃烧释放的热量为
(4)已知:H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
1molH2O(g)转变为H2O(l)时需要
试写出丙烷燃烧生成CO2和水蒸气时的热化学方程式
您最近一年使用:0次