海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了如图实验:
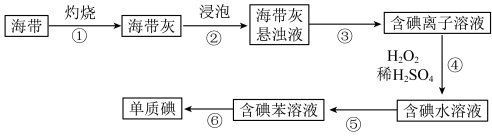
请填写下列空白:
(1)步骤③的实验操作名称是_______ 。
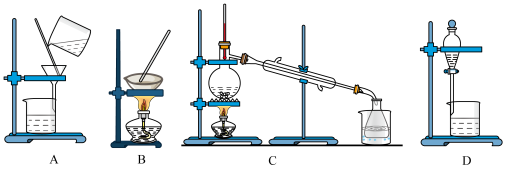
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是_______ 。
(3) 碘离子能被氯气氧化,请写出相关离子方程式是_______ 。
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:_______ 。

请填写下列空白:
(1)步骤③的实验操作名称是
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是

(3) 碘离子能被氯气氧化,请写出相关离子方程式是
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:
更新时间:2021-05-07 07:36:07
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】甘氨酸亚铁[(H2NCH2COO)2Fe]可有效改善缺铁性贫血,化学兴趣小组的同学设计了如下两个实验:装置1制备碳酸亚铁晶体;装置2制备甘氨酸亚铁。已知:柠檬酸易溶于水,具有较强的酸性和还原性。回答下列问题:
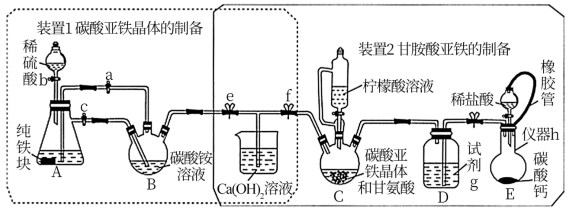
I.碳酸亚铁晶体(FeCO3·nH2O)的制备
(1)实验操作如下:关闭f,打开e,然后关闭活塞a,打开活塞b、c,加入适量稀硫酸反应一段时间后,关闭活塞b、c,打开活塞a,以上操作的目的为_______ 并使A产生的硫酸亚铁压入到B装置中发生反应;实验结束后,若装置B中没有出现碳酸亚铁晶体,可能的原因是_______ 。
(2)反应结束后,对装置B中的反应液进行静置、过滤、洗涤、干燥,得到碳酸亚铁晶体。过滤操作过程中用到的玻璃仪器有烧杯_______ ;干燥过程中可能有少量碳酸亚铁晶体被氧化为FeOOH,检验该氧化产物中阳离子所用的化学试剂为_______
II.甘氨酸亚铁[(H2NCH2COO)2Fe]的制备
实验操作如下:将装置1制取的碳酸亚铁晶体与甘氨酸的水溶液混合加入C中,关闭e,打开f,然后利用E中盐酸和碳酸钙反应生成的气体排尽装置中的空气,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥,得到甘氨酸亚铁。
(3)仪器h的名称为_______ ;试剂g为_______
(4)为了提高(H2NCH2COO)2Fe的产率,需要控制C中反应溶液的pH在5.6~6.0之间。若pH过低,(H2NCH2COO)2Fe的产率将降低,其原因为_______ ,滴入柠檬酸溶液的作用除了促进FeCO3的溶解,调节溶液的pH外,还有_______ 。
(5)(H2NCH2COO)2Fe中Fe2+含量的测定:使用电子天平准确称取3.440g产品,用蒸馏水配制成100mL溶液。取出25.00mL溶液于锥形瓶中,向其中加入一定量的稀硫酸酸化,用0.05000mol·L-1KMnO4;标准溶液滴定至终点(已知滴定过程中只有Fe2+被氧化),消耗KMnO4标准溶液的体积为17.20mL。则产品中Fe2+的质量分数为_______

I.碳酸亚铁晶体(FeCO3·nH2O)的制备
(1)实验操作如下:关闭f,打开e,然后关闭活塞a,打开活塞b、c,加入适量稀硫酸反应一段时间后,关闭活塞b、c,打开活塞a,以上操作的目的为
(2)反应结束后,对装置B中的反应液进行静置、过滤、洗涤、干燥,得到碳酸亚铁晶体。过滤操作过程中用到的玻璃仪器有烧杯
II.甘氨酸亚铁[(H2NCH2COO)2Fe]的制备
实验操作如下:将装置1制取的碳酸亚铁晶体与甘氨酸的水溶液混合加入C中,关闭e,打开f,然后利用E中盐酸和碳酸钙反应生成的气体排尽装置中的空气,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥,得到甘氨酸亚铁。
(3)仪器h的名称为
(4)为了提高(H2NCH2COO)2Fe的产率,需要控制C中反应溶液的pH在5.6~6.0之间。若pH过低,(H2NCH2COO)2Fe的产率将降低,其原因为
(5)(H2NCH2COO)2Fe中Fe2+含量的测定:使用电子天平准确称取3.440g产品,用蒸馏水配制成100mL溶液。取出25.00mL溶液于锥形瓶中,向其中加入一定量的稀硫酸酸化,用0.05000mol·L-1KMnO4;标准溶液滴定至终点(已知滴定过程中只有Fe2+被氧化),消耗KMnO4标准溶液的体积为17.20mL。则产品中Fe2+的质量分数为
您最近一年使用:0次
【推荐2】按要求回答以下问题:
(1)3S+6KOH K2SO3+2K2S+3H2O,氧化剂是
K2SO3+2K2S+3H2O,氧化剂是_______ (填化学式),还原剂是_______ (填化学式)。
(2)2KMnO4+16HCl(浓)=2KCl+2MnC12+8H2O+5Cl2↑,其中KMnO4中Mn的化合价是_______ 价,被氧化的物质是_______ (填化学式)。
(3)8NH3+6NO2 7N2+12H2O,
7N2+12H2O,_______ (填化学式)发生氧化反应,氧化产物是_______ (填化学式),每转移_______ mol电子,则产生7mol的N2。
(1)3S+6KOH
 K2SO3+2K2S+3H2O,氧化剂是
K2SO3+2K2S+3H2O,氧化剂是(2)2KMnO4+16HCl(浓)=2KCl+2MnC12+8H2O+5Cl2↑,其中KMnO4中Mn的化合价是
(3)8NH3+6NO2
 7N2+12H2O,
7N2+12H2O,
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐3】完成下列问题。
(1)有A、B、C、D四种化合物,分别由K+、Ba2+、 、
、 、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。推断A、B、C、D的化学式:A.
、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。推断A、B、C、D的化学式:A._______ ,B._______ ,C._______ ,D._______ 。写出B与盐酸反应的离子方程式:_______ ,
(2)一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH (B元素的化合价为+3价)与Fe2+反应生成纳米铁粉、H2和B(OH)
(B元素的化合价为+3价)与Fe2+反应生成纳米铁粉、H2和B(OH) ,其离子方程式为
,其离子方程式为_______ 。
(3)在无水条件下制备高铁酸钠的主要反应为2FeSO4+aNa2O2=2Na2FeO4+bX+2Na2SO4+cO2↑,该反应中物质X的化学式为_______ ,b与c的关系是_______ 。
(1)有A、B、C、D四种化合物,分别由K+、Ba2+、
 、
、 、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。推断A、B、C、D的化学式:A.
、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。推断A、B、C、D的化学式:A.(2)一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH
 (B元素的化合价为+3价)与Fe2+反应生成纳米铁粉、H2和B(OH)
(B元素的化合价为+3价)与Fe2+反应生成纳米铁粉、H2和B(OH) ,其离子方程式为
,其离子方程式为(3)在无水条件下制备高铁酸钠的主要反应为2FeSO4+aNa2O2=2Na2FeO4+bX+2Na2SO4+cO2↑,该反应中物质X的化学式为
您最近一年使用:0次
【推荐1】海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
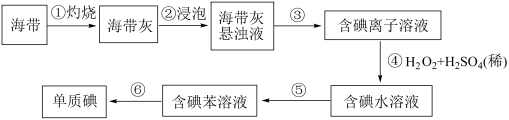
请填写下列空白:
(1)步骤⑤的实验操作名称是_____________________ 。
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是____________ 。
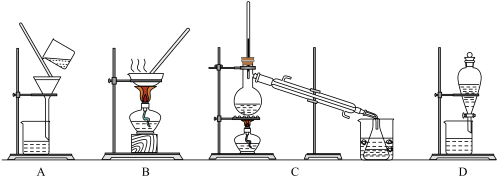
(3)步骤④反应的离子方程式是___________________________________________ 。
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:_____________________ 。

请填写下列空白:
(1)步骤⑤的实验操作名称是
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是

(3)步骤④反应的离子方程式是
(4)请设计一个简单的实验方案,检验提取碘后的水溶液中是否还含有单质碘:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】海水是巨大的资源宝库,从海水中提取溴和碘的过程如下。
(1)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验装置。

①图中仪器B的名称是___ ,冷却水的出口为___ 。(填“甲”或“乙”)
②C中液体的颜色为___ 。
③D装置中NaOH溶液的作用是___ 。
(2)如图是工业上从海水中提取镁的简单流程。
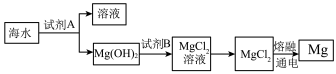
①工业上常用于沉淀Mg2+的试剂A是___ 。
②电解熔融的无水氯化镁所得的镁蒸汽在特定的环中冷却后即为固体镁。下列物质中可以用作镁蒸汽的冷却剂的是___ 。(填字母)
A.Ar B.CO2 C.氮气 D.O2 E.水蒸气
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如图所示。

①灼烧海带时所用的主要仪器名称是___ 。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式___ 。
②向酸化的滤液应该再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈___ 色。
(1)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验装置。

①图中仪器B的名称是
②C中液体的颜色为
③D装置中NaOH溶液的作用是
(2)如图是工业上从海水中提取镁的简单流程。

①工业上常用于沉淀Mg2+的试剂A是
②电解熔融的无水氯化镁所得的镁蒸汽在特定的环中冷却后即为固体镁。下列物质中可以用作镁蒸汽的冷却剂的是
A.Ar B.CO2 C.氮气 D.O2 E.水蒸气
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如图所示。

①灼烧海带时所用的主要仪器名称是
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式
②向酸化的滤液应该再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
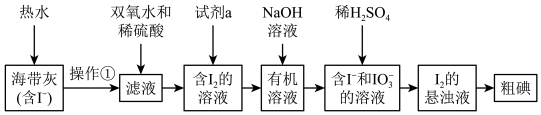
【推荐3】海洋是一个巨大的资源宝库。在海洋中生长的海带,富含碘元素。某同学设计以下实验方案,从海带中提取 。
。___________ 。
(2)如将加双氧水改为加二氧化锰也可达到实验目的,写出向滤液中加入 和稀硫酸发生反应的离子方程式:
和稀硫酸发生反应的离子方程式:___________ 。
(3)试剂a可以是___________ 。
(4)I-和 生成I2的离子方程式是
生成I2的离子方程式是___________ 。
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是___________ 。
(6)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:___________ 。
 。
。
(2)如将加双氧水改为加二氧化锰也可达到实验目的,写出向滤液中加入
 和稀硫酸发生反应的离子方程式:
和稀硫酸发生反应的离子方程式:(3)试剂a可以是
(4)I-和
 生成I2的离子方程式是
生成I2的离子方程式是(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是
(6)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:
您最近一年使用:0次



