黑木耳是常见食品,可以补充人体所必需的微量元素铁。某兴趣小组设计实验,检验黑木耳中的铁元素,实验流程如图:
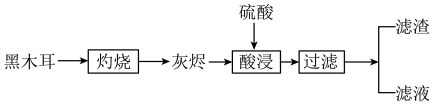
(1)灼烧黑木耳必须用到下列仪器中的___ (填字母)。
A. B.
B. C.
C. D.
D.
(2)灰烬中含有铁的氧化物以及钾、钙、硅等元素的化合物,酸浸的目的是___ 。
(3)取少许滤液于试管中,滴入几滴KSCN溶液,显红色,说明滤液中含有___ ;另取滤液检验,滤液能使KMnO4溶液紫色褪去,说明滤液中存在具有___ (填“氧化性”或“还原性”)的粒子。
(4)为进一步探究Fe3+和Fe2+的氧化性和还原性,该兴趣小组设计并进行如下实验,记录现象,完成实验报告。
(5)实验结束,离开实验室之前,下列做法正确的是___ (填字母)。
A.废弃药品直接倒入水池冲走 B.药品仪器归放
C.清洁实验仪器,打扫实验室卫生 D.关闭水电、门窗

(1)灼烧黑木耳必须用到下列仪器中的
A.
 B.
B. C.
C. D.
D.
(2)灰烬中含有铁的氧化物以及钾、钙、硅等元素的化合物,酸浸的目的是
(3)取少许滤液于试管中,滴入几滴KSCN溶液,显红色,说明滤液中含有
(4)为进一步探究Fe3+和Fe2+的氧化性和还原性,该兴趣小组设计并进行如下实验,记录现象,完成实验报告。
| 实验操作 | 实验现象 | 离子方程式 | 实验结论 |
| 向FeCl2溶液中添加新制氯水 | 溶液由浅绿色变为棕黄色 | 2Fe2++Cl2=2Fe3++2Cl- | ① |
| 向FeCl3溶液加入足量的铁粉 | 铁粉逐渐溶解,溶液由棕黄色变为浅绿色 | ② | Fe3+具有氧化性 |
A.废弃药品直接倒入水池冲走 B.药品仪器归放
C.清洁实验仪器,打扫实验室卫生 D.关闭水电、门窗
2021高二上·广东·学业考试 查看更多[5]
2021年1月广东省普通高中学业水平合格性考试化学试题(已下线)第12讲 铁、亚铁盐和铁盐-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)广东省深圳市南头中学2021~2022学年下学期期中考试化学试题 (学考科目)(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
更新时间:2021-05-23 22:07:59
|
相似题推荐
解答题-工业流程题
|
较易
(0.85)
【推荐1】某工业废水中含有大量的氯化亚铁、较多的氯化铜和少量的氯化钠。为减少污染并变废为宝,该工厂计划从废水中回收氯化亚铁和金属铜,请根据以下流程图,回答下列问题:
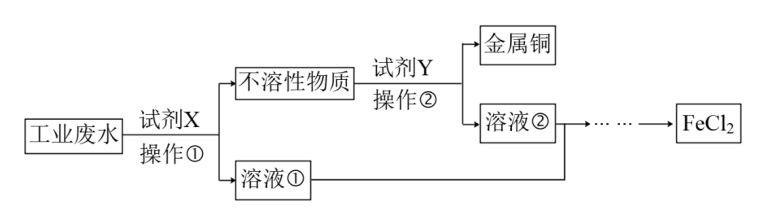
(1)不溶性物质的主要成分为___________ 。
(2)溶液②中溶质为___________ 。
(3)若鉴别溶液②中含有的主要金属阳离子时,应滴加的试剂依次为___________ ,请写出该鉴别过程中属于氧化还原反应的离子方程式___________ 。
(4)回收的氯化亚铁溶于水被氧化后得到氯化铁溶液,氯化铁溶液可用于腐蚀印刷电路板上的铜,向腐蚀后的溶液中加入一定量铁粉,充分反应。
①对反应后的溶液分析正确的是___________ 。
a.溶液中一定含有Fe2+
b.若有固体剩余,固体中一定含有铁
c.若有铁剩余,溶液中可能含有Cu2+
d.溶液若有Fe3+剩余,则一定没有固体析出
②在含有4molFeCl2的溶液中加入4molNa2O2,现象是___________ 。已知反应物恰好完全反应且反应转移6mol电子,发生反应的总的离子方程式:___________ 。

(1)不溶性物质的主要成分为
(2)溶液②中溶质为
(3)若鉴别溶液②中含有的主要金属阳离子时,应滴加的试剂依次为
(4)回收的氯化亚铁溶于水被氧化后得到氯化铁溶液,氯化铁溶液可用于腐蚀印刷电路板上的铜,向腐蚀后的溶液中加入一定量铁粉,充分反应。
①对反应后的溶液分析正确的是
a.溶液中一定含有Fe2+
b.若有固体剩余,固体中一定含有铁
c.若有铁剩余,溶液中可能含有Cu2+
d.溶液若有Fe3+剩余,则一定没有固体析出
②在含有4molFeCl2的溶液中加入4molNa2O2,现象是
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】从废旧锂电池正极材料中(主要成分为 、导电炭黑和铝箔)回收锂一直是科学家关注的热点,所设计的流程如下图所示:
、导电炭黑和铝箔)回收锂一直是科学家关注的热点,所设计的流程如下图所示:
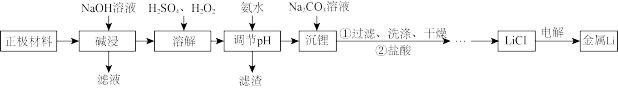
已知:ⅰ. 溶解度如下表:
溶解度如下表:
ⅱ.常温下,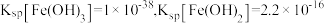
ⅲ. :不溶于碱,可溶于稀酸;
:不溶于碱,可溶于稀酸;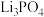 :白色结晶粉末,可溶于稀酸。
:白色结晶粉末,可溶于稀酸。
完成下列问题:
(1) 中
中 化合价为
化合价为___________ 。
(2)上述流程中,提高“溶解”步骤速率的措施有___________ (任写一条),该步骤中主要的离子方程式为___________ 。
(3)滤渣的主要成分为___________ 。
(4)常温下,使用氨水调节溶液的 ,理论上最小值为
,理论上最小值为___________ 。(当溶液中离子浓度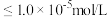 时,可认为该离子沉淀完全)
时,可认为该离子沉淀完全)
(5)洗涤 沉淀应使用
沉淀应使用___________ (填“热水”或“冷水”)。
 、导电炭黑和铝箔)回收锂一直是科学家关注的热点,所设计的流程如下图所示:
、导电炭黑和铝箔)回收锂一直是科学家关注的热点,所设计的流程如下图所示:
已知:ⅰ.
 溶解度如下表:
溶解度如下表:温度/ | 0 | 10 | 20 | 50 | 75 | 100 |
| 溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
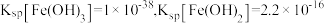
ⅲ.
 :不溶于碱,可溶于稀酸;
:不溶于碱,可溶于稀酸;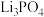 :白色结晶粉末,可溶于稀酸。
:白色结晶粉末,可溶于稀酸。完成下列问题:
(1)
 中
中 化合价为
化合价为(2)上述流程中,提高“溶解”步骤速率的措施有
(3)滤渣的主要成分为
(4)常温下,使用氨水调节溶液的
 ,理论上最小值为
,理论上最小值为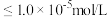 时,可认为该离子沉淀完全)
时,可认为该离子沉淀完全)(5)洗涤
 沉淀应使用
沉淀应使用
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐3】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
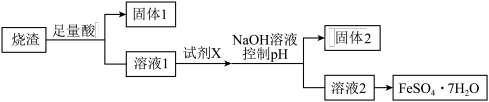
回答下列问题:
(1)溶解烧渣选用________ ;试剂X选用________ 。(填物质化学式)
(2)固体1中主要成分为________ 。(填物质化学式)
(3)加入NaOH控制pH的目的是________ 。
(4)由溶液2得到FeSO4·7H2O产品,实验操作为________ 、________ ,过滤、洗涤、干燥。
(5)从溶液2得到FeSO4·7H2O产品的过程中,除了需要防止其水解,还要防止________ 。

回答下列问题:
(1)溶解烧渣选用
(2)固体1中主要成分为
(3)加入NaOH控制pH的目的是
(4)由溶液2得到FeSO4·7H2O产品,实验操作为
(5)从溶液2得到FeSO4·7H2O产品的过程中,除了需要防止其水解,还要防止
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】“分类”是一种思想方法,利用分类对物质性质进行探究是科学探究的重要方法,某学习兴趣小组为探究物质的性质向实验室提供了如下实验试剂清单:
利用上述试剂,小组同学完成以下实验,回答下列问题:
(1)生活中常作为食品抗氧化剂的是___________ (填序号);常温下,实验室用②和④制备 ,选择②而不选择①的原因
,选择②而不选择①的原因___________ 。
(2)纳米级碳酸钙在造纸业中有重要用途,查阅资料后,小组同学采用将 和
和 混合通入⑤中的方法制备,证明所得分散系中的碳酸钙为纳米级碳酸钙的操作方法是
混合通入⑤中的方法制备,证明所得分散系中的碳酸钙为纳米级碳酸钙的操作方法是___________ 。
(3)实验中需用⑦配制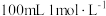 烧碱溶液,下列操作不正确的是___________。
烧碱溶液,下列操作不正确的是___________。
(4)取适量⑨于试管中,滴入少量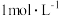 烧碱溶液,反应的现象为
烧碱溶液,反应的现象为___________ ;试剂⑨保存不当易变质,证明⑨是否完全变质可选择的试剂为___________ (填试剂序号)
| 组别 | 一 | 二 | 三 | 四 |
| 试剂及编号 | ①铁粉 | ④浓硝酸 | ⑤澄清石灰水 | ⑧酸性 溶液 溶液 |
| ②铜粉 | ⑥氨水 | ⑨ 溶液 溶液 | ||
| ③氯水 | ⑦ 固体 固体 | ⑩ 溶液 溶液 |
(1)生活中常作为食品抗氧化剂的是
 ,选择②而不选择①的原因
,选择②而不选择①的原因(2)纳米级碳酸钙在造纸业中有重要用途,查阅资料后,小组同学采用将
 和
和 混合通入⑤中的方法制备,证明所得分散系中的碳酸钙为纳米级碳酸钙的操作方法是
混合通入⑤中的方法制备,证明所得分散系中的碳酸钙为纳米级碳酸钙的操作方法是(3)实验中需用⑦配制
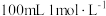 烧碱溶液,下列操作不正确的是___________。
烧碱溶液,下列操作不正确的是___________。A.用托盘天平在滤纸上称量 固体 固体 |
| B.将固体溶解后,溶液冷却至室温转移到容量瓶中 |
| C.转移溶液时,玻璃棒下端紧贴容量瓶刻线下内壁 |
| D.定容时用玻璃棒引流加入蒸馏水至凹液面最低端与刻线相平齐 |
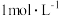 烧碱溶液,反应的现象为
烧碱溶液,反应的现象为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】磁铁矿的主要成分是 。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。
。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。
(1)步骤一:取少量磁铁矿石,粉碎后加入过量的试剂A可选用_____。
(2)步骤二:验证: 。取溶解后的无色液体少许,加入少量
。取溶解后的无色液体少许,加入少量___________ ,若观察到溶液变为血红色,则证明有 。
。
(3)步骤三:验证: 。取溶解后的无色液体少许,加入少量
。取溶解后的无色液体少许,加入少量___________ ,若观察到___________ ,则证明有 。
。
 。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。
。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。(1)步骤一:取少量磁铁矿石,粉碎后加入过量的试剂A可选用_____。
| A.氨水 | B.氢氧化钠溶液 | C.盐酸 | D.硫酸 |
 。取溶解后的无色液体少许,加入少量
。取溶解后的无色液体少许,加入少量 。
。(3)步骤三:验证:
 。取溶解后的无色液体少许,加入少量
。取溶解后的无色液体少许,加入少量 。
。
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】某兴趣小组利用下列试剂:铁粉、锌粉、0.1mol/LFeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用所给试剂写出体现Fe2+具有还原性的反应的离子反应方程式:___ 。
(2)设计实验方案,完成下列表格。
(3)该兴趣小组未说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为___ 。
(4)某反应中反应物与生成物有Fe3+、MnO 、H2O和一种未知离子X。
、H2O和一种未知离子X。
①已知氧化性:MnO >Fe3+,则X离子是
>Fe3+,则X离子是___ 。
②该反应的离子方程式是___ 。
(1)用所给试剂写出体现Fe2+具有还原性的反应的离子反应方程式:
(2)设计实验方案,完成下列表格。
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+的化学性质 | 取少量0.1mol/LFeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液 | 加入铁粉后,溶液变成 |
| 结论:Fe3+具有 | ||
(4)某反应中反应物与生成物有Fe3+、MnO
 、H2O和一种未知离子X。
、H2O和一种未知离子X。①已知氧化性:MnO
 >Fe3+,则X离子是
>Fe3+,则X离子是②该反应的离子方程式是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
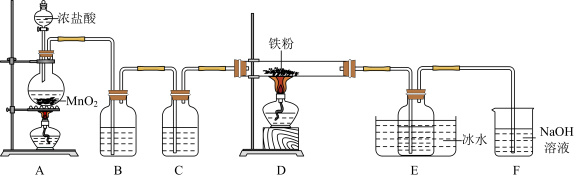
【推荐1】 是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
已知:① 易升华、遇水蒸气易潮解。
易升华、遇水蒸气易潮解。
②实验室用铁氰化钾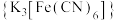 溶液检验
溶液检验 ,产生蓝色沉淀。
,产生蓝色沉淀。
回答下列问题:
(1)盛装浓盐酸的仪器是___________ (填名称),装置B中的试剂是___________ ,装置C的作用是___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置E中冰水浴的作用是___________ 。
(4)上述实验装置存在两处缺陷:一是制备产品的导气管太细,易堵塞;二是___________ 。
(5)对实验装置进行改进后,继续完成实验。实验完毕后,取产品探究其性质:
根据上述实验现象,不能确定产品中是否含有铁单质,理由是___________ (用离子方程式表示)。为了确认产品中是否含有铁单质,取上述实验②所得溶液于试管中,___________ (补充步骤和现象),则证明产品中含有铁单质。
 是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
已知:①
 易升华、遇水蒸气易潮解。
易升华、遇水蒸气易潮解。②实验室用铁氰化钾
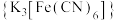 溶液检验
溶液检验 ,产生蓝色沉淀。
,产生蓝色沉淀。回答下列问题:
(1)盛装浓盐酸的仪器是
(2)装置A中发生反应的离子方程式为
(3)装置E中冰水浴的作用是
(4)上述实验装置存在两处缺陷:一是制备产品的导气管太细,易堵塞;二是
(5)对实验装置进行改进后,继续完成实验。实验完毕后,取产品探究其性质:
| 实验 | 操作 | 现象 |
| ① | 取少量固体溶于蒸缩水,滴加KSCN溶液 | 溶液变红色 |
| ② | 取少量固体溶于稀硫酸 | 固体溶解,无气泡产生 |
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
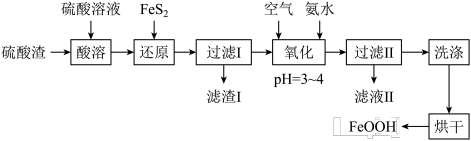
(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为___________________ 。
(2)滤渣I的主要成分是FeS2、S和___________ (填化学式);Fe3+被FeS2还原的离子方程式为_______________ 。
(3)“氧化”中,生成FeOOH的离子方程式为_______________ 。

(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为
(2)滤渣I的主要成分是FeS2、S和
(3)“氧化”中,生成FeOOH的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐3】以含钛高炉渣(主要成分为 ,还含有少量CaO、Fe2O3、
,还含有少量CaO、Fe2O3、 )为原料生产
)为原料生产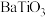 的工艺流程如下:
的工艺流程如下:
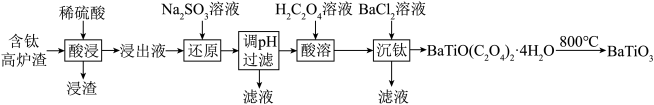
已知:
①浸出液的pH小于0.5
②相关金属离子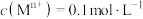 时,形成氢氧化物沉淀的pH范围如下:
时,形成氢氧化物沉淀的pH范围如下:
请回答以下问题:
(1)“浸渣”的主要成分为___________ (填化学式)。
(2)为了提高“酸浸”的浸取率,可采取的措施为___________ (任写一条)。
(3)加入 时所发生氧化还原反应的离子方程式为
时所发生氧化还原反应的离子方程式为___________ 。
 ,还含有少量CaO、Fe2O3、
,还含有少量CaO、Fe2O3、 )为原料生产
)为原料生产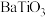 的工艺流程如下:
的工艺流程如下:
已知:
①浸出液的pH小于0.5
②相关金属离子
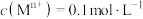 时,形成氢氧化物沉淀的pH范围如下:
时,形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |
| 开始沉淀的pH | 0.5 | 6.3 | 1.5 |
| 沉淀完全的pH | 2.5 | 8.3 | 2.8 |
(1)“浸渣”的主要成分为
(2)为了提高“酸浸”的浸取率,可采取的措施为
(3)加入
 时所发生氧化还原反应的离子方程式为
时所发生氧化还原反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】聚合硫酸铝铁(PAFS)是一种高效净水剂,其组成表示为[AlFe(OH)x(SO4)(3- )]y。为检测PAFS中Al的含量,设计如下流程。
)]y。为检测PAFS中Al的含量,设计如下流程。
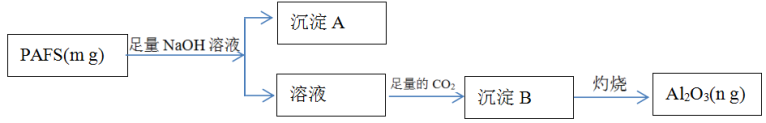
回答下列问题:
(1)实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为__ 。
(2)PAFS中铁元素的化合价为_______ ;沉淀A的化学式为_________ 。
(3)如图所示,过滤操作中的一处错误是__________ 。
(4)生成沉淀B的离子方程式为______ 。
(5)PAFS中Al元素的质量分数为_______ (用同m、n的代数式表示)。
 )]y。为检测PAFS中Al的含量,设计如下流程。
)]y。为检测PAFS中Al的含量,设计如下流程。
回答下列问题:
(1)实验中需配制1.0mol/L的NaOH溶液100mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器为
(2)PAFS中铁元素的化合价为
(3)如图所示,过滤操作中的一处错误是

(4)生成沉淀B的离子方程式为
(5)PAFS中Al元素的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
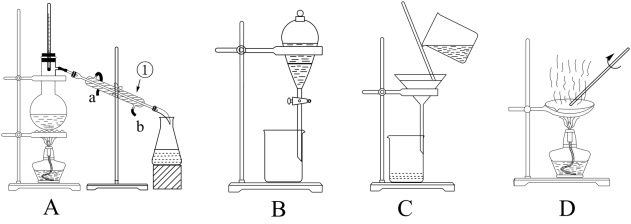
(1)装置 中玻璃仪器的名称除玻璃棒还有
中玻璃仪器的名称除玻璃棒还有___________ 。
(2)从碘水中分离出 ,选择装置
,选择装置___________ (填代表装置图的字母,下同),该分离方法的名称为___________ 、___________ 。
(3)从氯化钾溶液中得到氯化钾固体,选择装置___________ ﹔除去自来水中的 等杂质,选择装置
等杂质,选择装置___________ 。
(4)装置 中①的名称是
中①的名称是___________ ,进水的方向是从___________ 口进水,加入沸石或碎瓷片的目的是___________ ,温度计水银球的位置为___________ 。

(1)装置
 中玻璃仪器的名称除玻璃棒还有
中玻璃仪器的名称除玻璃棒还有(2)从碘水中分离出
 ,选择装置
,选择装置(3)从氯化钾溶液中得到氯化钾固体,选择装置
 等杂质,选择装置
等杂质,选择装置(4)装置
 中①的名称是
中①的名称是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】某学习小组想探究钠能否与 反应,为此设计如下图所示装置,实验操作及现象见下表。
反应,为此设计如下图所示装置,实验操作及现象见下表。
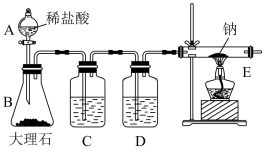
(1)C中所盛试剂为________ ,作用是________ 。D中所盛试剂为________ ,作用是_________ 。
(2)B中反应一段时间,等E中充满 后,再点燃E处酒精灯,其目的是
后,再点燃E处酒精灯,其目的是__________ 。
(3)请根据以上现象写出E中发生反应的化学方程式:________ 。
 反应,为此设计如下图所示装置,实验操作及现象见下表。
反应,为此设计如下图所示装置,实验操作及现象见下表。
| 实验I | 实验II | |
| 操作 | 先取一块纯净的钠放入干燥的E管中,然后打开A的活塞,反应一段时间后,点燃E处酒精灯 | 将实验Ⅰ的E管冷却后用水冲洗内壁,过滤。取黑色滤渣灼烧;取滤液滴加氯化钡溶液 |
| 现象 | ①钠剧烈燃烧,火焰呈黄色; ②产生大量白烟,同时有黑色物质生成,冷却后有白色固体附着在管壁上 | ①黑色物质可燃; ②滴加氯化钡溶液有白色沉淀生成 |
(2)B中反应一段时间,等E中充满
 后,再点燃E处酒精灯,其目的是
后,再点燃E处酒精灯,其目的是(3)请根据以上现象写出E中发生反应的化学方程式:
您最近一年使用:0次



