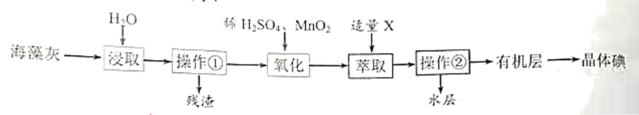
(1)操作①为
(2)氧化时发生反应的离子方程式为
(3)试剂X可以选择
A.酒精 B.四氯化碳 C.盐酸 D.苯
(4)实验室进行操作②需要的玻璃仪器有烧杯、玻璃棒和
相似题推荐
I.实验室制备NH4ReO4的装置如图所示。
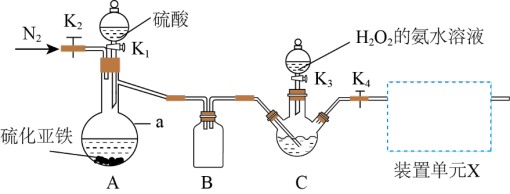
已知:(1)Re2O7易溶于水,溶于水后生成HReO4;HReO4与H2S反应生成Re2S7;
(2)2NH4ReO4
 2NH3↑+H2O+Re2O7
2NH3↑+H2O+Re2O7回答下列问题:
(1)仪器a的名称是
(2)反应开始前先向C中三颈烧瓶内加入一定量的Re2O7和水。关闭K2、K3,打开K1、K4,三颈烧瓶内生成Re2S7。关闭K1,打开K2通入N2一段时间,通入N2的目的是
(3)下列装置可用作装置单元X的是
A. | B. |
C. | D. |
II.NH4ReO4的纯度测定[M(NH4ReO4)268g/mol]
称取wgNH4ReO4样品,加适量水溶解,注入三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用VmLc1mol•L-1的盐酸标准溶液吸收,蒸氨结束后取下接收瓶。取吸收液用c2mol•L-1NaOH(稀)标准溶液滴定过剩的HCl,达到终点时消耗V2mLNaOH溶液。
(4)实验所用的NaOH标准溶液,通常采用间接法配制,即配成近似浓度的溶液,再用基准物标定。不能采用直接法配制的原因是
(5)样品中NH4ReO4的质量分数为
III.高纯度铼的制取
(6)高温下用H2还原NH4ReO4可制得金属铼,装置如图所示:

①装置B中盛放的试剂为
②玻璃管内发生反应的化学方程式为
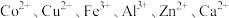 等金属阳离子)中提取钴并制得
等金属阳离子)中提取钴并制得 的工艺流程如下:
的工艺流程如下: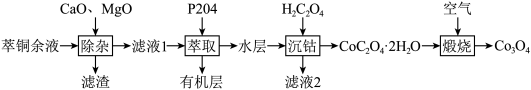
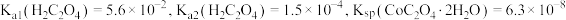 。相关金属离子
。相关金属离子 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 7.4 | 4.7 | 1.5 | 3.4 | 8.9 | 6.2 |
沉淀完全 的 的 | 9.4 | 6.7 | 2.8 | 4.7 | 10.9 | 8.2 |
(1)
 的价电子排布图为
的价电子排布图为(2)“除杂”时,将
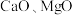 按一定比例同时加入萃铜余液中,调节溶液
按一定比例同时加入萃铜余液中,调节溶液 ,充分反应后过滤。
,充分反应后过滤。①滤渣的主要成分是
②
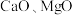 加入量过大时,钴的损耗增大,其原因是
加入量过大时,钴的损耗增大,其原因是(3)“萃取”时,用硫酸调节溶液的
 至2.5左右,加入萃取剂
至2.5左右,加入萃取剂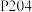 ,发生萃取反应:
,发生萃取反应: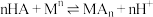 (其中HA为萃取剂P204,
(其中HA为萃取剂P204, 为金属离子)。萃取剂P204在不同
为金属离子)。萃取剂P204在不同 下对金属离子萃取率的影响如图所示。
下对金属离子萃取率的影响如图所示。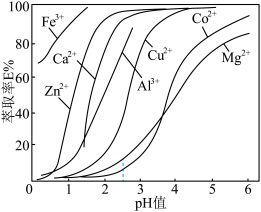
②往“萃取”所得有机层中加入
 ”或“
”或“ ”),可将其中金属离子反萃取至水中。反萃取后,有机萃取剂可循环使用。
”),可将其中金属离子反萃取至水中。反萃取后,有机萃取剂可循环使用。(4)“沉钴”时,往萃余液中加入
 ,调节溶液
,调节溶液 ,过滤得到
,过滤得到 沉淀。当
沉淀。当 恰好沉淀完全时,溶液中
恰好沉淀完全时,溶液中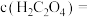
 。
。(5)“煅烧”时
 完全转化为
完全转化为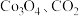 和
和 ,制得
,制得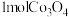 需消耗
需消耗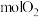 。
。(6)含
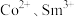 的溶液经电沉积可制备Sm-Co水磁合金,一种Sm-Co水磁合金的六方晶胞结构如图1所示,晶胞中Co原子的投影位置如图2所示。晶胞参数
的溶液经电沉积可制备Sm-Co水磁合金,一种Sm-Co水磁合金的六方晶胞结构如图1所示,晶胞中Co原子的投影位置如图2所示。晶胞参数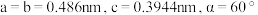 ,
, 。
。
②设
 为阿伏加德罗常数的值,合金最简式的式量为
为阿伏加德罗常数的值,合金最简式的式量为 ,则该合金的密度
,则该合金的密度
 (列出计算式)。
(列出计算式)。
【推荐3】镍、钴及其化合物在工业上应用广泛。从某含镍废渣(含主要成分为NiO、CoO、Co2O3及少量杂质Al2O3)提取碳酸钴、硫酸银的工艺如下:

已知:25℃,Ksp[Co(OH)2]=4.0×10-15,lg2=0.3。
(1)“酸浸”中,Co2O3转化为Co2+的离子方程式为
(2)“沉淀”的主要成分是
(3)“萃取”和“反萃取”可简单表示为:2HX+Ni2+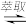 NiX2+2H+。为了将有机层的镍充分“反萃取”得到NiSO4溶液,需要往有机层中加
NiX2+2H+。为了将有机层的镍充分“反萃取”得到NiSO4溶液,需要往有机层中加
(4)“沉钴”反应的离子方程式
(5)某工厂用m1 kg废渣(含钴10%)制备CoCO3,最终得到产品 m2 kg,产率为
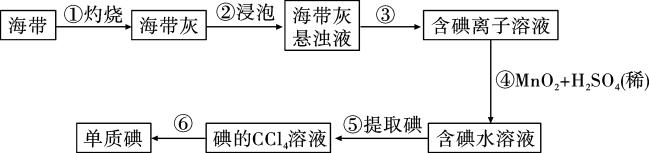
(1)灼烧海带时,除需要三脚架、泥三角和酒精灯外,还需要用到的实验仪器是_______。
| A.烧杯 | B.坩埚 | C.蒸发皿 | D.试管 |
(3)向碘水中加入适量CCl4并振荡,静置后观察到的现象是__________。
| A.形成均匀的无色溶液 | B.形成均匀的紫红色溶液 |
| C.液体分层,下层呈紫红色 | D.液体分层,上层呈紫红色 |
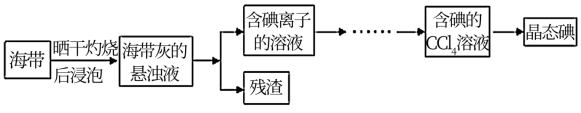
(1)灼烧海带时除需要三脚架、酒精灯、泥三角外,还需要的主要仪器是
(2)为更好的完成实验,灼烧海带时,需加入一定量的氢氧化钠充分混合后再灼烧。此操作目的是
(3)向盛有碘离子溶液中加入CCl4和氯水,
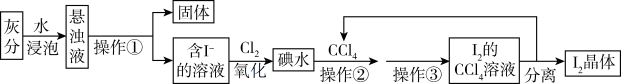
(1)操作①的名称
(2)操作②选用CCl4的理由是_____(填写序号)。
| A.CCl4不溶于水 | B.CCl4的密度比水大 |
| C.碘在CCl4中比在水中溶解度更大 | D.CCl4与碘水不反应 |
碱性条件:
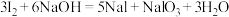 ;
;酸性条件:
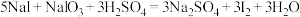 。
。以下是反萃取过程的操作,请填写相关空格:
①向装有I2的CCl4溶液的
②振荡至溶液的
③将含碘的碱溶液从仪器的
④边搅拌边加入几滴1mol⋅L-1H2SO4溶液,溶液立即转为棕黄色,并析出碘晶体。
(4)本实验中可以循环利用的物质是



