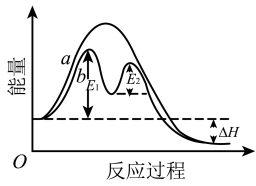
下列说法不正确的是
| A.我们把能够发生化学反应的碰撞叫做有效碰撞 |
| B.活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能 |
| C.当其他条件相同时,反应物浓度增大,单位体积内活化分子数增多,单位时间内有效碰撞的次数增加,化学反应速率增大 |
| D.活化分子之间发生的碰撞一定是有效碰撞 |
更新时间:2021-07-07 16:46:20
|
相似题推荐
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】下列对化学反应速率增大原因的分析,不正确 的是
| A.对有气体参加的反应,减小容器容积使增大压强,单位体积内活化分子数增大 |
| B.向反应体系中加入相同浓度的反应物,使活化分子百分数增大 |
| C.升高温度,使反应物分子中活化分子百分数增大 |
| D.加入适宜的催化剂,使反应物分子中活化分子的数目增大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】已知可逆反应A2(g)+B2(g)⇌2AB(g)的能量变化如图所示,则下列叙述中不正确的是
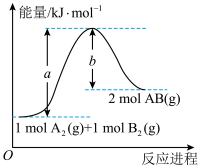
| A.该反应的活化能为akJ⋅mol-1 |
| B.该反应的逆反应的活化能为bkJ⋅mol-1 |
| C.使用催化剂,a的数值减小,△H也减小 |
| D.该反应的ΔH=+(a-b)kJ⋅mol-1 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】在化学反应中,其他条件不变,仅改变下列其中一个条件,能提高活化分子百分数的是
| A.增大反应物浓度 |
| B.增大气体反应的压强(压缩体积) |
| C.加入高效催化剂 |
| D.增大固体反应物的接触面积 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】反应A+B→C分两步进行:①A+B→X(慢反应),②X→C(快反应),反应过程中能量变化如图所示,下列有关叙述正确的是
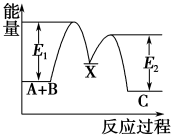
| A.反应A+B→C的ΔH>0 |
| B.X是反应A+B→C的催化剂 |
| C.反应A+B→C的快慢主要取决于反应① |
| D.E2表示反应X→C的活化能 |
您最近一年使用:0次