某兴趣小组用甲苯与干燥氯气在光照下反应制取一氯化苄,并按以下步骤测定所得粗产品的纯度:
I.称取0.255g粗产品,与25 mL 4.00 mol·L-1氢氧化钠水溶液在100 mL圆底烧瓶中混合,加热回流1小时,发生反应: C6H5CH2Cl+ NaOH=C6H5CH2OH+NaCl。
II.将混合液冷至室温,加入25.00 mL 0.1000 mol·L-1硝酸银水溶液。
Ⅲ.用0.1000 mol·L-1NH4SCN水溶液滴定剩余的硝酸银,以硫酸铁铵为指示剂,消耗了6.75 mL,发生反应: NH4SCN+ AgNO3= AgSCN↓+NH4NO3。
下列说法错误的是
A.步骤II存在错误。
B.达滴定终点时,溶液血红色褪去
C.若试剂和操作无误,则粗产品纯度为90.6%
D. 测定结果会高于样品中一氯化苄的实际含量
I.称取0.255g粗产品,与25 mL 4.00 mol·L-1氢氧化钠水溶液在100 mL圆底烧瓶中混合,加热回流1小时,发生反应: C6H5CH2Cl+ NaOH=C6H5CH2OH+NaCl。
II.将混合液冷至室温,加入25.00 mL 0.1000 mol·L-1硝酸银水溶液。
Ⅲ.用0.1000 mol·L-1NH4SCN水溶液滴定剩余的硝酸银,以硫酸铁铵为指示剂,消耗了6.75 mL,发生反应: NH4SCN+ AgNO3= AgSCN↓+NH4NO3。
下列说法错误的是
A.步骤II存在错误。
B.达滴定终点时,溶液血红色褪去
C.若试剂和操作无误,则粗产品纯度为90.6%
D. 测定结果会高于样品中一氯化苄的实际含量
更新时间:2021-07-15 17:48:13
|
相似题推荐
单选题
|
较难
(0.4)
解题方法
【推荐1】常温下,向20ml,浓度均为 的盐酸和醋酸的混合溶液中滴加等物质的量浓度的
的盐酸和醋酸的混合溶液中滴加等物质的量浓度的 溶液,测得混合溶液的电导率与
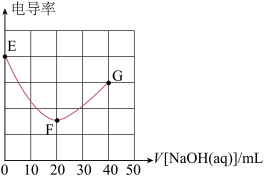
溶液,测得混合溶液的电导率与 溶液体积的关系如图所示。已知:常温下,
溶液体积的关系如图所示。已知:常温下,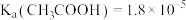 。
。
下列叙述正确的是
 的盐酸和醋酸的混合溶液中滴加等物质的量浓度的
的盐酸和醋酸的混合溶液中滴加等物质的量浓度的 溶液,测得混合溶液的电导率与
溶液,测得混合溶液的电导率与 溶液体积的关系如图所示。已知:常温下,
溶液体积的关系如图所示。已知:常温下,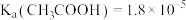 。
。
下列叙述正确的是
| A.E→F→G的过程中,水的电离程度逐渐减小 |
B.F点溶液中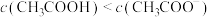 |
C.F点溶液中: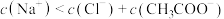 |
D.E点溶液中 约为 约为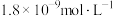 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】25 °C时,用氢氧化钠调节浓度为2.0×10-3mol • L-1的氢氟酸溶液的pH (忽略体积 变化),溶液中c(HF)、c(F- )与pH的变化关系如下图所示。下列说法不正确的是
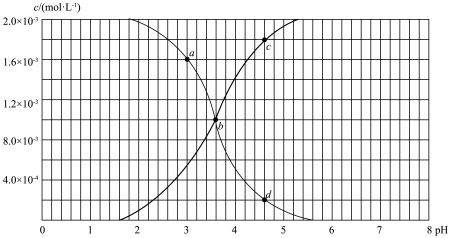

| A.a〜b〜d曲线代表c(F-)随pH的变化 |
| B.25 °C时,HF电离平衡常数的数值Ka=10 -3.6 |
| C.从b点到c点发生的离子反应方程式是:HF + OH- = H2O+ F- |
| D.图中a点溶液粒子浓度大小是:c(HF)>c(H+)>c(F-)>c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】在托盘天平两端的烧杯中加入同浓度同体积的足量盐酸,当向两个烧杯中分别加入0.1mol两种金属充分反应后,而在某一端要再放一个0.2g砝码,天平才能平衡,则这两种金属是
| A.Mg和Al | B.Al和Fe | C.Fe和Cu | D.Na和Mg |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】在常温下,向20 mL浓度均为0.1 mol·L−1的盐酸和氯化铵混合溶液中滴加0.1 mol·L−1的氢氧化钠溶液,溶液pH随氢氧化钠溶液加入体积的变化如图所示(忽略溶液体积变化)。下列说法正确的是


A.V(NaOH)=20 mL时,2n( )+n(NH3·H2O)+n(H+)-n(OH−)=0.1 mol )+n(NH3·H2O)+n(H+)-n(OH−)=0.1 mol |
B.V(NaOH)=40 mL时,c( )<c(OH−) )<c(OH−) |
| C.当0<V(NaOH)<40 mL时,H2O的电离程度一直增大 |
| D.若改用同浓度的氨水滴定原溶液,同样使溶液pH=7时所需氨水的体积比氢氧化钠溶液要小 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】同种离子用不同试剂鉴定,灵敏度不同。已知最低浓度是指在一定条件下, 某鉴定反应能检出离子并能得出肯定结果时该离子的最低浓度。检出限量是指在一定条件下,某鉴定反应所能检出离子的最小质量。限界稀度指最低浓度的倒数。若最低浓度越小,该方法越灵敏。表为两种鉴定K+灵敏度的几种表示方式:
下列说法不正确的是
| 试剂 | 试液体积 | 检出限量 | 最 低浓度 | 限界稀度 | |
| 方法1 | Na3[Co(NO2)6] | 0.03 mL | m | c | 2.5×105 g·mL-1 |
| 方法2 | 酒石酸钠 | 0.05 mL | 0.3μg | 6×10-6 g·mL-1 | G |
| A.m=1.2 μ g | B.c=4 ×10-6 g·mL-1 |
| C.G=1.67 ×105 g·mL-1 | D.方法1更灵敏 |
您最近一年使用:0次


 增大
增大 、
、 、
、 、
、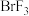 物质中,水解产物中既有酸又有碱的是
物质中,水解产物中既有酸又有碱的是


