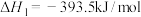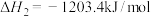(1)已知2molH2完全燃烧生成液态水时放出572kJ热量,则2molH2完全燃烧生成水蒸气时放出热量_______ (填大于、等于或小于)572kJ。
(2)现已知N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化如图所示(E1=1127kJ,E2=1173kJ):
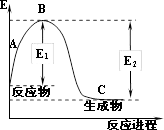
根据以上键能数据计算N—H键的键能为_______ kJ/mol。
(3)N4分子结构为正四面体,与白磷分子相似,如图所示。
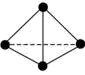
已知N-N键、N≡N键的键能分别为193kJ/mol、940kJ/mol,则1mol N4气体转化为N2时需___ (填“吸收”或“放出”)___ kJ能量。
(2)现已知N2(g)和H2(g)反应生成1molNH3(g)过程中能量变化如图所示(E1=1127kJ,E2=1173kJ):

| 化学键 | H-H | N≡N |
| 键能(kJ/mol) | 436 | 946 |
根据以上键能数据计算N—H键的键能为
(3)N4分子结构为正四面体,与白磷分子相似,如图所示。

已知N-N键、N≡N键的键能分别为193kJ/mol、940kJ/mol,则1mol N4气体转化为N2时需
更新时间:2021-07-29 17:42:24
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】请按要求填空。
(1)以 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
I.
II.
III.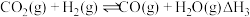
回答下列问题:

_______  。
。
(2)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为_______ 、_______ 。
(3)已知:
I.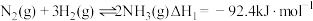
II.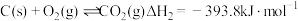
III.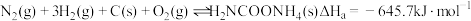
写出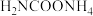 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:_______ 。
(1)以
 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:I.

II.

III.
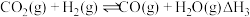
回答下列问题:

 。
。(2)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
热化学硫碘循环水分解制氢系统(I)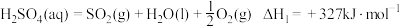 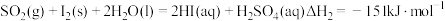 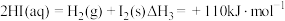 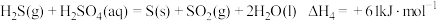 热化学硫碘循环硫化氢分解联产氢气、硫黄系统(IIⅡ) |
通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为
(3)已知:
I.
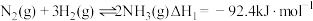
II.
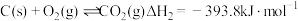
III.
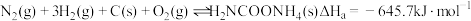
写出
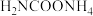 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH1<0 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)=2H2O(g) ΔH4<0 ④
则途径I放出的热量___________ (填“大于”“等于”或“小于”)途径Ⅱ放出的热量;ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是___________ 。
(2)在25℃、101kPa下,2g甲醇完全燃料放热45.36kJ,写出甲醇燃烧热的热化学方程式___________ 。
(3)已知①CO(g)+ O2(g)=CO2(g) ∆H1=-283.0kJ/mol
O2(g)=CO2(g) ∆H1=-283.0kJ/mol
②H2(g)+ O2(g)=H2O(l) ΔH2=-285.8kJ/mol
O2(g)=H2O(l) ΔH2=-285.8kJ/mol
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=___________ 。
(4)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ∆H1=+551kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ∆H3=-297kJ/mol
反应Ⅱ的热化学方程式:___________ 。
(5)火箭和导弹表面的薄层是耐高温物质。制得该物质的热化学方程式为: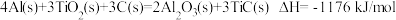 。该反应中每转移1 mol电子放出的热量为
。该反应中每转移1 mol电子放出的热量为___________  。
。
(1)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH1<0 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)=2H2O(g) ΔH4<0 ④
则途径I放出的热量
(2)在25℃、101kPa下,2g甲醇完全燃料放热45.36kJ,写出甲醇燃烧热的热化学方程式
(3)已知①CO(g)+
 O2(g)=CO2(g) ∆H1=-283.0kJ/mol
O2(g)=CO2(g) ∆H1=-283.0kJ/mol②H2(g)+
 O2(g)=H2O(l) ΔH2=-285.8kJ/mol
O2(g)=H2O(l) ΔH2=-285.8kJ/mol③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=-1370kJ/mol
试计算④2CO(g)+4H2(g)=H2O(l)+C2H5OH(l)的ΔH=
(4)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ∆H1=+551kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ∆H3=-297kJ/mol
反应Ⅱ的热化学方程式:
(5)火箭和导弹表面的薄层是耐高温物质。制得该物质的热化学方程式为:
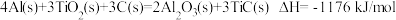 。该反应中每转移1 mol电子放出的热量为
。该反应中每转移1 mol电子放出的热量为 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】宇宙中所有的一切都是能量的变化,研究化学反应中的能量变化意义重大。
(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热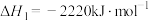 ,正丁烷的燃烧热
,正丁烷的燃烧热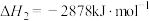 ;异丁烷的燃烧热
;异丁烷的燃烧热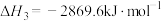 。下列有关说法正确的是
。下列有关说法正确的是_______ (填字母)。
A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(2)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。键能也可以用于估算化学反应的反应热( )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:

已知白磷的燃烧热为2378.0kJ·mol-1,白磷和白磷完全燃烧的产物结构如图所示,则上表中X=___ 。
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
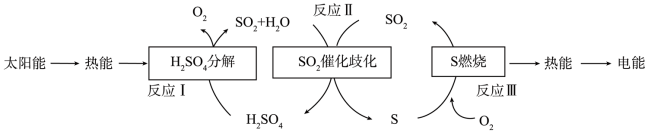
反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g)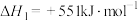
反应III:S(s)+O2(g)=SO2(g)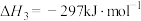
反应II的热化学方程式:_______ 。
(4)热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热( )。如图为VIA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
)。如图为VIA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
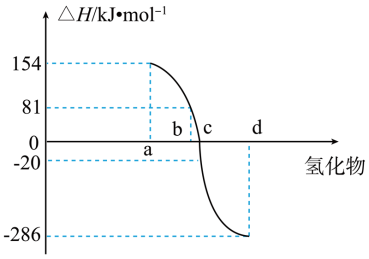
①图中d对应的氢化物是_______ (填化学式),结合元素周期律归纳非金属元素氢化物的稳定性与氢化物的生成热 的关系:
的关系:_______ 。
②硒化氢在上述条件下发生分解反应的热化学方程式为____ 。(沸点:硒化氢-41.3℃;硒684.9℃)
(1)奥运会火炬常用的燃料为丙烷、丁烷等。已知:丙烷的燃烧热
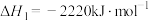 ,正丁烷的燃烧热
,正丁烷的燃烧热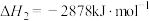 ;异丁烷的燃烧热
;异丁烷的燃烧热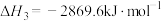 。下列有关说法正确的是
。下列有关说法正确的是A.奥运火炬燃烧时的能量转化形式主要是由化学能转化为热能、光能
B.异丁烷分子中的碳氢键比正丁烷的多
C.正丁烷比异丁烷稳定
(2)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。键能也可以用于估算化学反应的反应热(
 )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ/mol) | 172 | 335 | 498 | X |

已知白磷的燃烧热为2378.0kJ·mol-1,白磷和白磷完全燃烧的产物结构如图所示,则上表中X=
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:

反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g)
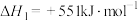
反应III:S(s)+O2(g)=SO2(g)
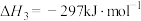
反应II的热化学方程式:
(4)热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(
 )。如图为VIA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
)。如图为VIA族元素(包括氧、硫、硒、碲)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
①图中d对应的氢化物是
 的关系:
的关系:②硒化氢在上述条件下发生分解反应的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】亚硝酸氯(ClNO)可由NO与 在通常条件下反应得到,化学方程式为
在通常条件下反应得到,化学方程式为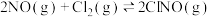
 。
。
已知:几种化学键的键能数据如表所示(亚硝酸氯的结构式为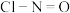 )
)
(1)
___________  。
。
(2)对于反应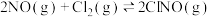
 ,在
,在___________ (填“低温”、“高温”或“任意温度”)下有利该反应自发进行,判断的理由为___________ 。
(3)对于反应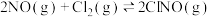
 ,下列说法正确的是
,下列说法正确的是________ (填标号)。
A.反应达到平衡后,仅充入少量 ,
, 将减小
将减小
B.每消耗0.2molNO(g),同时消耗2.24L
C.每断裂0.1molCl-Cl键,同时形成0.2molN-Cl键
(4)在一定温度下,该反应于某一恒容密闭容器中达到平衡,继续通入NO(g)。
①刚通入NO时,正反应速率___________ (填“增大”、“减小”或“不变”)。
②反应重新达到平衡后,该反应的平衡常数将___________ (填“增大”、“减小”或“不变”),判断的理由为___________ 。
 在通常条件下反应得到,化学方程式为
在通常条件下反应得到,化学方程式为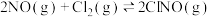
 。
。已知:几种化学键的键能数据如表所示(亚硝酸氯的结构式为
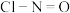 )
)| 化学键 |  | Cl-Cl | Cl-N |  |
键能 | 630 | 243 | 200 | 607 |

 。
。(2)对于反应
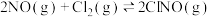
 ,在
,在(3)对于反应
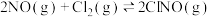
 ,下列说法正确的是
,下列说法正确的是A.反应达到平衡后,仅充入少量
 ,
, 将减小
将减小B.每消耗0.2molNO(g),同时消耗2.24L

C.每断裂0.1molCl-Cl键,同时形成0.2molN-Cl键
(4)在一定温度下,该反应于某一恒容密闭容器中达到平衡,继续通入NO(g)。
①刚通入NO时,正反应速率
②反应重新达到平衡后,该反应的平衡常数将
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于放热反应的是_________ (填字母)。
A.碳与水蒸气反应 B.铝和氧化铁反应 C.CaCO3受热分解 D.氢气还原三氧化钨制取钨 E.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。通常人们把断裂1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
则H2(g)+Cl2(g)=2HCl(g)的反应热ΔH为__________________________
②通过盖斯定律可计算。发射卫星用 作燃料,
作燃料, 作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,写出气体肼和NO2气体反应生成N2和水蒸气的热化学方程式
作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,写出气体肼和NO2气体反应生成N2和水蒸气的热化学方程式___________________________________________________
③利用实验装置测量利用下图图装置测定中和热的实验步骤如下:
回答下列问题:
I.仪器a的名称为______________________________
II.做了四次实验,并将实验数据记录如下:
近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以上数据计算中和热ΔH=_________________ ( 结果保留小数点后一位)。
(1)下列反应中,属于放热反应的是
A.碳与水蒸气反应 B.铝和氧化铁反应 C.CaCO3受热分解 D.氢气还原三氧化钨制取钨 E.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。通常人们把断裂1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ·mol-1) | 436 | 243 | 431 |
②通过盖斯定律可计算。发射卫星用
 作燃料,
作燃料, 作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,写出气体肼和NO2气体反应生成N2和水蒸气的热化学方程式
作氧化剂,两者反应生成N2和水蒸气,已知:N2(g) +2O2(g)= 2NO2(g)△H1 =+67.7kJ/mol;N2H4(g)+O2(g)= N2(g)+2H2O(g) △H2=-534kJ/mol,写出气体肼和NO2气体反应生成N2和水蒸气的热化学方程式③利用实验装置测量利用下图图装置测定中和热的实验步骤如下:
 | ①用量筒量取0.25mol/L的硫酸50mL倒入小烧杯中,测出硫酸溶液温度; ②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用同一温度计测出其温度; ③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。 |
I.仪器a的名称为
II.做了四次实验,并将实验数据记录如下:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 |
您最近一年使用:0次