天然氟矿主要有萤石、氟磷灰石等。由萤石矿制F2的方法是先用浓硫酸与萤石反应,生成HF,在HF中加入KF,再电解得F2。
(1)由萤石矿制F2的主要化学反应的方程式:①_______ ②_______ ;
(2)之所以用硫酸而不用盐酸与萤石反应的理由是_______ ;
(3)在制取过程中加入KF的作用是_______ ;
(4)F-对人体的危害是很严重的。人体中若含有过多的F-,F-会与人体内一种重要的金属阳离子形成难溶物,而带给人体严重的伤害和痛苦。这种阳离子是:_______ 。
(1)由萤石矿制F2的主要化学反应的方程式:①
(2)之所以用硫酸而不用盐酸与萤石反应的理由是
(3)在制取过程中加入KF的作用是
(4)F-对人体的危害是很严重的。人体中若含有过多的F-,F-会与人体内一种重要的金属阳离子形成难溶物,而带给人体严重的伤害和痛苦。这种阳离子是:
2007高二·安徽·竞赛 查看更多[1]
更新时间:2021-08-07 16:22:38
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】按要求填空
(1)常温下,已知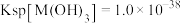 ,要使溶液中的
,要使溶液中的 降至
降至 ,则应调节溶液
,则应调节溶液
___________ 。
(2)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为1.0×10-38、1.0×10-11,浓度均为0.1mol·L-1的FeCl3、MgCl2的混合溶液中。要使Fe3+完全沉淀(离子浓度小于1.0×10-5)而Mg2+不沉淀,应该调节溶液pH的范围是___________ ,调节pH应选用的试剂是___________ 。(填化学式)。
(1)常温下,已知
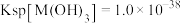 ,要使溶液中的
,要使溶液中的 降至
降至 ,则应调节溶液
,则应调节溶液
(2)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为1.0×10-38、1.0×10-11,浓度均为0.1mol·L-1的FeCl3、MgCl2的混合溶液中。要使Fe3+完全沉淀(离子浓度小于1.0×10-5)而Mg2+不沉淀,应该调节溶液pH的范围是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.请根据所学知识的回答:
(1)A为0.1mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________________
(2)B为0.1mol/LNaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示):____________ ;___________ ;__________ 。
实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:________________
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入________________ 目的是_____________ ;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为_________________ .
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
AgCl(s) Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25℃时,氯化银的Ksp=1.8×10-10mol2/L2.现将足量氯化银分别放入:
① 100mL蒸馏水中;
② 100mL 0.2mol/LAgNO3溶液中;
③ 100mL 0.1mol/L氯化铝溶液中;
④ 100mL 0.1mol/L盐酸溶液中.充分搅拌后,相同温度下银离子浓度由大到小的顺序_____________ (填写序号);②中氯离子的浓度为_________ mol/L,③中银离子的浓度为______ mol/L
(1)A为0.1mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
(2)B为0.1mol/LNaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示):
实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:
AgCl(s)
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)在25℃时,氯化银的Ksp=1.8×10-10mol2/L2.现将足量氯化银分别放入:
① 100mL蒸馏水中;
② 100mL 0.2mol/LAgNO3溶液中;
③ 100mL 0.1mol/L氯化铝溶液中;
④ 100mL 0.1mol/L盐酸溶液中.充分搅拌后,相同温度下银离子浓度由大到小的顺序
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】磷酸铝(AlPO4)是一种用途广泛的材料,可在玻璃生产过程中充当助熔剂,作陶瓷或牙齿的黏合剂等。以磷硅渣[主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等]为原料制备磷酸铝的工艺流程如图所示,回答下列问题:

在物质的量浓度分别为0.01mol/L的CaCl2和AlCl3的混合溶液中加入等体积的Na3PO4溶液,若Al3+恰好沉淀完全,即溶液中c(Al3+)=1.0×10-5mol/L,此时AlPO4沉淀中___________ (填“是”或“否”)混有Ca3(PO4)2。[已知AlPO4、Ca3(PO4)2的Ksp分别为6.3×10-19、2.0×10-29]

在物质的量浓度分别为0.01mol/L的CaCl2和AlCl3的混合溶液中加入等体积的Na3PO4溶液,若Al3+恰好沉淀完全,即溶液中c(Al3+)=1.0×10-5mol/L,此时AlPO4沉淀中
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是______ 。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。

①该电池的总反应化学方程式为______ ;
②电池中NaCl的作用是______ 。
③以铝-空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为______ 。
④某铝-空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为______ 。
(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为______ 。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式______ 。
(1)铝元素在元素周期表中的位置是
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。

①该电池的总反应化学方程式为
②电池中NaCl的作用是
③以铝-空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为
④某铝-空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为
(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。

(1)当有1molNa+通过阳离子交换膜时,a极生成气体_______ L(标准状况),阳极的电极反应式是_______ 。
(2)稀NaOH溶液的作用是_______ ,B处流出较浓的NaOH溶液,C处流出的是_______ 。
(3)在标准状况下,若用甲烷-空气燃料电池做电源,处理含SO2 20%(体积分数)的废气40m3,理论上需要消耗甲烷_______ m3

(1)当有1molNa+通过阳离子交换膜时,a极生成气体
(2)稀NaOH溶液的作用是
(3)在标准状况下,若用甲烷-空气燃料电池做电源,处理含SO2 20%(体积分数)的废气40m3,理论上需要消耗甲烷
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】Na2[Fe(CN)5(NO)]的磁矩为零, 给出铁原子的氧化态___________ 。N2[Fe(CN)5(NO)]是鉴定 S2-的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。___________
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】现有Fe、Cu组成的合金,其总物质的量为amol,Cu的物质的量分数为x;研成粉末后,全部投入含bmolHNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)若剩余的残渣只有Cu,则溶液中含有的金属离子为(写出所有可能情况)_______
(2)当溶液中金属离子只有Fe2+、Cu2+时,求b的取值范围(用含a、x的式子表示)_______
(3)当x=0.5,且溶液中Fe3+与Fe2+的物质的量相等时,在标准状况下共产生672mL气体,求a、b的值_______
(1)若剩余的残渣只有Cu,则溶液中含有的金属离子为(写出所有可能情况)
(2)当溶液中金属离子只有Fe2+、Cu2+时,求b的取值范围(用含a、x的式子表示)
(3)当x=0.5,且溶液中Fe3+与Fe2+的物质的量相等时,在标准状况下共产生672mL气体,求a、b的值
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】铂系金属是最重要的工业催化剂。但其储藏已几近枯竭,上小行星去开采还纯属科学幻想。研究证实,有一类共价化合物可代替铂系金属催化剂。它们是坚硬的固体,熔点极高,高温下不分解,被称为“千禧催化剂”(millenniumcatalysts),下面3种方法都可以合成它们:
①在高温下将烃类气体通过钨或钼的氧化物的表面。
②高温分解钨或钼的有机金属化合物(即:钨或钼与烃或烃的卤代物形成的配合物)。
③在高度分散的碳表面上通过高温气态钨或钼的氧化物。
(1)合成的化合物的中文名称是_______ 和_______ 。
(2)为解释这类化合物为什么能代替铂系金属,提出了一种电子理论,认为这些化合物是金属原子与非金属原子结合的原子晶体,金属原子周围的价电子数等于同周期的铂原子或钌原子的价电子数。这类化合物的化学式(即最简式或实验式)是_______ 和_______ 。
①在高温下将烃类气体通过钨或钼的氧化物的表面。
②高温分解钨或钼的有机金属化合物(即:钨或钼与烃或烃的卤代物形成的配合物)。
③在高度分散的碳表面上通过高温气态钨或钼的氧化物。
(1)合成的化合物的中文名称是
(2)为解释这类化合物为什么能代替铂系金属,提出了一种电子理论,认为这些化合物是金属原子与非金属原子结合的原子晶体,金属原子周围的价电子数等于同周期的铂原子或钌原子的价电子数。这类化合物的化学式(即最简式或实验式)是
您最近一年使用:0次




