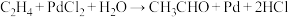在25℃和101kPa条件下,断开1molH2(g)中的化学键要吸收436kJ的能量,断开1molCl2(g)中的化学键要吸收243kJ的能量,形成2molHCl(g)中的化学键要释放862kJ的能量。下列说法正确的是


| A.H(g)和Cl(g)形成HCl(g)的过程要吸收能量 |
| B.等质量的HCl(l)与HCl(g)具有相同的能量 |
| C.H2(g)+Cl2(g)=2HCl(g)的能量关系可用如图表示 |
| D.在H2和Cl2的反应过程中,断开化学键吸收的总能量大于形成化学键释放的总能量 |
更新时间:2021/08/07 21:37:21
|
相似题推荐
【推荐1】已知乙炔与苯蒸气完全燃烧的热化学方程式如下所示:
①2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+2600kJ
②2C6H6(g)+15O2(g)→12CO2(g)+6H2O(l)+6590kJ
下列说法正确的是
①2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+2600kJ
②2C6H6(g)+15O2(g)→12CO2(g)+6H2O(l)+6590kJ
下列说法正确的是
| A.2mol C2H2(g) 完全燃烧生成气态水时放热大于2600kJ |
| B.2mol C6H6(l) 完全燃烧生成液态水时放热大于6590kJ |
| C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多 |
| D.C2H2(g) 三聚生成C6H6(g) 的过程属于放热反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述错误 的是


| A.过程I中产生的FeO是还原产物 |
| B.过程I中分离出O2,可提高Fe3O4的转化率 |
| C.过程II中每转移NA个电子,生成11.2L H2 |
| D.铁氧化合物循环制H2具有节约能源、产物易分离等优点 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
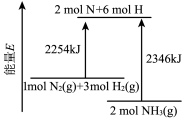
【推荐1】肼(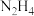 )在不同条件下的分解产物不同,200℃时在Cu表面分解的机理如图1所示。已知200℃时,反应Ⅰ:
)在不同条件下的分解产物不同,200℃时在Cu表面分解的机理如图1所示。已知200℃时,反应Ⅰ: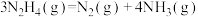
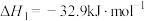 ,反应Ⅱ:
,反应Ⅱ:
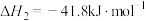 ,下列说法不正确的是。
,下列说法不正确的是。
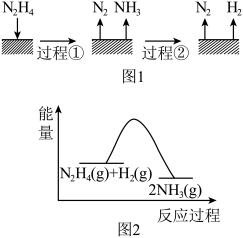
 )在不同条件下的分解产物不同,200℃时在Cu表面分解的机理如图1所示。已知200℃时,反应Ⅰ:
)在不同条件下的分解产物不同,200℃时在Cu表面分解的机理如图1所示。已知200℃时,反应Ⅰ: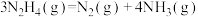
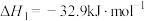 ,反应Ⅱ:
,反应Ⅱ:
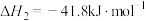 ,下列说法不正确的是。
,下列说法不正确的是。
| A.图1所示过程①②都是放热反应 |
| B.反应Ⅱ的能量过程示意图如图2所示 |
C.断开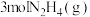 中的化学键吸收的能量小于形成 中的化学键吸收的能量小于形成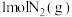 和 和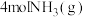 中的化学键释放的能量 中的化学键释放的能量 |
D.200℃时,肼分解生成氮气和氢气的热化学方程式为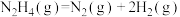 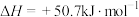 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法正确的是
| A.NO与空气中的氧气反应生成NO2属于氮的固定 |
| B.需要加热才能发生的反应都是吸热反应 |
| C.断开1mol C-H键要放出一定的能量 |
| D.液氨汽化时需要吸收大量的热,可用作制冷剂 |
您最近一年使用:0次
【推荐1】某反应的反应过程中能量变化如图所示。下列叙述不正确的是( )
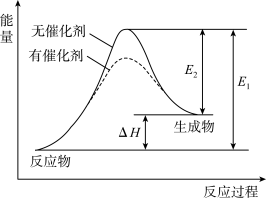

| A.该反应的能量变化与氯化铵晶体和氢氧化钡晶体反应相同 |
| B.该反应的△H=E1-E2 |
| C.若生成物中某一物质由气态变成液态,则该反应的△H变大 |
| D.加催化剂不能改变反应的△H,但可以加快反应速率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】 金属钠和
金属钠和 氯气反应的能量关系如图所示,下列说法错误的是
氯气反应的能量关系如图所示,下列说法错误的是
 金属钠和
金属钠和 氯气反应的能量关系如图所示,下列说法错误的是
氯气反应的能量关系如图所示,下列说法错误的是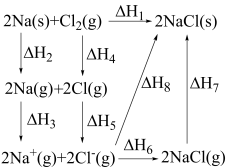
A.相同条件下,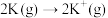 的 的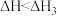 | B.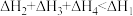 |
C. 的数值与 的数值与 键键能的数值相等 键键能的数值相等 | D.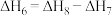 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】已知共价键的键能与热化学方程式等信息如下表:
已知乙烷的标准燃烧热为-1560kJ·mol-1。则H-O的键能为
| 共价键 | C-H | O=O | C-C | C=O |
| 键能/(kJ/mol) | 413 | 498 | 331 | 799 |
| 热化学方程式 | H2O(l)= H2O(g)ΔH=+44kJ·mol-1 | |||
| A.464kJ/mol | B.-464kJ/mol | C.486kJ/mol | D.-486kJ/mol |
您最近一年使用:0次
单选题-单题
|
适中
(0.65)
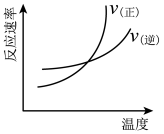
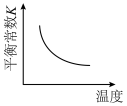
【推荐2】合成氨反应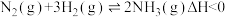 ,下列图示与对应叙述相符合的是
,下列图示与对应叙述相符合的是
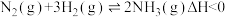 ,下列图示与对应叙述相符合的是
,下列图示与对应叙述相符合的是
|
|
A. | B. 达到平衡时 的转化率随 的转化率随 比值的变化 比值的变化 |
|
|
| C. 正、逆反应速率随温度的变化 | D. 该反应平衡常数随温度的变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】HBr被 氧化依次由如下Ⅰ、Ⅱ、Ⅲ三步反应组成:
氧化依次由如下Ⅰ、Ⅱ、Ⅲ三步反应组成:
Ⅰ.HBr(g)+O2(g)=HOOBr(g);
Ⅱ.HOOBr(g)+HBr(g)=2HOBr(g);
Ⅲ.HOBr(g)+HBr(g)=H2O(g)+Br2(g)
1mol HBr(g)被氧化为 (g)放出
(g)放出 热量,其能量与反应进程的关系如图所示:
热量,其能量与反应进程的关系如图所示:
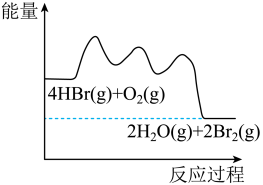
下列说法正确的是

 氧化依次由如下Ⅰ、Ⅱ、Ⅲ三步反应组成:
氧化依次由如下Ⅰ、Ⅱ、Ⅲ三步反应组成:Ⅰ.HBr(g)+O2(g)=HOOBr(g);
Ⅱ.HOOBr(g)+HBr(g)=2HOBr(g);
Ⅲ.HOBr(g)+HBr(g)=H2O(g)+Br2(g)
1mol HBr(g)被氧化为
 (g)放出
(g)放出 热量,其能量与反应进程的关系如图所示:
热量,其能量与反应进程的关系如图所示:
下列说法正确的是


| A.反应Ⅰ、Ⅱ、Ⅲ均为放热反应 |
| B.Ⅰ的反应速率最慢 |
C.HOOBr比HBr和 稳定 稳定 |
D.热化学方程式为:4HBr(g)+O2(g)=2H2O(g)+2Br2(g) 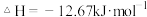 |
您最近一年使用:0次

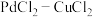 溶液中乙烯能较快地直接被氧化成乙醛。其历程如图所示。
溶液中乙烯能较快地直接被氧化成乙醛。其历程如图所示。