判断
(1)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小____________
(2)第二周期元素从左到右,最高正价从+1递增到+7____________
(3)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强____________
(4)元素的氧化物对应的水化物酸性越强,非金属性越强;碱性越强,金属性越强____________
(5)已知Ra是第7周期ⅡA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强____________
(6)已知As是第4周期ⅤA族的元素,故AsH3的稳定性比NH3的稳定性弱____________
(7)已知Cs的原子半径比Na的原子半径大,故Cs与水反应比Na与水反应更剧烈____________
(8)已知Cl的非金属性比S的强,故HClO的酸性比H2SO3的强____________
(9)第ⅠA族与第ⅦA族元素间可形成共价化合物或离子化合物____________
(10)第二周期元素从左到右,最高正价从+1递增到+7____________
(11)同主族元素的简单阴离子还原性越强,水解程度越大____________
(12)同周期金属元素的化合价越高,其原子失电子能力越强____________
(13)由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>F____________
(14)人们可以在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料____________
(15)短周期元素正化合价数值和其族序数相同____________
(16)短周期元素形成的微粒X2-和Y2+核外电子排布相同,离子半径:X2->Y2+____________
(1)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小
(2)第二周期元素从左到右,最高正价从+1递增到+7
(3)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强
(4)元素的氧化物对应的水化物酸性越强,非金属性越强;碱性越强,金属性越强
(5)已知Ra是第7周期ⅡA族的元素,故Ra(OH)2的碱性比Mg(OH)2的碱性强
(6)已知As是第4周期ⅤA族的元素,故AsH3的稳定性比NH3的稳定性弱
(7)已知Cs的原子半径比Na的原子半径大,故Cs与水反应比Na与水反应更剧烈
(8)已知Cl的非金属性比S的强,故HClO的酸性比H2SO3的强
(9)第ⅠA族与第ⅦA族元素间可形成共价化合物或离子化合物
(10)第二周期元素从左到右,最高正价从+1递增到+7
(11)同主族元素的简单阴离子还原性越强,水解程度越大
(12)同周期金属元素的化合价越高,其原子失电子能力越强
(13)由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>F
(14)人们可以在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料
(15)短周期元素正化合价数值和其族序数相同
(16)短周期元素形成的微粒X2-和Y2+核外电子排布相同,离子半径:X2->Y2+
2021高三·全国·专题练习 查看更多[2]
更新时间:2021-08-08 21:00:44
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
【推荐1】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。如表列出了九种主族元素在元素周期表中的位置,回答下列问题(用元素符号表示):
(1)元素B的一种同位素可用于考古时测定一些文物的年代。写出该核素的符号___________ 。元素A与元素C可以形成一种常见绿色氧化剂Y,Y在酸性条件下可将亚铁盐氧化为三价铁盐,请写出该反应的离子方程式___________ 。
(2)元素F的单质与E的最高价氧化物对应的水化物反应的化学方程式是___________ 。
(3)用电子式表示化合物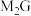 的形成过程
的形成过程___________ 。
(4)C、D、E、F的简单离子半径由大到小的顺序为___________ (填离子符号)。
(5)元素G与元素H相比,非金属性较强的是___________ (用元素符号表示),下列表述中能证明这一事实的是___________ (填字母序号)。
a.最高价氧化物对应的水化物的酸性G比H的强
b.最高化合价H比G的高
c.H的单质能从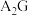 溶液中置换出G的单质
溶液中置换出G的单质
d.气态氢化物的稳定性H强于G
e.气态氢化物水溶液的酸性H强于G
| A | |||||||||||||||||
| B | C | D | |||||||||||||||
| E | F | G | H | ||||||||||||||
| M | |||||||||||||||||
(2)元素F的单质与E的最高价氧化物对应的水化物反应的化学方程式是
(3)用电子式表示化合物
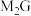 的形成过程
的形成过程(4)C、D、E、F的简单离子半径由大到小的顺序为
(5)元素G与元素H相比,非金属性较强的是
a.最高价氧化物对应的水化物的酸性G比H的强
b.最高化合价H比G的高
c.H的单质能从
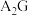 溶液中置换出G的单质
溶液中置换出G的单质d.气态氢化物的稳定性H强于G
e.气态氢化物水溶液的酸性H强于G
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是5种元素的相关信息,W、X都位于第三周期。
(1)W的最高价氧化物对应的水化物的化学式是_______ 。
(2)元素W和X可以形成化合物WX,是_______ (填“离子”“共价”)化合物。
(3)比较W、X、Y的离子半径大小_______ (用离子符号表示)。
(4)X单质与水反应的离子方程式是_______ 。
(5)比较X和Y最高价氧化物的水化物的碱性_______ (用化学式表示);比较W和Z离子的还原性:_______ (用离子符号表示)。
(6)下列对于Z及其化合物的推断中,正确的是_______ (填字母)。
A.Z的最低负化合价与W的最低负化合价相同
B.Z的氢化物的稳定性弱于W的氢化物的稳定性
C.Z的单质可与X和W形成的化合物的水溶液发生置换反应
| 元素 | 信息 |
| W | 最高化合价为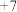 价 价 |
| X | 最高价氧化物对应的水化物在其所在周期中碱性最强 |
| Y | 焰色试验(透过蓝色钴玻璃观察)火焰呈紫色 |
| Z | 原子结构示意图为: |
(2)元素W和X可以形成化合物WX,是
(3)比较W、X、Y的离子半径大小
(4)X单质与水反应的离子方程式是
(5)比较X和Y最高价氧化物的水化物的碱性
(6)下列对于Z及其化合物的推断中,正确的是
A.Z的最低负化合价与W的最低负化合价相同
B.Z的氢化物的稳定性弱于W的氢化物的稳定性
C.Z的单质可与X和W形成的化合物的水溶液发生置换反应
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】有以下6种元素,其中R、W、X、Y、M是原子序数依次增大的五种短周期元素,R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2.工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与X是同一主族的元素,且在元素周期表中与X相邻。Q是第4周期第Ⅷ族元素,它的一种复杂的化合物是具有磁性的黑色晶体。
(1)若R的一种原子中质子数和中子数相等,则R的原子组成符号为___________ ;R2Y、R2X都属于___________ (填“离子”或“共价”)化合物。W在元素周期表中的位置___________ 。
(2)M是生活中常见的一种元素,它能与很多元素形成化合物。
①用电子式表示RM的形成过程___________ 。
②如图所示,将M单质水溶液滴入试管中。试管中的实验现象为___________ 。___________ 。
③MX2是一种高效消毒剂,工业上用其处理中性废水中的锰,使 转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为
转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为___________ 。
(3)元素硒(Se)的原子结构示意图为
根据元素周期律,下列推断正确的是___________ (填字母序号)
a.Se位于第4周期、与Y同主族 b.Se的最低负化合价为-2价
c.SeO2具有还原性 d.H2Se的还原性比H2Y强
e.H2SeO3的酸性强于H2SO4 f.SeO2在一定条件下可与NaOH溶液反应
(4)下列事实能判断元素金属性强弱的是___________ (填字母)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(1)若R的一种原子中质子数和中子数相等,则R的原子组成符号为
(2)M是生活中常见的一种元素,它能与很多元素形成化合物。
①用电子式表示RM的形成过程
②如图所示,将M单质水溶液滴入试管中。试管中的实验现象为

③MX2是一种高效消毒剂,工业上用其处理中性废水中的锰,使
 转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为
转化为MnO2沉淀除去,M被还原至最低价,该反应的离子方程式为(3)元素硒(Se)的原子结构示意图为

根据元素周期律,下列推断正确的是
a.Se位于第4周期、与Y同主族 b.Se的最低负化合价为-2价
c.SeO2具有还原性 d.H2Se的还原性比H2Y强
e.H2SeO3的酸性强于H2SO4 f.SeO2在一定条件下可与NaOH溶液反应
(4)下列事实能判断元素金属性强弱的是
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:

(1)地壳中含量最高的金属元素是_______ (填标号);化学性质最不活泼的元素是_______ (填元素符号)。
(2)A分别与G、H、I形成的最简单化合物中,稳定性最强的是_______ (填化学式)。
(3)B、C、E、H四种元素对应的简单离子半径由大到小的顺序是_______ (用离子符号表示)。
(4)B、C形成的最高价氧化物对应水化物的碱性从强到弱的顺序为_______ (填化学式)。
(5)写出J在周期表中的位置_______ 。
(6)请写出B、E的最高价氧化物对应的水化物发生反应的化学方程式:_______ 。

(1)地壳中含量最高的金属元素是
(2)A分别与G、H、I形成的最简单化合物中,稳定性最强的是
(3)B、C、E、H四种元素对应的简单离子半径由大到小的顺序是
(4)B、C形成的最高价氧化物对应水化物的碱性从强到弱的顺序为
(5)写出J在周期表中的位置
(6)请写出B、E的最高价氧化物对应的水化物发生反应的化学方程式:
您最近一年使用:0次
【推荐2】已知A、B、C、D、E、F、G、H为原子序数依次增大的前36号元素,A的一种同位素原子无中子;B元素基态原子的核外电子数是其能级数的2倍,且含有未成对的电子;D的基态原子2p轨道中含有两种不同自旋方向的电子,且电子数之比为3∶1;E为周期表中电负性最强的元素;F、H与D元素同主族;G为第四周期元素,其+1价阳离子的核外电子排布式为[Ar]3d10。回答下列问题(用元素符号或化学式表示):
(1)G在元素周期表中位于_______ 区。
(2)B、C、F的原子半径由大到小的顺序为_______ (填元素符号)。
(3)C、D、E的第一电离能由大到小排序是_______ (填元素符号)。
(4)从分子结构与性质角度分析 气体易溶于水的原因是
气体易溶于水的原因是_______ ,_______ 。
(5)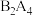 分子为平面结构(键角均为120°),其中B原子的杂化方式是
分子为平面结构(键角均为120°),其中B原子的杂化方式是_______ 。
(6)由A、B、D三种元素形成的餐桌上常见的化合物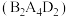 ,一个该分子中含
,一个该分子中含_______ 个 键,该分子中所含的化学键的类型为
键,该分子中所含的化学键的类型为_______ (填序号)。
A.离子键 B.极性共价键 C.非极性共价键
(7)D的简单氢化物与H的简单氢化物结构相似,常压下沸点分别为100℃和-41℃,造成二者沸点差异的原因为_______ 。
(1)G在元素周期表中位于
(2)B、C、F的原子半径由大到小的顺序为
(3)C、D、E的第一电离能由大到小排序是
(4)从分子结构与性质角度分析
 气体易溶于水的原因是
气体易溶于水的原因是(5)
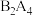 分子为平面结构(键角均为120°),其中B原子的杂化方式是
分子为平面结构(键角均为120°),其中B原子的杂化方式是(6)由A、B、D三种元素形成的餐桌上常见的化合物
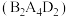 ,一个该分子中含
,一个该分子中含 键,该分子中所含的化学键的类型为
键,该分子中所含的化学键的类型为A.离子键 B.极性共价键 C.非极性共价键
(7)D的简单氢化物与H的简单氢化物结构相似,常压下沸点分别为100℃和-41℃,造成二者沸点差异的原因为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取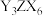 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓( )的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a、Ga位于元素周期表第四周期IVA族
b、Ga为门捷列夫预言的“类铝”
c、Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d、酸性: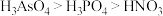
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取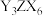 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(
 )的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a、Ga位于元素周期表第四周期IVA族
b、Ga为门捷列夫预言的“类铝”
c、Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d、酸性:
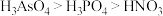
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为___________ 。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)___________ 。
(3)YX4M的电子式为___________ ,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为____________________ 。
(4)X、Z两元素形成的原子个数比为1:1的化合物中含有的化学键类型为__________ 。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为________________ 。
(1)R在元素周期表中的位置为
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)
(3)YX4M的电子式为
(4)X、Z两元素形成的原子个数比为1:1的化合物中含有的化学键类型为
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】X、Y、Z、W、E是原子序数依次增大的前四周期元素,结合表中所给信息,请回答下列问题。
(1)Z、W形成的简单离子半径___________ >___________ (用离子符号表示)。
(2)Y、Z对应简单气态氢化物的稳定性强的是___________ (用化学式表示),该氢化物由固态变为气态克服的微粒间作用力有___________ 。
(3)Z基态原子中能量最高的电子占据的原子轨道呈___________ 形。
(4)检验E元素常用的方法___________ ,请用原子结构的知识解释该方法的原理:___________ 。
(5)X、Y组成的化合物R是合成烈性炸药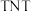 的原料,写出该反应的化学方程式
的原料,写出该反应的化学方程式___________ 。
| 原子 | 特征 |
| X | 元素的核电荷数和电子层数相等 |
| Y | 原子中有三个能级,且各能级电子数相等 |
| Z | 原子最外层有两个未成对电子 |
| W | 在同周期主族元素原子中半径最大 |
| E | 和W形成的合金可做原子反应堆的导热剂 |
(2)Y、Z对应简单气态氢化物的稳定性强的是
(3)Z基态原子中能量最高的电子占据的原子轨道呈
(4)检验E元素常用的方法
(5)X、Y组成的化合物R是合成烈性炸药
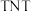 的原料,写出该反应的化学方程式
的原料,写出该反应的化学方程式
您最近一年使用:0次
【推荐3】X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如下表:
请用化学用语填空:
(1)X元素位于元素周期表第___________ 周期___________ 族; R是___________ 区的元素。
(2)请写出Q元素基态原子的外围电子排布图:___________ 。
(3)X、Y、Z、M四种元素的原子半径由小到大的顺序是___________ (用元素符号表示)。
(4)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是___________ 。
(5)与M元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:___________ ;已知T元素和Q元素的电负性分别为1.5和3.0,则它们形成的化合物是___________ (填“离子化合物”或“共价化合物”)。
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期元素中最大 |
| M | 逐级电离能(kJ·mol-1)依次为 578、1 817、2 745、11 575、14 830、18 376 |
| Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
(1)X元素位于元素周期表第
(2)请写出Q元素基态原子的外围电子排布图:
(3)X、Y、Z、M四种元素的原子半径由小到大的顺序是
(4)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是
(5)与M元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物的水化物反应的化学方程式:
您最近一年使用:0次



