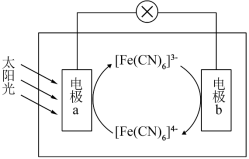
Ⅰ.某研究性学习小组,为了探究电极与原电池的电解质之间关系,设计了下列实验方案:用铝片、铜片、镁片作电极,分别与下列溶液构成原电池,并接电流表。
(1)若电解质溶液为0.5mol/L硫酸,电极为铜片和铝片,铝片上的电极的反应式为___________ 。
(2)若用浓硝酸作电解质溶液,电极为铜片和铝片,铝片为___________ 极(填“正”或“负”)。正极上发生的电极反应式为___________ 。
(3)若电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片,则正极发生的电极反应为_____ 。
Ⅱ.肼( )又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
(4)肼-空气燃料电池放电时:正极的电极反应式是___________ 。
(1)若电解质溶液为0.5mol/L硫酸,电极为铜片和铝片,铝片上的电极的反应式为
(2)若用浓硝酸作电解质溶液,电极为铜片和铝片,铝片为
(3)若电解质溶液为0.5mol/L氢氧化钠溶液,电极为镁片和铝片,则正极发生的电极反应为
Ⅱ.肼(
 )又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。(4)肼-空气燃料电池放电时:正极的电极反应式是
21-22高二上·河南南阳·期中 查看更多[2]
更新时间:2021-11-04 20:52:17
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】如图所示,C、D、E、F都是惰性电极,A、B为电源。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色,D质量增加。

(1)AB作为电源,可以利用多种原电池来提供电能,兴趣小组同学设计如下电源:
①小红同学设计利用反应“Cu+2Fe3+=Cu2++2Fe2+”制成化学电池来提供电能,该电池的负极材料是_______ ,电解质溶液是_______ 。
②小秦同学设计将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为_______ (填字母)。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
(2)若甲中装有足量的硫酸铜溶液,工作一段时间后,停止通电,欲使溶液恢复到起始状态,可向溶液中加入_______(填字母)。
(3)通电后乙中发生的总反应方程式为_______ 。
(4)欲用丙装置给铜镀银,则金属银应为_______ (填“G”或“H”)极,反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2g,理论上消耗氧气的质量为_______ g。

(1)AB作为电源,可以利用多种原电池来提供电能,兴趣小组同学设计如下电源:
①小红同学设计利用反应“Cu+2Fe3+=Cu2++2Fe2+”制成化学电池来提供电能,该电池的负极材料是
②小秦同学设计将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
(2)若甲中装有足量的硫酸铜溶液,工作一段时间后,停止通电,欲使溶液恢复到起始状态,可向溶液中加入_______(填字母)。
| A.Cu | B.Cu2(OH)2CO3 | C.Cu(OH)2 | D.CuCO3 |
(4)欲用丙装置给铜镀银,则金属银应为
您最近一年使用:0次
【推荐2】火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx: CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为_____________________________ 。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH3。
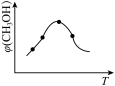
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应的ΔH3_____ (填“>”、“<”或“=”)0。
②在一个恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

试回答:0~10 min内,氢气的平均反应速率为_____ mol·L-1·min-1;该温度下,反应的平衡常数的值为_____ (结果保留一位小数);第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数_____ (填“增大”、“减小”或“不变”)。
(3)脱硫。
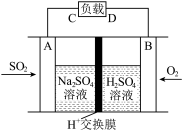
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极。则导线中电子移动方向为_____ (用“A→C”或“C→A”表示),A极的电极反应式为_____________ 。
②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成的硫酸铵和硝酸铵的混合物可作为化肥。硫酸铵和硝酸铵的水溶液pH<7,其原因用离子方程式表示为____________ ;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)_____ c(N )+c(OH-)。(填“>”、“=”或“<”)
)+c(OH-)。(填“>”、“=”或“<”)
(1)脱硝。利用甲烷催化还原NOx: CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(2)脱碳。将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH3。
①取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应的ΔH3

②在一个恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

试回答:0~10 min内,氢气的平均反应速率为
(3)脱硫。
①有学者想利用如图所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极。则导线中电子移动方向为

②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成的硫酸铵和硝酸铵的混合物可作为化肥。硫酸铵和硝酸铵的水溶液pH<7,其原因用离子方程式表示为
 )+c(OH-)。(填“>”、“=”或“<”)
)+c(OH-)。(填“>”、“=”或“<”)
您最近一年使用:0次
【推荐3】氨气常用作制冷剂及制取铵盐和氮肥,是一种用途广泛的化工原料.
(1)下表是当反应器中按 :
: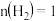 :3投料后,在
:3投料后,在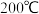 、
、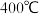 、
、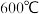 下,反应达到平衡时,混合物中
下,反应达到平衡时,混合物中 的物质的量分数随压强的变化曲线.
的物质的量分数随压强的变化曲线.
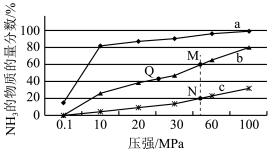
 曲线a对应的温度是
曲线a对应的温度是 ______ .
 关于工业合成氨的反应,下列叙述正确的是
关于工业合成氨的反应,下列叙述正确的是 ______  填字母
填字母 .
.
A.及时分离出 可以提高
可以提高 的平衡转化率
的平衡转化率
B.加催化剂能加快反应速率且提高 的平衡转化率
的平衡转化率
C.上图中M、N、Q点平衡常数K的大小关系是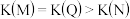
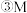 点对应的
点对应的 转化率是
转化率是 ______ .
(2)工业制硫酸的尾气中含较多的 ,为防止污染空气,回收利用
,为防止污染空气,回收利用 ,工业上常用氨水吸收法处理尾气.
,工业上常用氨水吸收法处理尾气.
 当氨水中所含氨的物质的量为3mol,吸收标准状况下
当氨水中所含氨的物质的量为3mol,吸收标准状况下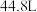
 时,溶液中的溶质为
时,溶液中的溶质为 ______ .
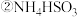 溶液显酸性.用氨水吸收
溶液显酸性.用氨水吸收 ,当吸收液显中性时,溶液中离子浓度关系正确的是
,当吸收液显中性时,溶液中离子浓度关系正确的是 ______  填字母
填字母 .
.
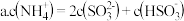
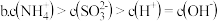
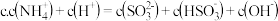
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:
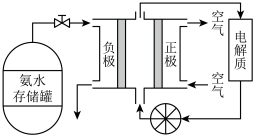
 氨气燃料电池的电解质溶液最好选择
氨气燃料电池的电解质溶液最好选择 ______  填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性” 溶液.
溶液.
 空气在进入电池装置前需要通过过滤器除去的气体是
空气在进入电池装置前需要通过过滤器除去的气体是 ______ .
 氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是
氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是 ______ .
(1)下表是当反应器中按
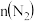 :
: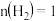 :3投料后,在
:3投料后,在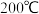 、
、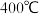 、
、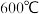 下,反应达到平衡时,混合物中
下,反应达到平衡时,混合物中 的物质的量分数随压强的变化曲线.
的物质的量分数随压强的变化曲线. 
 曲线a对应的温度是
曲线a对应的温度是  关于工业合成氨的反应,下列叙述正确的是
关于工业合成氨的反应,下列叙述正确的是  填字母
填字母 .
.A.及时分离出
 可以提高
可以提高 的平衡转化率
的平衡转化率 B.加催化剂能加快反应速率且提高
 的平衡转化率
的平衡转化率 C.上图中M、N、Q点平衡常数K的大小关系是
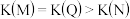
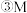 点对应的
点对应的 转化率是
转化率是 (2)工业制硫酸的尾气中含较多的
 ,为防止污染空气,回收利用
,为防止污染空气,回收利用 ,工业上常用氨水吸收法处理尾气.
,工业上常用氨水吸收法处理尾气.  当氨水中所含氨的物质的量为3mol,吸收标准状况下
当氨水中所含氨的物质的量为3mol,吸收标准状况下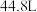
 时,溶液中的溶质为
时,溶液中的溶质为 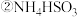 溶液显酸性.用氨水吸收
溶液显酸性.用氨水吸收 ,当吸收液显中性时,溶液中离子浓度关系正确的是
,当吸收液显中性时,溶液中离子浓度关系正确的是  填字母
填字母 .
.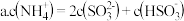
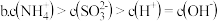
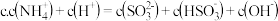
(3)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:

 氨气燃料电池的电解质溶液最好选择
氨气燃料电池的电解质溶液最好选择  填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性” 溶液.
溶液.  空气在进入电池装置前需要通过过滤器除去的气体是
空气在进入电池装置前需要通过过滤器除去的气体是  氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是
氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池正极的电极反应方是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】乙烯是重要的基本化工原料,以乙烷为原料生产乙烯有多种方法。
I.乙烷裂解脱氢法。该方法的反应为:C2H6(g)=C2H4(g)+H2(g) △H=akJ/mol
(1)已知101kPa,298K时,C(s)和H2(g)生成lmoC2H6(g)、1molC2H4(g)的△H分别为-84.7 kJ/mol、+52.3kJ/mol。则a=___________ 。
II.乙烷氧化脱氢法,在原料气中加入氧气,乙烷氧化脱氢的反应如下:2C2H6(g)+O2(g) 2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
(2)①反应的平衡常数表达式为K=___________ ,K(750℃)___________ K(900℃)(填“>”、“<”、“=”)
②当温度超过800℃时,乙烯的选择性降低,其主要原因可能是________________ 。
III.催化氧化脱氢法。以Mo-V-Nb-Sb的氧化物为催化剂,在常压、380℃下,反应速率与氧气分压[P(O2)]、乙烷分压[P(C2H6)的关系如下图所示。
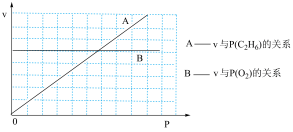
(3)已知该反应的速率方程为v=kPm(O2)·Pn(C2H6),则m=___________ ,n=___________ 。
IV质子膜燃料电池法。
(4)乙烷氧化制乙烯会产生CO2的大量排放,近年研究人员开发了乙烷氧化制乙烯的质子膜燃料电池(SOFC),该燃料电池的负极反应式为__________ ,这种电池工作过程中没有CO2排放,原因是______________ 。
I.乙烷裂解脱氢法。该方法的反应为:C2H6(g)=C2H4(g)+H2(g) △H=akJ/mol
(1)已知101kPa,298K时,C(s)和H2(g)生成lmoC2H6(g)、1molC2H4(g)的△H分别为-84.7 kJ/mol、+52.3kJ/mol。则a=
II.乙烷氧化脱氢法,在原料气中加入氧气,乙烷氧化脱氢的反应如下:2C2H6(g)+O2(g)
 2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:
2C2H4(g)+2H2O(g) △H<0,副反应都为放热反应,副产物有CH4(g)、CO(g)、CO2(g)。原料气(70.1%空气、29.9%C2H6)在反应器中停留15s,获得相关数据如下表:| 反应温度/℃ | 乙烷转化率/% | 乙烯选择性/% | 产率/% |
| 750 | 80.5 | 62.9 | 50.6 |
| 800 | 85.6 | 64.5 | 55.2 |
| 850 | 92.2 | 63.2 | 58.3 |
| 900 | 97.6 | 59.0 | 57.6 |
②当温度超过800℃时,乙烯的选择性降低,其主要原因可能是
III.催化氧化脱氢法。以Mo-V-Nb-Sb的氧化物为催化剂,在常压、380℃下,反应速率与氧气分压[P(O2)]、乙烷分压[P(C2H6)的关系如下图所示。

(3)已知该反应的速率方程为v=kPm(O2)·Pn(C2H6),则m=
IV质子膜燃料电池法。
(4)乙烷氧化制乙烯会产生CO2的大量排放,近年研究人员开发了乙烷氧化制乙烯的质子膜燃料电池(SOFC),该燃料电池的负极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某大学开发出纸一样薄的可生物降解锌电池,一化学兴趣小组受到启发,设计出如图所示装置用于探究原电池构成条件。回答下列问题:
(1)甲同学设计了下列实验探究原电池的构成条件。
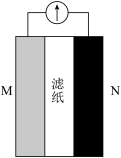
①实验1中电流计指针发生偏转的原因为_______ (填标号)。
A.铝与铜的活泼性不同 B.稀硫酸为电解质
C.整个装置形成了闭合回路 D.铜不与稀硫酸反应
②实验1中电流计发生偏转的原因之一是溶液中有自由移动的_______ (填“分子”、“离子”或“电子”);实验4中,原电池的负极为_______ (填“铝箔”或“铜箔”)。
(2)乙同学设计了下列实验探究原电池的构成条件。
①实验5、6中,所用稀H2SO4的物质的量的浓度相同,N极均观察到有气泡产生,产生气泡较快的是实验_______ (填“5”或“6”),原因是_______ 。
②实验7中的未知溶液可能为_______ (填标号)。
a.浓盐酸 b.浓硝酸 c.NaOH溶液 d.稀硫酸
(3)丙同学按下列材料设计了一原电池,该电池工作时, 移向
移向_______ (填“M”或“N”)极,该电池的正极表面发生的电极反应为_______ 。
(1)甲同学设计了下列实验探究原电池的构成条件。

| 试验编号 | M极材料 | N极材料 | 滤纸浸泡物质 | 电流计指针是否偏转 |
| 1 | 铝箔 | 铜箔 | 稀H2SO4 | 是 |
| 2 | 铝箔 | 铜箔 | 乙醇 | 否 |
| 3 | 铝箔 | 铜箔 | 蔗糖溶液 | 否 |
| 4 | 铝箔 | 铜箔 | 番茄汁(pH≈4) | 是 |
A.铝与铜的活泼性不同 B.稀硫酸为电解质
C.整个装置形成了闭合回路 D.铜不与稀硫酸反应
②实验1中电流计发生偏转的原因之一是溶液中有自由移动的
(2)乙同学设计了下列实验探究原电池的构成条件。
| 试验编号 | M极材料 | N极材料 | 滤纸浸泡物质 | 电流计指针是否偏转及偏转方向 |
| 5 | 铝箔 | 铜箔 | 稀H2SO4 | 偏向铝箔 |
| 6 | 铝箔 | 铝箔 | 稀H2SO4 | 不偏转 |
| 7 | 铜箔 | 铝箔 | 未知溶液 | 偏向铜箔 |
②实验7中的未知溶液可能为
a.浓盐酸 b.浓硝酸 c.NaOH溶液 d.稀硫酸
(3)丙同学按下列材料设计了一原电池,该电池工作时,
 移向
移向| M极材料 | N极材料 | 滤纸浸泡物质 |
| 铁箔 | 铜箔 | FeCl3稀溶液 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】下图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

(1)A中反应的离子方程式是_____ 。
(2)B中Cu极属于原电池中的_____ 极;Fe极附近溶液呈_____ 色。
(3)C中被腐蚀的金属是_____ (填化学式),A、B、C中铁被腐蚀的速率,由快到慢的顺序是_____ (用“>”表示)。

(1)A中反应的离子方程式是
(2)B中Cu极属于原电池中的
(3)C中被腐蚀的金属是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】 是一种清洁能源和重要化工原料。
是一种清洁能源和重要化工原料。
(1)已知下列热化学方程式:
①
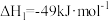
②
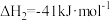
③

用 和
和 反应合成
反应合成 时,若消耗标准状况下
时,若消耗标准状况下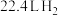 ,则理论上需要
,则理论上需要_____ (填“放出”或“吸收”)_______  的能量。
的能量。
(2)在恒容密闭容器中投入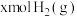 、
、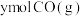 发生反应;
发生反应; ,测得
,测得 平衡转化率
平衡转化率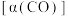 与温度(
与温度( )、投料比(
)、投料比( )的关系如图所示。
)的关系如图所示。

①当投料比一定时,随着温度升高, 的平衡转化率降低,其原因是
的平衡转化率降低,其原因是____ 。
②投料比( ):I
):I____ II(填“ ”“
”“ ”或“
”或“ ”)。
”)。
③在1L恒容密闭容器中,初始时加入 、
、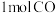 ,在温度
,在温度 下反应达到图中M平衡点,则该温度下该反应的平衡常数K=
下反应达到图中M平衡点,则该温度下该反应的平衡常数K=____ 。
(3)利用如图所示的装置探究酸性高锰酸钾溶液氧化甲醇的反应(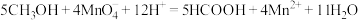 )。
)。
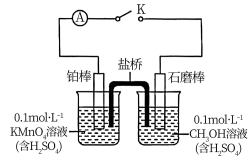
关闭K,观察到电流表指针有明显偏转,左烧杯中溶液的紫红色逐渐变浅,则石墨棒为_____ 极(填“正”或“负”),正极反应式为_____ 。
 是一种清洁能源和重要化工原料。
是一种清洁能源和重要化工原料。(1)已知下列热化学方程式:
①

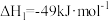
②

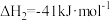
③


用
 和
和 反应合成
反应合成 时,若消耗标准状况下
时,若消耗标准状况下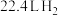 ,则理论上需要
,则理论上需要 的能量。
的能量。(2)在恒容密闭容器中投入
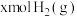 、
、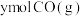 发生反应;
发生反应; ,测得
,测得 平衡转化率
平衡转化率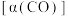 与温度(
与温度( )、投料比(
)、投料比( )的关系如图所示。
)的关系如图所示。
①当投料比一定时,随着温度升高,
 的平衡转化率降低,其原因是
的平衡转化率降低,其原因是②投料比(
 ):I
):I ”“
”“ ”或“
”或“ ”)。
”)。③在1L恒容密闭容器中,初始时加入
 、
、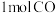 ,在温度
,在温度 下反应达到图中M平衡点,则该温度下该反应的平衡常数K=
下反应达到图中M平衡点,则该温度下该反应的平衡常数K=(3)利用如图所示的装置探究酸性高锰酸钾溶液氧化甲醇的反应(
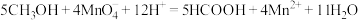 )。
)。
关闭K,观察到电流表指针有明显偏转,左烧杯中溶液的紫红色逐渐变浅,则石墨棒为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z的最外层电子数之比为 2:3,常见化合物Y2X2与水反应生成X的单质,其水溶液可使酚酞试液变红。请回答下列问题:
(1)Z的原子结构示意图为_______ ;
(2)化合物Y2X2中含有的化学键类型有_______ (填序号)。
A.离子键 B.极性共价键 C.非极性键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为:_______ 。
(4)将Z与X形成的气态化合物ZX2通入Ba(NO3)2溶液中,有白色沉淀和一氧化氮气体生成,发生反应的离子方程式为:_______ 。
(5)由BA4、X2、YXA溶液可以组成原电池,则组成该原电池的负极反应式为:_______ ,
原电池工作一段时间后,整个溶液的pH将_______ (填“增大”、“不变”或“减小”)
(1)Z的原子结构示意图为
(2)化合物Y2X2中含有的化学键类型有
A.离子键 B.极性共价键 C.非极性键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为:
(4)将Z与X形成的气态化合物ZX2通入Ba(NO3)2溶液中,有白色沉淀和一氧化氮气体生成,发生反应的离子方程式为:
(5)由BA4、X2、YXA溶液可以组成原电池,则组成该原电池的负极反应式为:
原电池工作一段时间后,整个溶液的pH将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇(CH3OH)与氧作用生成水和二氧化碳。该电池 负极发生的反应是_______ 。
(2)要实现铁上镀银,则阳极为_______ ,电极反应式为_______ ,阴极为_______ ,电极反应式为_______ ,电镀液为_______ 。
(3)电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a ;X、Y 是两块电极板,通过导线与直流电源相连。请回答以下问题:

①若X、Y 都是惰性电极,a 是饱和 NaCl 溶液,则电解池中 X 极上的电极反应 为_______ ,Y 电极上的电极反应式是_______ ,检验该电极反应产物的方法是 :_______ 。
③如果用电解方法精炼粗铜,电解液 a 选用 CuSO4溶液,则X 电极的材料是_______ ,电极反应式是_______ ,Y 电极的材料是_______ ,电极反应式是_______ 。(假设粗铜中含铁、锌、银、金)
(4)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2 SO
 2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):放电时:正极的电极反应式是
2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):放电时:正极的电极反应式是_______ ;电解液中 H2SO4的浓度将变_______ ;当外电路通过 1 mol 电子时,理论上负极板的质量增加_______ g。充电时:阴极的电极反应式是_______ 。
(1)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇(CH3OH)与氧作用生成水和二氧化碳。该电池 负极发生的反应是
(2)要实现铁上镀银,则阳极为
(3)电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a ;X、Y 是两块电极板,通过导线与直流电源相连。请回答以下问题:

①若X、Y 都是惰性电极,a 是饱和 NaCl 溶液,则电解池中 X 极上的电极反应 为
③如果用电解方法精炼粗铜,电解液 a 选用 CuSO4溶液,则X 电极的材料是
(4)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2 SO

 2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):放电时:正极的电极反应式是
2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):放电时:正极的电极反应式是
您最近一年使用:0次
【推荐2】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效开发利用CO2,已引起全世界的普遍重视。一定条件下,CO2可以转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
(1)在一恒温恒容密闭容器中充入1molCO2和3molH2进行上述反应。测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。
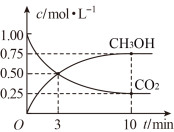
①0~10min内,氢气的平均反应速率为___ ,第10min后,保持温度不变,向该密闭容器中再充入1molCO2(g)和1molH2O(g),则平衡___ (填“正向”“逆向”或“不”)移动。
②若已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(g) ΔH=-akJ·mol-1;
2H2(g)+ O2(g)=2H2O(g) ΔH=-bkJ·mol-1
H2O(g)=H2O(l) ΔH=-ckJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-dkJ·mol-1。
则表示CH3OH(l)燃烧热的热化学方程为___ 。
(2)如图所示,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解600mL一定浓度的NaCl溶液,电池的正极反应式为___ 。在电解一段时间后,NaCl溶液的pH变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为___ mol。

(3)向(2)电解后U形管的溶液中通入标准状况下89.6mL的CO2气体,则所得溶液呈___ (填“酸”“碱”或“中”)性,溶液中各离子浓度由大到小的顺序为___ 。
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。(1)在一恒温恒容密闭容器中充入1molCO2和3molH2进行上述反应。测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。

①0~10min内,氢气的平均反应速率为
②若已知:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-akJ·mol-1;
CH3OH(g)+H2O(g) ΔH=-akJ·mol-1;2H2(g)+ O2(g)=2H2O(g) ΔH=-bkJ·mol-1
H2O(g)=H2O(l) ΔH=-ckJ·mol-1;
CH3OH(g)=CH3OH(l) ΔH=-dkJ·mol-1。
则表示CH3OH(l)燃烧热的热化学方程为
(2)如图所示,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解600mL一定浓度的NaCl溶液,电池的正极反应式为

(3)向(2)电解后U形管的溶液中通入标准状况下89.6mL的CO2气体,则所得溶液呈
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的开关时,观察到电流表的指针发生了偏转。请回答下列问题:
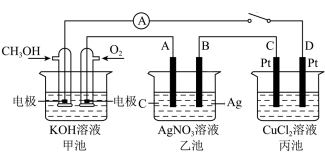
(1)甲池为_______ (填“原电池“电解池”或“电镀池”)。
(2)丙池中D极的电极反应为_______ 。
(3)若甲、乙、丙溶液体积均为500mL,当乙池中B极质量增加5.4g时,甲池中理论上消耗O2的体积为_______ (标准状况),乙池中溶液pH=_______ ,要使乙池溶液恢复原状,可向溶液中加入物质_______ (假设各池溶质均足量)。
(4)若丙中电极不变,将其溶液换成溶液,写出丙池发生反应的化学方程式_______ 。

(1)甲池为
(2)丙池中D极的电极反应为
(3)若甲、乙、丙溶液体积均为500mL,当乙池中B极质量增加5.4g时,甲池中理论上消耗O2的体积为
(4)若丙中电极不变,将其溶液换成溶液,写出丙池发生反应的化学方程式
您最近一年使用:0次