回答下列问题:
(1)H2+Cl2=2HCl的反应过程如下图所示:

根据图中信息,该反应_______ (填“放出”或“吸收”)_______ kJ热量。
(2)硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:(a)SiO2+2C Si+2CO↑。
Si+2CO↑。
精炼硅:(b)Si+3HCl SiHCl3+H2;
SiHCl3+H2;
(c)SiHCl3+H2 Si+3HCl。
Si+3HCl。
化学反应与能量变化如图所示,回答下列问题:
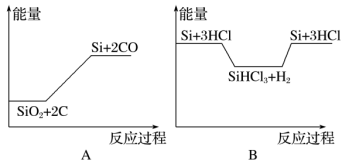
①(a)是_______ 反应,(b)是_______ 反应,(c)是_______ 反应(填“吸热”或“放热”)。
②反应(b)破坏反应物中的化学键所吸收的能量_______ (填“大于”或“小于”)形成生成物中化学键所放出的能量。
(1)H2+Cl2=2HCl的反应过程如下图所示:

根据图中信息,该反应
(2)硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:(a)SiO2+2C
 Si+2CO↑。
Si+2CO↑。精炼硅:(b)Si+3HCl
 SiHCl3+H2;
SiHCl3+H2;(c)SiHCl3+H2
 Si+3HCl。
Si+3HCl。化学反应与能量变化如图所示,回答下列问题:

①(a)是
②反应(b)破坏反应物中的化学键所吸收的能量
更新时间:2021-11-09 16:57:09
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】硅是无机非金属材料的主角,硅的氧化物和硅酸盐占地壳的90%以上。
(1)下列不属于硅酸盐的是_______ 。
A.碳化硅陶瓷 B.黏土 C.玻璃 D. 石英
B.黏土 C.玻璃 D. 石英
(2)科学家用金属钠、四氯化碳和四氯化硅制得了碳化硅纳米棒,反应的化学方程式为:8Na+CCl4+SiCl4=SiC+8NaCl,其中氧化剂为______ 。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可以用作______ ;Na2SiO3可通过SiO2与纯碱混合高温下反应制得,反应时可以采用的坩埚为______ (填字母)。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D. 铁坩埚
(4)制备纯硅的生产过程为如图:
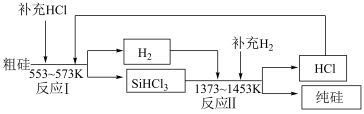
假设每一轮次制备1mol纯硅,生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应Ⅱ中H2的利用率为93.75%。则在第二轮次的生产中,补充投入HCl和H2的物质的量之比为______ 。
(1)下列不属于硅酸盐的是
A.碳化硅陶瓷
 B.黏土 C.玻璃 D. 石英
B.黏土 C.玻璃 D. 石英(2)科学家用金属钠、四氯化碳和四氯化硅制得了碳化硅纳米棒,反应的化学方程式为:8Na+CCl4+SiCl4=SiC+8NaCl,其中氧化剂为
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可以用作
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D. 铁坩埚
(4)制备纯硅的生产过程为如图:

假设每一轮次制备1mol纯硅,生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应Ⅱ中H2的利用率为93.75%。则在第二轮次的生产中,补充投入HCl和H2的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
石英砂 粗硅
粗硅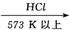 SiHCl3(粗)
SiHCl3(粗) SiHCl3(纯)
SiHCl3(纯)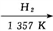 高纯硅
高纯硅
①写出由纯Si HCl3制备高纯硅的化学反应方程式:
HCl3制备高纯硅的化学反应方程式:_____________ 。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出这一过程的化学反应方程式:__ ;H2还原SiHCl3过程中若混入O2,可能引起的后果是__________ 。
(2)下列有关硅材料的说法正确的是_____ (填字母)。
A.碳化硅化学性质稳定,可用于生产砂纸、砂轮的磨料
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(1)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
石英砂
 粗硅
粗硅 SiHCl3(粗)
SiHCl3(粗) SiHCl3(纯)
SiHCl3(纯) 高纯硅
高纯硅①写出由纯Si
 HCl3制备高纯硅的化学反应方程式:
HCl3制备高纯硅的化学反应方程式:②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出这一过程的化学反应方程式:
(2)下列有关硅材料的说法正确的是
A.碳化硅化学性质稳定,可用于生产砂纸、砂轮的磨料
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】请按要求回答下列问题:
(1)下列纯净物中:a.NaOH b.Ar c.MgCl2 d.HCl e.NH3 f.KNO3
①不含化学键的物质是_______ (填序号,下同)。
②既含有离子键又含有共价键的物质是______ 。
③只含有离子键的物质是________ 。
(2)下列变化中,不需要破坏化学键的是______ 。
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
(3)实验室盛放碱液的试剂瓶不能用玻璃塞,以氢氧化钠为例,用离子方程式表示其原因:_________ ,任写一个制造普通玻璃的主要反应的化学方程___________________ 。
(4)硅是良好的半导体材料,写出工业上生产粗硅的化学方程式:__________________________ 。
(1)下列纯净物中:a.NaOH b.Ar c.MgCl2 d.HCl e.NH3 f.KNO3
①不含化学键的物质是
②既含有离子键又含有共价键的物质是
③只含有离子键的物质是
(2)下列变化中,不需要破坏化学键的是
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
(3)实验室盛放碱液的试剂瓶不能用玻璃塞,以氢氧化钠为例,用离子方程式表示其原因:
(4)硅是良好的半导体材料,写出工业上生产粗硅的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要___ ,形成化学键要___ 。
(2)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
①2SO2(g)+O2(g) 2SO3(g)ΔH1=-197kJ/mol;
2SO3(g)ΔH1=-197kJ/mol;
②H2O(g)=H2O(l)ΔH2=-44kJ/mol;
③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)ΔH3=-545kJ/mol。
写出SO3(g)与H2O(l)反应的热化学方程式是____ 。
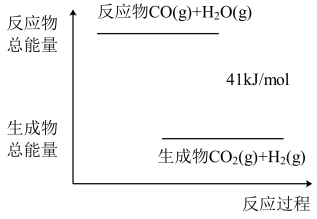
(3)已知一定条件下,CO(g)+H2O(g) CO2(g)+H2(g)反应过程能量变化如图所示,该反应为
CO2(g)+H2(g)反应过程能量变化如图所示,该反应为___ 反应(填“吸热”或“放热”)。
(4)已知热化学方程式:SO2(g)+ O2(g)
O2(g) SO3(g)ΔH=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g)ΔH=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为_____ 。
A.98.32kJ B.196.64kJ/mol C.<196.64kJ D.>196.64kJ
(1)从能量的角度看,断开化学键要
(2)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
①2SO2(g)+O2(g)
 2SO3(g)ΔH1=-197kJ/mol;
2SO3(g)ΔH1=-197kJ/mol;②H2O(g)=H2O(l)ΔH2=-44kJ/mol;
③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)ΔH3=-545kJ/mol。
写出SO3(g)与H2O(l)反应的热化学方程式是
(3)已知一定条件下,CO(g)+H2O(g)
 CO2(g)+H2(g)反应过程能量变化如图所示,该反应为
CO2(g)+H2(g)反应过程能量变化如图所示,该反应为
(4)已知热化学方程式:SO2(g)+
 O2(g)
O2(g) SO3(g)ΔH=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g)ΔH=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为A.98.32kJ B.196.64kJ/mol C.<196.64kJ D.>196.64kJ
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】完成下列问题。
(1)下列反应中,属于放热反应的是_______ (填字母,下同),属于吸热反应的是_______ 。
a.盐酸与烧碱溶液反应
b.
c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
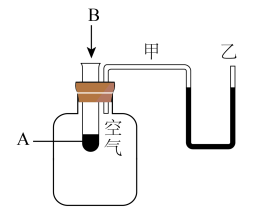
(2)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面上升乙处液面下降。
①该反应为_______ 反应(填“放热”或“吸热”)。
②该反应的反应物化学键断裂吸收的能量________ (填“高”或“低”)于生成物化学键形成放出的能量。
(3)A、B、C、D四种金属按下表中装置进行实验。
根据实验现象回答下列问题:
①装置甲中负极是_______ (填“A”或“B”)极。
②装置乙中正极有铜生成则正级电极反应式为_______ 。
③四种金属活动性由强到弱的顺序是_______ 。
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为见解质,其工作原理如下图所示:_______ (填“a极到b极”或“b极到a极”)。
②a电极的电极方程式为_______ 。
(1)下列反应中,属于放热反应的是
a.盐酸与烧碱溶液反应
b.

c.氢气在氧气中燃烧生成水
d.高温煅烧石灰石使其分解
(2)为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面上升乙处液面下降。
①该反应为
②该反应的反应物化学键断裂吸收的能量
(3)A、B、C、D四种金属按下表中装置进行实验。
| 装置 |
|
|
|
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中负极是
②装置乙中正极有铜生成则正级电极反应式为
③四种金属活动性由强到弱的顺序是
(4)甲烷可直接应用于燃料电池,该电池采用KOH溶液为见解质,其工作原理如下图所示:
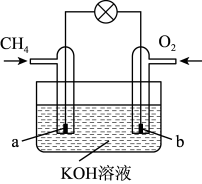
②a电极的电极方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】生产生活中的化学反应都伴随能量的变化,请根据有关知识回答下列问题:
(1)“即热饭盒”可利用下面___________ (填字母序号)反应释放的热量加热食物。
A.生石灰和水B.浓硫酸和水C.钠和水
(2)氧、硫、硒( )、碲(
)、碲( )、钋(
)、钋(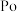 )是元素周期表中原子序数依次增大的同主族元素。
)是元素周期表中原子序数依次增大的同主族元素。
某温度时,该族单质与 反应生成气态
反应生成气态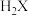 的热化学方程式如下:
的热化学方程式如下:
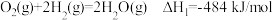
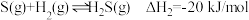
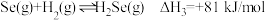
①硫和硒氢化物的热稳定性:
___________  (填“>”、“=”或“<”):判断依据是
(填“>”、“=”或“<”):判断依据是___________ 。
②写出 与
与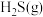 反应生成
反应生成 和
和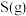 的热化学方程式
的热化学方程式___________ 。
(3)火箭发射时可以用液态肼作燃料, 作氧化剂。相关物质的能量转化关系如下。
作氧化剂。相关物质的能量转化关系如下。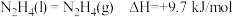 ,则
,则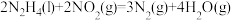 的反应热
的反应热 为
为___________  。
。
(1)“即热饭盒”可利用下面
A.生石灰和水B.浓硫酸和水C.钠和水
(2)氧、硫、硒(
 )、碲(
)、碲( )、钋(
)、钋(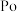 )是元素周期表中原子序数依次增大的同主族元素。
)是元素周期表中原子序数依次增大的同主族元素。某温度时,该族单质与
 反应生成气态
反应生成气态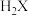 的热化学方程式如下:
的热化学方程式如下: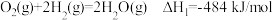
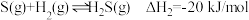
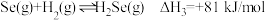
①硫和硒氢化物的热稳定性:

 (填“>”、“=”或“<”):判断依据是
(填“>”、“=”或“<”):判断依据是②写出
 与
与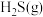 反应生成
反应生成 和
和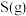 的热化学方程式
的热化学方程式(3)火箭发射时可以用液态肼作燃料,
 作氧化剂。相关物质的能量转化关系如下。
作氧化剂。相关物质的能量转化关系如下。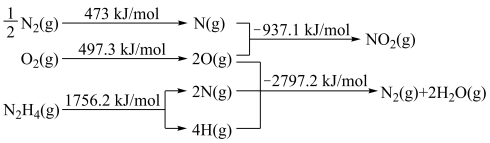
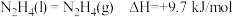 ,则
,则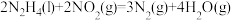 的反应热
的反应热 为
为 。
。
您最近一年使用:0次