按要求填空:
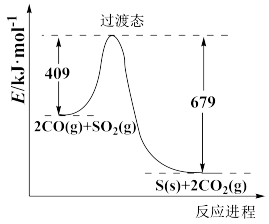
(1)对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下由SO2和CO反应生成S和CO2的能量变化如图所示,若反应中有48g S(s)生成,则该反应___________ (填“放出”或“吸收”)的热量为___________ 。
(2)汽车尾气中排放的NOx和CO污染环境,在汽车尾气中安装催化转化器,可有效降低NOx和CO的排放。已知:
a.2CO(g)+O2(g) 2CO2(g) ∆H=-566.0kJ·mol-1
2CO2(g) ∆H=-566.0kJ·mol-1
b.N2(g)+O2(g) 2NO(g) ∆H=+180.5kJ·mol-1
2NO(g) ∆H=+180.5kJ·mol-1
回答下列问题
①CO的燃烧热为___________ 。
②CO将NO还原为N2的热化学方程式为___________ 。
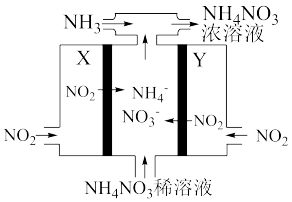
(3)电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。电解NO2制备NH4NO3原理如图所示。阳极为___________ (填“X”或“Y”),Y的电极反应式为___________ 。
(1)对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下由SO2和CO反应生成S和CO2的能量变化如图所示,若反应中有48g S(s)生成,则该反应

(2)汽车尾气中排放的NOx和CO污染环境,在汽车尾气中安装催化转化器,可有效降低NOx和CO的排放。已知:
a.2CO(g)+O2(g)
 2CO2(g) ∆H=-566.0kJ·mol-1
2CO2(g) ∆H=-566.0kJ·mol-1b.N2(g)+O2(g)
 2NO(g) ∆H=+180.5kJ·mol-1
2NO(g) ∆H=+180.5kJ·mol-1回答下列问题
①CO的燃烧热为
②CO将NO还原为N2的热化学方程式为
(3)电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。电解NO2制备NH4NO3原理如图所示。阳极为

21-22高二上·安徽宿州·期中 查看更多[2]
安徽省宿州市十三所重点中学2021-2022学年高二上学期期中质量检测(鲁科版理科)化学试题(已下线)4.2.2 电解原理的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)
更新时间:2021-12-07 21:29:32
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)通过以下反应均可获取H2。下列有关说法正确的是(_____ )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=206.1kJ·mol–1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH=74.8kJ·mol–1
(2)俄罗斯用“质子﹣M”号运载火箭成功将“光线”号卫星送入预定轨道。发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
①H2(g)=H2(l)△H1=﹣0.92kJ·mol﹣1
②O2(g)=O2(l)△H2=﹣6.84kJ·mol﹣1
③有关过程如图:
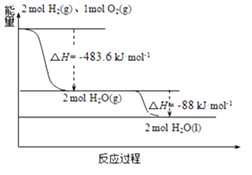
下列说法正确的是(_____ )
A.2mol H2(g)与1mol O2(g)所具有的总能量比2molH2O(g)所具有的总能量低
B.氢气的燃烧热为△H=﹣241.8 kJ·mol﹣1
C.火箭液氢燃烧的热化学方程式2H2(l)+O2(l)═2H2O(g)△H=﹣474.92kJ·mol﹣1
D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
(3)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH____ 0(填“>”、“<”或“=”)。
(4)①合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。贮氢合金ThNi5可催化由CO、H2合成CH4的反应,已知温度为T时:
CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165kJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41kJ•mol
则温度为T时,该反应的热化学方程式为_________ 。
②研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式____________ 。
(5)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2 ,其中CO分子为C≡O)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=___ kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=___ kJ·mol-1。
(1)通过以下反应均可获取H2。下列有关说法正确的是(
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=206.1kJ·mol–1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH=74.8kJ·mol–1
(2)俄罗斯用“质子﹣M”号运载火箭成功将“光线”号卫星送入预定轨道。发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
①H2(g)=H2(l)△H1=﹣0.92kJ·mol﹣1
②O2(g)=O2(l)△H2=﹣6.84kJ·mol﹣1
③有关过程如图:

下列说法正确的是(
A.2mol H2(g)与1mol O2(g)所具有的总能量比2molH2O(g)所具有的总能量低
B.氢气的燃烧热为△H=﹣241.8 kJ·mol﹣1
C.火箭液氢燃烧的热化学方程式2H2(l)+O2(l)═2H2O(g)△H=﹣474.92kJ·mol﹣1
D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
(3)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH
(4)①合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。贮氢合金ThNi5可催化由CO、H2合成CH4的反应,已知温度为T时:
CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165kJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41kJ•mol
则温度为T时,该反应的热化学方程式为
②研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式
(5)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2 ,其中CO分子为C≡O)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2③CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】回答下列问题:
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质硫和二氧化碳。已知:①CO(g)+
 O2(g)=CO2(g) ΔH=-283.0kJ·mol-1;②S(s)+O2(g)=SO2(g) ΔH=-296.0kJ·mol-1。该转化反应的热化学方程式为
O2(g)=CO2(g) ΔH=-283.0kJ·mol-1;②S(s)+O2(g)=SO2(g) ΔH=-296.0kJ·mol-1。该转化反应的热化学方程式为(2)氮氧化物是造成光化学烟雾的主要气体。已知:
CO(g)+NO2(g)=NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-bkJ·mol-1(b>0)
若用3.36L(标准状况下)CO将NO2还原为N2(CO完全反应),整个反应过程中转移电子的物质的量为
(3)用CH4催化还原NOx也可以消除氮氧化物污染。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1①
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2②
若1molCH4将NO2还原为N2,整个过程中放出的热量为867kJ,则ΔH2=
(4)某氮肥厂含氮废水中的氮元素多以NH
 和NH3·H2O形式存在,处理过程中NH
和NH3·H2O形式存在,处理过程中NH 在微生物的作用下经过两步反应被氧化为NO
在微生物的作用下经过两步反应被氧化为NO 。这两步反应过程中的能量变化如图所示:
。这两步反应过程中的能量变化如图所示:
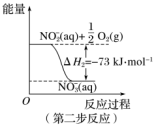
1molNH (aq)全部被氧化成NO
(aq)全部被氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氢气、甲烷、甲醇等都是优质的清洁燃料,通常用于制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______ 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。该反应的平衡常数表达式为___ 。则T1___ T2(填“<”“>”或“=”下同),A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___ 。

②120℃时,将1molCH4和2molH2O(g)通入容积为1L的密闭容器中发生反应,不能说明该反应已经达到平衡状态的是_______ 。
a.混合气体的相对分子质量恒定
b.容器内气体密度恒定
c.容器内的压强恒定
d.单位时间内消耗0.3molCH4同时生成0.9molH2
e.3v正(CH4)=v逆(H2)
(3)某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。放电时,Li+在电解质中向_______ 迁移,负极的电极反应式为_______ 充电时,若转移xmole-,石墨(C6)电极将增重_______ g
(1)已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。该反应的平衡常数表达式为

②120℃时,将1molCH4和2molH2O(g)通入容积为1L的密闭容器中发生反应,不能说明该反应已经达到平衡状态的是
a.混合气体的相对分子质量恒定
b.容器内气体密度恒定
c.容器内的压强恒定
d.单位时间内消耗0.3molCH4同时生成0.9molH2
e.3v正(CH4)=v逆(H2)
(3)某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。放电时,Li+在电解质中向
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】按题意要求填空:
(1)已知10g己烷完全燃烧生成液态水放出484kJ的热量,写出表示己烷燃烧热的热化学方程______________ 。
(2)已知在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:

则 全部被氧化成
全部被氧化成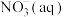 的热化学方程式为:
的热化学方程式为:_____________ 。
(3)化学键的键能是原子间形成(或断裂) 化学键时释放(或吸收)的能量。以下是部分共价键键能数据:H-S:
化学键时释放(或吸收)的能量。以下是部分共价键键能数据:H-S: ;S-S:
;S-S: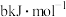 ;S=O:
;S=O: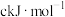 ;H-O:
;H-O: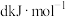 。
。
已知反应:
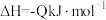 ,其反应产物中的固体
,其反应产物中的固体 实为
实为 ,实际分子是一个8元环状分子(即
,实际分子是一个8元环状分子(即 ),试根据这些数据计算已知反应的反应热:则Q=
),试根据这些数据计算已知反应的反应热:则Q=__________ (用a、b、c、d表示)。若已知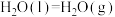
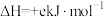 ,试写出
,试写出 和
和 反应生成
反应生成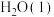 的热化学方程式为:
的热化学方程式为:_______ 。
(4)已知 (金刚石,s)
(金刚石,s)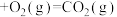
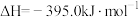
 (石墨,s)
(石墨,s)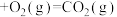
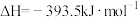
①石墨和金刚石相比,石墨的稳定性_______ 金刚石的稳定性。(填“大于”“小于”或“等于”,下同)
②石墨中 键键能
键键能_______ 金刚石中 键键能
键键能
(1)已知10g己烷完全燃烧生成液态水放出484kJ的热量,写出表示己烷燃烧热的热化学方程
(2)已知在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:
则
 全部被氧化成
全部被氧化成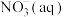 的热化学方程式为:
的热化学方程式为:(3)化学键的键能是原子间形成(或断裂)
 化学键时释放(或吸收)的能量。以下是部分共价键键能数据:H-S:
化学键时释放(或吸收)的能量。以下是部分共价键键能数据:H-S: ;S-S:
;S-S: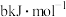 ;S=O:
;S=O: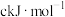 ;H-O:
;H-O: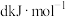 。
。已知反应:

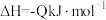 ,其反应产物中的固体
,其反应产物中的固体 实为
实为 ,实际分子是一个8元环状分子(即
,实际分子是一个8元环状分子(即 ),试根据这些数据计算已知反应的反应热:则Q=
),试根据这些数据计算已知反应的反应热:则Q=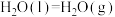
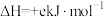 ,试写出
,试写出 和
和 反应生成
反应生成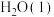 的热化学方程式为:
的热化学方程式为:(4)已知
 (金刚石,s)
(金刚石,s)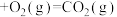
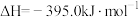
 (石墨,s)
(石墨,s)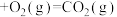
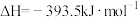
①石墨和金刚石相比,石墨的稳定性
②石墨中
 键键能
键键能 键键能
键键能
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】氨气是一种重要的物质,可用于制取化肥和硝酸等。已知H﹣H键、N﹣H键、N≡N键的键能分别是436 kJ·mol-1、391 kJ·mol-1、946 kJ·mol-1。
(1)写出合成氨的热反应方程式:____ 。生成1 mol NH3需要吸收或放出___ kJ。
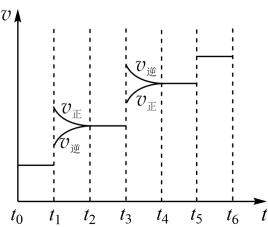
(2)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中t1时引起平衡移动的条件可能是______ 。其中表示平衡混合物中NH3的含量最高的一段时间是______ 。
(1)写出合成氨的热反应方程式:
(2)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中t1时引起平衡移动的条件可能是

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
(1)①已知断裂或形成1mol化学键所吸收或放出的能量叫做该化学键的键能,单位为kJ·mol-1.白磷在氧气中燃烧的化学方程式可用结构式表示如图:
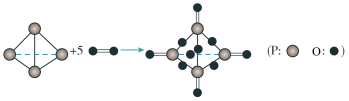
根据下表中数据计算:0.1molP4(白磷)在氧气中充分反应___________ (填“吸收”或“放出”)___________ kJ能量,在此过程中能量的转化形式为___________ 。
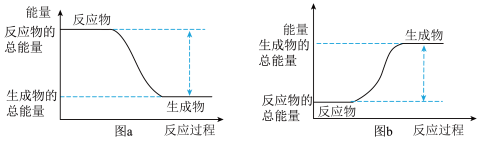
②白磷在氧气中燃烧的能量变化可用图中的___________ (填字母)表示。
③已知在一定条件下,白磷转化为红磷释放能量,故白磷比红磷的稳定性___________ (填“强”或“弱”)。
(2)根据下图所示的转化关系判断,生成16gCH3OH(l)放出___________ kJ能量。

(1)①已知断裂或形成1mol化学键所吸收或放出的能量叫做该化学键的键能,单位为kJ·mol-1.白磷在氧气中燃烧的化学方程式可用结构式表示如图:

根据下表中数据计算:0.1molP4(白磷)在氧气中充分反应
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ·mol-1 | 198 | 360 | 498 | 585 |

③已知在一定条件下,白磷转化为红磷释放能量,故白磷比红磷的稳定性
(2)根据下图所示的转化关系判断,生成16gCH3OH(l)放出

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】甲、乙、丙、丁是原子序数依次增大的短周期元素,甲与丙、乙与丁分别同主族,甲、丙均可与乙形成原子个数之比为1:1和2:1的化合物。由甲、乙、丁中的一种或几种元素可组成下列转化关系中的所有物质。
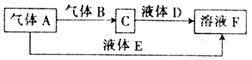
请回答下列问题:
(1)丙元素的离子结构示意图为
(2)E的电子式为
(3)科学家提出设想,以右上图所示装置利用电化学原理生产溶液F,写出通入气体A的一极的电极反应式:


请回答下列问题:
(1)丙元素的离子结构示意图为
(2)E的电子式为
(3)科学家提出设想,以右上图所示装置利用电化学原理生产溶液F,写出通入气体A的一极的电极反应式:
您最近一年使用:0次
填空题
|
适中
(0.65)
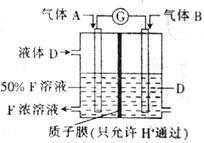
【推荐2】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
(1)海水显弱碱性的原因是(用离子方程式表示):____________ ,该海水中Ca2+的物质的量浓度为__________ mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________ 。
② 电解一段时间,____ 极(填“阴”或“阳”)会产生水垢,其成分为_____ (填化学式)。
③ 淡水的出口为a、b、c中的__________ 出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____ (填粒子符号),充电时该电极反应式为_______ 。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________ (空气中氧气的体积分数按20%计)。
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg∙L-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为
② 电解一段时间,
③ 淡水的出口为a、b、c中的
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】以氨气代替氢气研发氨燃料电池是当前科研的热点,其工作原理如图所示。
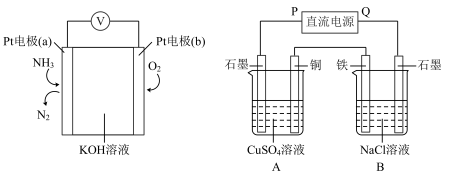
(1)氨燃料电池负极的电极反应式为_________ ,溶液中OH-向电极_________ 移动(填“a”或“b”)
(2)用氨燃料电池电解足量NaCl溶液和CuSO4溶液(如图所示),反应一段时间后,停止通电。向B烧杯中滴入几滴紫色石蕊试液,观察到石墨电极附近首先变蓝。
①电源的Q端为_________ 极,B烧杯中石墨电极上的电极反应为____________________ 。
②A烧杯中电解反应的化学方程式为_________________________ 。
③停止电解,向A烧杯的溶液中加入0.4 g CuO固体后恰好可使溶液恢复到电解前的浓度,电解前后溶液体积变化忽略不计,均为100 ml,则电解后所得溶液的pH为_________ 。

(1)氨燃料电池负极的电极反应式为
(2)用氨燃料电池电解足量NaCl溶液和CuSO4溶液(如图所示),反应一段时间后,停止通电。向B烧杯中滴入几滴紫色石蕊试液,观察到石墨电极附近首先变蓝。
①电源的Q端为
②A烧杯中电解反应的化学方程式为
③停止电解,向A烧杯的溶液中加入0.4 g CuO固体后恰好可使溶液恢复到电解前的浓度,电解前后溶液体积变化忽略不计,均为100 ml,则电解后所得溶液的pH为
您最近一年使用:0次



