实验题
(1)用50mL0.50mol/L的盐酸与50mL0.55mol/L的 溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
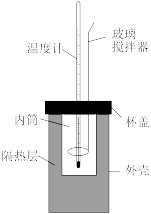
回答下列问题:(①②③填“偏大”“偏小”或“无影响”)。
①若将杯盖改为薄铁板,则求得的ΔH会___________
②混合酸、碱溶液时,动作缓慢,则求得的ΔH会___________
③若将盐酸改为醋酸,则求得的ΔH会___________
④实验中加入过量碱的原因是___________
⑤若通过测定计算出产生的热量为1.42kJ,请写出该反应的热化学方程式:___________ 。
(2)已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4kJ/mol
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为___________ 。
(3)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F-F键能为160kJ·mol-1,S-F键能为330kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式___________ 。
(1)用50mL0.50mol/L的盐酸与50mL0.55mol/L的
 溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和反应反应热。
回答下列问题:(①②③填“偏大”“偏小”或“无影响”)。
①若将杯盖改为薄铁板,则求得的ΔH会
②混合酸、碱溶液时,动作缓慢,则求得的ΔH会
③若将盐酸改为醋酸,则求得的ΔH会
④实验中加入过量碱的原因是
⑤若通过测定计算出产生的热量为1.42kJ,请写出该反应的热化学方程式:
(2)已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ/mol
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4kJ/mol
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
(3)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F-F键能为160kJ·mol-1,S-F键能为330kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式
更新时间:2021-11-08 20:04:29
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】化学反应中常伴随着能量的变化。回答下列问题:
(1)S8分子可形成单斜硫和斜方硫,转化过程为: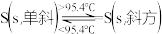 △H=-0.398kJ·mol-1,则S(单斜)与S(斜方)相比,较稳定的是
△H=-0.398kJ·mol-1,则S(单斜)与S(斜方)相比,较稳定的是___________ 。
(2)已知稀溶液中: (1) △H=-57.3·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量
(1) △H=-57.3·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量___________ (填“>”“<”或“=”)57.3kJ。
(3)1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化如图所示:
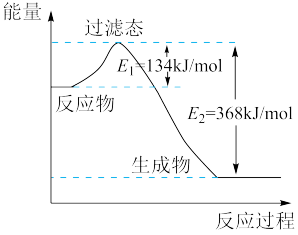
①若在反应体系中加入催化剂,反应速率增大,E1___________ (填“增大”“减小”或“不变”)。
②写出NO2和CO反应的热化学方程式___________ 。
(4)化学家研究出一种新型复合光催化剂(C3N4/CQDS)能利用太阳光高效分解水,原理如图所示。
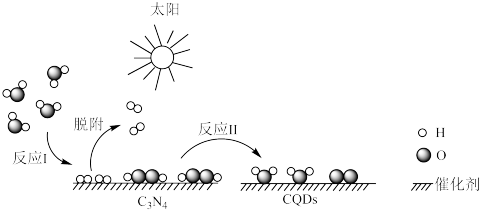
已知断裂1mol化学键所需的能量(kJ):O-H为464、O-O为146、O=O为498。
①写出反应Ⅱ的热化学方程式___________ 。
②设总反应的反应热为△H,反应I的反应热为△H1,则△H___________ (填“>”、“<”或“=”)△H1.
(1)S8分子可形成单斜硫和斜方硫,转化过程为:
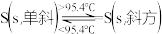 △H=-0.398kJ·mol-1,则S(单斜)与S(斜方)相比,较稳定的是
△H=-0.398kJ·mol-1,则S(单斜)与S(斜方)相比,较稳定的是(2)已知稀溶液中:
 (1) △H=-57.3·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量
(1) △H=-57.3·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1mol水,放出的热量(3)1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化如图所示:

①若在反应体系中加入催化剂,反应速率增大,E1
②写出NO2和CO反应的热化学方程式
(4)化学家研究出一种新型复合光催化剂(C3N4/CQDS)能利用太阳光高效分解水,原理如图所示。

已知断裂1mol化学键所需的能量(kJ):O-H为464、O-O为146、O=O为498。
①写出反应Ⅱ的热化学方程式
②设总反应的反应热为△H,反应I的反应热为△H1,则△H
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。请回答下列问题:
(1)工业催化氧化SO2制备SO3的反应2SO2(g)+O2(g) 2SO3(g)是放热的可逆反应,反应条件是高温、常压,并且需要合适的催化剂。已知1molSO2(g)完全转化为SO3(g)可放出98.3kJ热量。如果将5molSO2(g)和足量O2(g)混合,使其充分反应,放出的热量
2SO3(g)是放热的可逆反应,反应条件是高温、常压,并且需要合适的催化剂。已知1molSO2(g)完全转化为SO3(g)可放出98.3kJ热量。如果将5molSO2(g)和足量O2(g)混合,使其充分反应,放出的热量____ (填“大于”、“小于”或“等于”)491.5kJ。
(2)实验室模拟工业催化氧化SO2制备SO3,在容积为2L的恒容密闭容器内进行,反应经过10min,生成8molSO3。
①用O2表示的化学反应速率为____ 。
②一定条件下,能说明该反应进行到最大限度的是____ (填标号)。
a.SO2的转化率达到最大值
b.体系内气体的密度保持不变
c.SO2、O2和SO3的体积分数之比为2:1:2
d.体系内物质的平均相对分子质量保持不变
(3)C、CO、CH4完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g) △H=-393.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-565.2kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-889.6kJ·mol-1
完全燃烧等物质的量的上述物质,放出的热量由大到小的顺序为____ 。
完全燃烧等质量的上述物质,放出的热量由大到小的顺序为____ 。
完全燃烧等物质的量的上述物质,需要的空气体积由大到小的顺序为____ 。
(4)25℃、101kPa时,16gN2H4(l)在足量的O2(g)中充分燃烧生成N2(g)和H2O(g),放出271.5kJ热量,写出N2H4(l)和O2(g)反应的热化学方程式:____ 。
(1)工业催化氧化SO2制备SO3的反应2SO2(g)+O2(g)
 2SO3(g)是放热的可逆反应,反应条件是高温、常压,并且需要合适的催化剂。已知1molSO2(g)完全转化为SO3(g)可放出98.3kJ热量。如果将5molSO2(g)和足量O2(g)混合,使其充分反应,放出的热量
2SO3(g)是放热的可逆反应,反应条件是高温、常压,并且需要合适的催化剂。已知1molSO2(g)完全转化为SO3(g)可放出98.3kJ热量。如果将5molSO2(g)和足量O2(g)混合,使其充分反应,放出的热量(2)实验室模拟工业催化氧化SO2制备SO3,在容积为2L的恒容密闭容器内进行,反应经过10min,生成8molSO3。
①用O2表示的化学反应速率为
②一定条件下,能说明该反应进行到最大限度的是
a.SO2的转化率达到最大值
b.体系内气体的密度保持不变
c.SO2、O2和SO3的体积分数之比为2:1:2
d.体系内物质的平均相对分子质量保持不变
(3)C、CO、CH4完全燃烧的热化学方程式分别为:
C(s)+O2(g)=CO2(g) △H=-393.6kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-565.2kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-889.6kJ·mol-1
完全燃烧等物质的量的上述物质,放出的热量由大到小的顺序为
完全燃烧等质量的上述物质,放出的热量由大到小的顺序为
完全燃烧等物质的量的上述物质,需要的空气体积由大到小的顺序为
(4)25℃、101kPa时,16gN2H4(l)在足量的O2(g)中充分燃烧生成N2(g)和H2O(g),放出271.5kJ热量,写出N2H4(l)和O2(g)反应的热化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As是33号元素,在元素周期表中的位置是________ 。
(2)N元素非金属性比As强,下列说法正确的是_______
①热稳定性:NH3<AsH3
②酸性:HNO3>H3AsO4
③原子半径:N<As
(3)请依据如图信息写出As2O5分解为As2O3的热化学方程式_______ 。

(4)查阅文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如图:

已知:As2S3不溶于水;As2O3微溶于水。
①As2S3、Na3AsS3中的硫元素均为-2价,碱浸过程中发生的反应______ (填“是”或“不是”)氧化还原反应。
②过程Ⅲ的离子方程式为_______ 。
③过程Ⅲ得到纯净As2O3固体的系列操作包括_____ 、_____ 、_____ 。
④过程Ⅲ中,其它条件相同时仅改变溶液pH,发现酸性越强,As2O3的产率越高,可能的原因是_______ 。
(1)As是33号元素,在元素周期表中的位置是
(2)N元素非金属性比As强,下列说法正确的是
①热稳定性:NH3<AsH3
②酸性:HNO3>H3AsO4
③原子半径:N<As
(3)请依据如图信息写出As2O5分解为As2O3的热化学方程式

(4)查阅文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如图:

已知:As2S3不溶于水;As2O3微溶于水。
①As2S3、Na3AsS3中的硫元素均为-2价,碱浸过程中发生的反应
②过程Ⅲ的离子方程式为
③过程Ⅲ得到纯净As2O3固体的系列操作包括
④过程Ⅲ中,其它条件相同时仅改变溶液pH,发现酸性越强,As2O3的产率越高,可能的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.某实验小组用 的
的 溶液和
溶液和 的硫酸溶液进行中和反应反应热测定实验。
的硫酸溶液进行中和反应反应热测定实验。
(1)取 溶液和
溶液和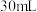 硫酸溶液进行实验,测得的实验数据如表。
硫酸溶液进行实验,测得的实验数据如表。
①请填写下表中的空白:
②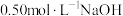 溶液和
溶液和 硫酸溶液的密度均近似为
硫酸溶液的密度均近似为 ,中和后生成的溶液比热容
,中和后生成的溶液比热容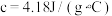 。则测得生成
。则测得生成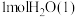 的热量为
的热量为_____________  (取小数点后一位)。
(取小数点后一位)。
③上述实验数值结果比正常值偏小,产生偏差的原因可能是_____________ (填字母)。
A.实验装置保温、隔热效果差
B.量取 溶液的体积时仰视读数
溶液的体积时仰视读数
C.分多次把 溶液倒入盛有硫酸的小烧杯中
溶液倒入盛有硫酸的小烧杯中
D.用温度计测定 溶液起始温度后直接测定
溶液起始温度后直接测定 溶液的温度
溶液的温度
(2)现将一定量稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别与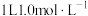 的稀硫酸恰好完全反应,其反应热分别为
的稀硫酸恰好完全反应,其反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 由大到小关系为
由大到小关系为_____________ 。
Ⅱ.测定晶体中 的含量:称取
的含量:称取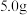 样品,配成
样品,配成 溶液。量取
溶液。量取 溶液加入锥形中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用
溶液加入锥形中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用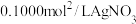 标准溶液滴定,达到滴定终点,三次滴定平均消耗
标准溶液滴定,达到滴定终点,三次滴定平均消耗 标准溶液
标准溶液 。
。
(3)①滴定时发生的反应: (白色),则指示剂的化学式为
(白色),则指示剂的化学式为_____________ (填序号)。
A. B.
B. C.
C. D.
D.
②晶体中 的质量分数为
的质量分数为_____________ (计算结果保留三位有效数字)。
 的
的 溶液和
溶液和 的硫酸溶液进行中和反应反应热测定实验。
的硫酸溶液进行中和反应反应热测定实验。(1)取
 溶液和
溶液和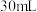 硫酸溶液进行实验,测得的实验数据如表。
硫酸溶液进行实验,测得的实验数据如表。①请填写下表中的空白:
| 温度/实验次数 | 起始温度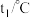 | 终止温度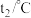 | 温度差平均值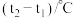 | ||
 |  | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
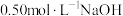 溶液和
溶液和 硫酸溶液的密度均近似为
硫酸溶液的密度均近似为 ,中和后生成的溶液比热容
,中和后生成的溶液比热容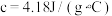 。则测得生成
。则测得生成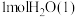 的热量为
的热量为 (取小数点后一位)。
(取小数点后一位)。③上述实验数值结果比正常值偏小,产生偏差的原因可能是
A.实验装置保温、隔热效果差
B.量取
 溶液的体积时仰视读数
溶液的体积时仰视读数C.分多次把
 溶液倒入盛有硫酸的小烧杯中
溶液倒入盛有硫酸的小烧杯中D.用温度计测定
 溶液起始温度后直接测定
溶液起始温度后直接测定 溶液的温度
溶液的温度(2)现将一定量稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别与
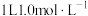 的稀硫酸恰好完全反应,其反应热分别为
的稀硫酸恰好完全反应,其反应热分别为 、
、 、
、 ,则
,则 、
、 、
、 由大到小关系为
由大到小关系为Ⅱ.测定晶体中
 的含量:称取
的含量:称取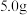 样品,配成
样品,配成 溶液。量取
溶液。量取 溶液加入锥形中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用
溶液加入锥形中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用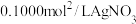 标准溶液滴定,达到滴定终点,三次滴定平均消耗
标准溶液滴定,达到滴定终点,三次滴定平均消耗 标准溶液
标准溶液 。
。(3)①滴定时发生的反应:
 (白色),则指示剂的化学式为
(白色),则指示剂的化学式为A.
 B.
B. C.
C. D.
D.
②晶体中
 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
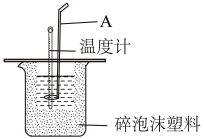
(1)大小烧杯中填充泡沫塑料的作用是___ 。
(2)仪器A的名称是__ ;在实验过程中,如果不把温度计上的酸用水冲洗干净就直接测量NaOH溶液的温度,则测得的ΔH__ (填“偏大”“偏小”或“无影响”)。
(3)取50mL0.50mol·L-1NaOH溶液和50mL0.25mol·L-1硫酸溶液进行实验,实验数据如表。
①请填写下表中的空白:
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液的密度都是1g/cm3中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=__ (取小数点后一位)。
③大烧杯上如不盖硬纸板,则求得的中和热数值__ (填“偏大”、“偏小”或“无影响”)。
(4)实验中若改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量__ (填“相等”或“不相等”),所求中和热的数值__ (填“相等”或“不相等”)。

(1)大小烧杯中填充泡沫塑料的作用是
(2)仪器A的名称是
(3)取50mL0.50mol·L-1NaOH溶液和50mL0.25mol·L-1硫酸溶液进行实验,实验数据如表。
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.3 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.0 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.6 | |
③大烧杯上如不盖硬纸板,则求得的中和热数值
(4)实验中若改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】50mL0.5mol/L的盐酸与50mL0.55moL/L 的 NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

回答问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器,这种玻璃仪器的名称是_____ ;能否改用铁丝________ (填“能、否”),原因是____ ;
(2)烧杯间填满碎泡沫塑料的作用是_____ ;实验时氢氧化钠溶液的浓度要用 0.55 mol/L 的原因是:_____________ 。
(3)实验中改用 60mL0.50moL/L 盐酸跟 50mL0.55moL/L 的 NaOH 溶液进行反应,与上述实验相比,所放出的热量____ (填“偏大”“相等”或“偏小”),所求中和热_______ (填“相等”或“不相等”)。
(4) 若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同, 而终止温度与起始温度差分别为①3.1℃②3.2℃ ③2.7℃,则最终代入计算式的温差均值为______ ℃ (保留 2 位小数)
(5)近似地认为 0.55mol/L NaOH 溶液和 0.5mol/L 盐酸密度都是 1 g/cm3,中和后生成溶液的比热容 c=4.18 J/(g·℃), 则中和热ΔH=_____ kJ/moL (取小数点后一位)
(6)上述实验数值结果与 57.3 kJ/mol 相比偏小,产生偏差的原因可能是(填字母)___________
a.实验装置保温、隔热效果差
b.配制 0.55 mol/L NaOH 溶液定容时俯视刻度线读数
c.分多次把 NaOH 溶液倒入盛有盐酸的小烧杯中
d.用温度计测定 NaOH 溶液起始温度后直接测定盐酸溶液的温度
e.用量筒量取盐酸溶液的体积时仰视读数

回答问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器,这种玻璃仪器的名称是
(2)烧杯间填满碎泡沫塑料的作用是
(3)实验中改用 60mL0.50moL/L 盐酸跟 50mL0.55moL/L 的 NaOH 溶液进行反应,与上述实验相比,所放出的热量
(4) 若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同, 而终止温度与起始温度差分别为①3.1℃②3.2℃ ③2.7℃,则最终代入计算式的温差均值为
(5)近似地认为 0.55mol/L NaOH 溶液和 0.5mol/L 盐酸密度都是 1 g/cm3,中和后生成溶液的比热容 c=4.18 J/(g·℃), 则中和热ΔH=
(6)上述实验数值结果与 57.3 kJ/mol 相比偏小,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.配制 0.55 mol/L NaOH 溶液定容时俯视刻度线读数
c.分多次把 NaOH 溶液倒入盛有盐酸的小烧杯中
d.用温度计测定 NaOH 溶液起始温度后直接测定盐酸溶液的温度
e.用量筒量取盐酸溶液的体积时仰视读数
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】亚硝酰氯(ClNO)是有机合成中的重要试剂, 工业上可用 NO 与Cl2合成:
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及反应的热化学方程式和平衡常数如表:
则Δ H3=___________ (用Δ H1、Δ H2表示); K3=___________ (用 K1、K2表示)。
(2)300℃时,在一密闭容器中发生反应:2ClNO(g) 2NO(g)+Cl2 (g),其正反应速率表达式
2NO(g)+Cl2 (g),其正反应速率表达式 正=k·Cn(ClNO)。测得正反应速率和对应浓度的数据如表:
正=k·Cn(ClNO)。测得正反应速率和对应浓度的数据如表:
则n=___________ ,k=___________ 。
(3)25℃时,向体积为2L且带气压计的恒容密闭容器中通入 0.08mol NO 和 0.04mol Cl2,发生反应: 2NO(g)+Cl2 (g) 2ClNO(g) Δ H。
2ClNO(g) Δ H。

已知:反应起始和平衡时温度相同。
①测得反应过程中压强(p)随时间(t)的变化如图曲线 a 所示,则Δ H___________ 0(填“>”“<” 或“不确定”);若其他条件相同,仅改变某一条件时,测得压强(p)随时间(t)的变化如图曲线b所示,则改变的条件是___________ 。
②求该温度下反应的压强平衡常数Kp,写出计算过程___________ 。(注:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及反应的热化学方程式和平衡常数如表:
| 反应 | 热化学方程式 | 平衡常数 |
| ① | 2NO2(g)+ NaCl(s)  NaNO3(s) + ClNO(g) Δ H1 NaNO3(s) + ClNO(g) Δ H1 | K1 |
| ② | 4NO2(g)+ 2NaCl(s)  2NaNO3(s) + 2NO(g)+Cl2(g) Δ H2 2NaNO3(s) + 2NO(g)+Cl2(g) Δ H2 | K2 |
| ③ | 2NO(g)+ Cl2(g)  2ClNO(g) Δ H3 2ClNO(g) Δ H3 | K3 |
(2)300℃时,在一密闭容器中发生反应:2ClNO(g)
 2NO(g)+Cl2 (g),其正反应速率表达式
2NO(g)+Cl2 (g),其正反应速率表达式 正=k·Cn(ClNO)。测得正反应速率和对应浓度的数据如表:
正=k·Cn(ClNO)。测得正反应速率和对应浓度的数据如表:| 序号 | c(ClNO)/(mol ·L-1) |  正/(mol ·L-1·s-1) 正/(mol ·L-1·s-1) |
| ① | 0.30 | 3.60×10−9 |
| ② | 0.60 | 1.44×10−8 |
| ③ | 0.90 | 3.24×10−8 |
(3)25℃时,向体积为2L且带气压计的恒容密闭容器中通入 0.08mol NO 和 0.04mol Cl2,发生反应: 2NO(g)+Cl2 (g)
 2ClNO(g) Δ H。
2ClNO(g) Δ H。
已知:反应起始和平衡时温度相同。
①测得反应过程中压强(p)随时间(t)的变化如图曲线 a 所示,则Δ H
②求该温度下反应的压强平衡常数Kp,写出计算过程
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】煤的主要组成元素是碳、氢、氧、硫、氮,燃煤产生CxHy、SO2等大气污染物,煤的气化是高效、清洁利用煤炭的重要途径之一。回答下列问题:
(1)利用煤的气化获得的水煤气( 主要成分为CO、CO2和H2 )在催化剂作用下可以合成绿色燃料甲醇。
已知: H2O(1) = H2O(g) ΔH1= +44 .0kJ/mol
CO2(g)+H2(g) = CO(g)+H2O(l) ΔH2=-3.0kJ/mol
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH3=-58.7 kJ/mol
写出由CO与H2制备CH3OH 气体的热化学方程式____________ 。
(2)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3简称DMC) ;
2CH3OH(g)+CO2(g)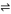 CH3OCOOCH3(g)+H2O(g) ΔH4<0
CH3OCOOCH3(g)+H2O(g) ΔH4<0
①该化学反应的平衡常数表达式为K=__________
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是________ (填编号)。
A.V正(CH3OH)= 2V逆(H2O)
B.容器内气体的密度不变
C.容器内压强不变
D.CH3OH与CO2的物质的量之比保持不变
(3)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如图所示:
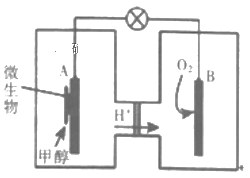
A极是_____ 极(填“正”或“负”),其电极反应式是_______ 。该电池不能在高温下工作的理由是________ 。
(4)一定条件下,在体积为5 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)根据题意完成下列各题:
CH3OH(g)根据题意完成下列各题:
①在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________
②在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_____
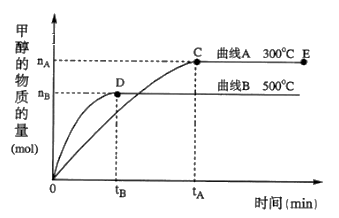
A.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加
d. 重新平衡时n(H2)/n(CH3OH)增大
(1)利用煤的气化获得的水煤气( 主要成分为CO、CO2和H2 )在催化剂作用下可以合成绿色燃料甲醇。
已知: H2O(1) = H2O(g) ΔH1= +44 .0kJ/mol
CO2(g)+H2(g) = CO(g)+H2O(l) ΔH2=-3.0kJ/mol
CO2(g)+3H2(g) = CH3OH(g)+H2O(g) ΔH3=-58.7 kJ/mol
写出由CO与H2制备CH3OH 气体的热化学方程式
(2)甲醇和CO2可直接合成碳酸二甲酯(CH3OCOOCH3简称DMC) ;
2CH3OH(g)+CO2(g)
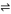 CH3OCOOCH3(g)+H2O(g) ΔH4<0
CH3OCOOCH3(g)+H2O(g) ΔH4<0①该化学反应的平衡常数表达式为K=
②在恒温恒容密闭容器中发生上述反应,能说明反应达到平衡状态的是
A.V正(CH3OH)= 2V逆(H2O)
B.容器内气体的密度不变
C.容器内压强不变
D.CH3OH与CO2的物质的量之比保持不变
(3)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如图所示:

A极是
(4)一定条件下,在体积为5 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
 CH3OH(g)根据题意完成下列各题:
CH3OH(g)根据题意完成下列各题:①在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
②在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是

A.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加
d. 重新平衡时n(H2)/n(CH3OH)增大
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】诺贝尔化学奖获得者GeorgeA.Olah提出了“甲醇经济”的概念,他建议用甲醇来代替目前广泛使用的化石燃料。工业上用天然气为原料,分为两个阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH=-90.67 kJ·mol-1
CH3OH(g) ΔH=-90.67 kJ·mol-1
回答下列问题:
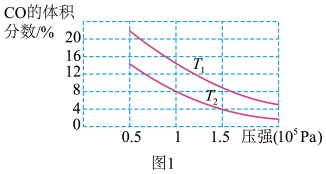
(1)制备合成气反应中,平衡混合物中CO的体积分数与压强的关系如图1所示,判断T1和T2的大小关系:T1_______ T2(填“<”或“=”),理由是_______ 。
(2)工业生产中为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1,为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为
CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1,为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为_______ 。
(3)在体积不变的密闭容器中投入0.5 mol CO和1 mol H2,不同条件下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
CH3OH(g) ΔH。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
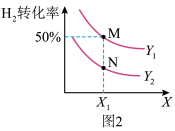
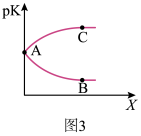
①图2中X代表_______ (填“温度”或“压强”)。图3中正确表示该反应的平衡常数的负对数pK(pK=-lgK)与X的关系的曲线_______ (填“AC”或“AB”)。
②若图2中M点对应的容器体积为5 L,此时容器的压强为b kPa,则N点的压强平衡常数Kp为_______ 。
(4)为节约化石能源,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成甲醇和水蒸气的热化学方程式为_______ 。
②研究表明在二氧化碳合成甲醇的原料气中加入CO可以降低CO2与H2反应的活化能。在200~360℃、9MPa时,合成气初始组成H2、CO、CO2物质的量之比为7:2:1的条件下研究甲醇的合成反应(如图所示)。
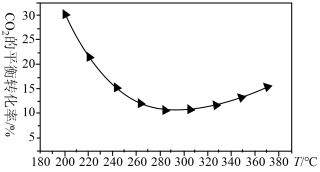
CO2的平衡转化率随温度的升高先减小后增大,请分析可能的原因_______ 。
(i)制备合成气:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1(ii)合成甲醇:CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.67 kJ·mol-1
CH3OH(g) ΔH=-90.67 kJ·mol-1回答下列问题:
(1)制备合成气反应中,平衡混合物中CO的体积分数与压强的关系如图1所示,判断T1和T2的大小关系:T1

(2)工业生产中为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1,为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为
CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1,为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为(3)在体积不变的密闭容器中投入0.5 mol CO和1 mol H2,不同条件下发生反应:CO(g)+2H2(g)
 CH3OH(g) ΔH。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
CH3OH(g) ΔH。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
①图2中X代表

②若图2中M点对应的容器体积为5 L,此时容器的压强为b kPa,则N点的压强平衡常数Kp为
(4)为节约化石能源,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成甲醇和水蒸气的热化学方程式为
②研究表明在二氧化碳合成甲醇的原料气中加入CO可以降低CO2与H2反应的活化能。在200~360℃、9MPa时,合成气初始组成H2、CO、CO2物质的量之比为7:2:1的条件下研究甲醇的合成反应(如图所示)。

CO2的平衡转化率随温度的升高先减小后增大,请分析可能的原因
您最近一年使用:0次



