下列说法不正确 的是
| A.影响化学反应速率的主要因素是反应物的组成、结构和性质 |
| B.活化分子之间发生的碰撞一定是有效碰撞 |
| C.所有活化分子的平均能量高于所有分子的平均能量 |
| D.升高温度能加快反应速率是因为反应物分子中活化分子的百分数增加 |
更新时间:2022-01-21 17:36:48
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列关于有效碰撞理论的说法正确的是
| A.加入催化剂,可以降低活化能,活化分子百分数虽然不变,但反应速率会增加 |
| B.通过压缩气体的体积增大压强,可提高单位体积内活化分子数,从而提高反应速率 |
| C.增大反应物浓度,活化分子百分数增大,反应速率加快 |
| D.其他条件不变,升高温度,一定增大活化分子百分数,但不一定加快反应速率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】合成氨的化学反应为N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ·mol-1.最近,吉林大学与韩国、加拿大科研人员合作研究,提出基于机械化学(“暴力”干扰使铁活化)在温和条件下由氮气合成氨的新方案(过程如图所示),利用这种方案所得氨的体积分数最终可高达82.5%。下列有关分析错误的是
2NH3(g) △H=-92.4 kJ·mol-1.最近,吉林大学与韩国、加拿大科研人员合作研究,提出基于机械化学(“暴力”干扰使铁活化)在温和条件下由氮气合成氨的新方案(过程如图所示),利用这种方案所得氨的体积分数最终可高达82.5%。下列有关分析错误的是

 2NH3(g) △H=-92.4 kJ·mol-1.最近,吉林大学与韩国、加拿大科研人员合作研究,提出基于机械化学(“暴力”干扰使铁活化)在温和条件下由氮气合成氨的新方案(过程如图所示),利用这种方案所得氨的体积分数最终可高达82.5%。下列有关分析错误的是
2NH3(g) △H=-92.4 kJ·mol-1.最近,吉林大学与韩国、加拿大科研人员合作研究,提出基于机械化学(“暴力”干扰使铁活化)在温和条件下由氮气合成氨的新方案(过程如图所示),利用这种方案所得氨的体积分数最终可高达82.5%。下列有关分析错误的是
| A.铁是该合成氨反应的催化剂 | B.采用该方案生产氨气,活化能不变 |
| C.采用该方案生产氨气,△H不变 | D.该方案氨的含量高,与反应温度较低有关 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
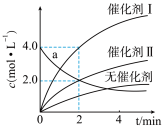
【推荐1】在相同条件下研究催化剂I、II对反应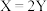 的影响,各物质浓度c随反应时间t的部分变化曲线如图,则下列说法
的影响,各物质浓度c随反应时间t的部分变化曲线如图,则下列说法不正确 的是
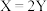 的影响,各物质浓度c随反应时间t的部分变化曲线如图,则下列说法
的影响,各物质浓度c随反应时间t的部分变化曲线如图,则下列说法
| A.催化剂I、II相比,I使反应活化能更低 |
B.使用催化剂I,反应时间为 时,X的转化率为 时,X的转化率为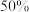 |
| C.a曲线表示使用催化剂II时X的浓度随t的变化 |
D.使用催化剂II时,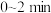 内, 内,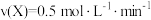 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】“接触法制硫酸”的主要反应2SO2+O2 2SO3在催化剂表面的反应历程如下:
2SO3在催化剂表面的反应历程如下:
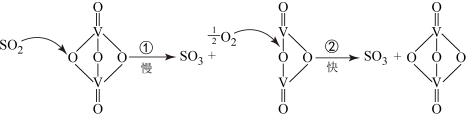
下列说法错误的是
 2SO3在催化剂表面的反应历程如下:
2SO3在催化剂表面的反应历程如下:
下列说法错误的是
| A.使用上述催化剂能加快正逆反应速率 |
| B.反应②的活化能比反应①大 |
| C.过程中既有V-O键的断裂,也有V-O键的形成 |
| D.该反应的催化剂是V2O5 |
您最近一年使用:0次



