硫酸铁铵[化学式可表示为NH4Fe(SO4)2]可用作分析试剂等。某兴趣小组利用铁矿石(主要成分为FeO、Fe2O3 )制硫酸铁铵的流程如下:
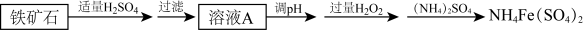
回答下列问题:
(1)溶液A中所含金属阳离子有___________ 。
(2)写出FeO与稀硫酸反应的离子方程式:___________ 。
(3)加入H2O2的作用是___________ 。
(4)若想探究NH4Fe(SO4)2与Ba(OH)2反应生成最大质量沉淀的条件,某同学向含a molNH4Fe(SO4)2的溶液中滴加含b mol Ba(OH)2的溶液,与OH-反应的顺序:先是Fe3+,后是NH ,当a=b时,发生的离子反应为
,当a=b时,发生的离子反应为___________ ,当b=1. 5a时,反应后溶液中NH 与SO
与SO 的浓度之比为
的浓度之比为___________ ,当___________ 时,沉淀的质量达到最大。
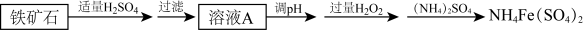
回答下列问题:
(1)溶液A中所含金属阳离子有
(2)写出FeO与稀硫酸反应的离子方程式:
(3)加入H2O2的作用是
(4)若想探究NH4Fe(SO4)2与Ba(OH)2反应生成最大质量沉淀的条件,某同学向含a molNH4Fe(SO4)2的溶液中滴加含b mol Ba(OH)2的溶液,与OH-反应的顺序:先是Fe3+,后是NH
 ,当a=b时,发生的离子反应为
,当a=b时,发生的离子反应为 与SO
与SO 的浓度之比为
的浓度之比为
更新时间:2022-01-20 23:24:37
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】叠氮化钠( NaN3)是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
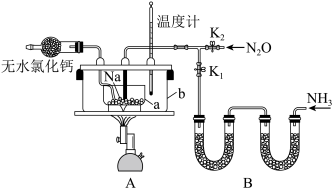
①关闭止水夹K2,打开止水夹K1,开始通入氨气;
②加热装置a中的金属钠,使其熔化并充分反应后,生成白色固体NaNH2,停止通入氨气并关闭止水夹K1;
③打开止水夹K2,通入N2O,继续加热a容器到210 ~220℃ ,充分反应;
④冷却,向产物中加入……
⑤过滤……
已知:NaNH2熔点210℃,沸点400℃,在水溶液中易水解生成NaOH和氨气。请回答下列问题:
(1)图中仪器a用不锈钢材质而不用玻璃,其主要原因是_______ 。
(2)N2O可由NH4NO3(熔点169.6℃)在185 ~ 200℃分解制得,最好选用的气体发生装置是_______ (填标号)。

(3)生成步骤③中生成NaN3的化学方程式_______ 。
(4)反应结束后,进行以下操作,得到NaN3固体:
a中混合物固体
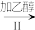

 NaN3固体
NaN3固体
操作Ⅱ的目的是_______ ,操作Ⅳ最好选用的试剂是_______ 。
(5)实验室中,多余的NaN3常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。请写出该反应的离子方程式_______ 。
(6)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500. 00mL溶液。
②取50.00mL溶液置于锥形瓶中,用滴定管加入50.00mL0.1000mol·L-1(NH4)2Ce(NO3)6溶液。发生反应:2(NH4)2Ce(NO3)6+ 2NaN3 =4NH4NO3 +2Ce( NO3)3 +2NaNO3 +3N2↑。
③充分反应后,将溶液稀释,酸化后滴入3滴邻菲罗琳指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为34. 00mL。发生反应:Ce 4+Fe2+ = Ce3+ +Fe3+。
试样中NaN3的质量分数为_______ (保留4位有效数字)。
(7)若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是_______(填字母)。

①关闭止水夹K2,打开止水夹K1,开始通入氨气;
②加热装置a中的金属钠,使其熔化并充分反应后,生成白色固体NaNH2,停止通入氨气并关闭止水夹K1;
③打开止水夹K2,通入N2O,继续加热a容器到210 ~220℃ ,充分反应;
④冷却,向产物中加入……
⑤过滤……
已知:NaNH2熔点210℃,沸点400℃,在水溶液中易水解生成NaOH和氨气。请回答下列问题:
(1)图中仪器a用不锈钢材质而不用玻璃,其主要原因是
(2)N2O可由NH4NO3(熔点169.6℃)在185 ~ 200℃分解制得,最好选用的气体发生装置是

(3)生成步骤③中生成NaN3的化学方程式
(4)反应结束后,进行以下操作,得到NaN3固体:
a中混合物固体


 NaN3固体
NaN3固体操作Ⅱ的目的是
(5)实验室中,多余的NaN3常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。请写出该反应的离子方程式
(6)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:
①将2.500g试样配成500. 00mL溶液。
②取50.00mL溶液置于锥形瓶中,用滴定管加入50.00mL0.1000mol·L-1(NH4)2Ce(NO3)6溶液。发生反应:2(NH4)2Ce(NO3)6+ 2NaN3 =4NH4NO3 +2Ce( NO3)3 +2NaNO3 +3N2↑。
③充分反应后,将溶液稀释,酸化后滴入3滴邻菲罗琳指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为34. 00mL。发生反应:Ce 4+Fe2+ = Ce3+ +Fe3+。
试样中NaN3的质量分数为
(7)若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是_______(填字母)。
| A.滴加六硝酸铈铵溶液入锥形瓶时,滴加前仰视读数,滴加后俯视读数 |
| B.锥形瓶使用叠氮化钠溶液润洗 |
| C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡 |
| D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】在进行钠和水的反应实验中,有如下操作和实验现象,回答下列各问题。
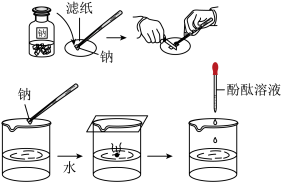
(1)金属钠保存在_____ 中。
(2)金属钠块投入水中后,观察到_____ (说明反应放热)。
(3)钠小球在水面上迅速游动,发出“嘶嘶”的声响,如果水中事先已滴入酚酞溶液,反应后溶液由无色变为_____ 色。
(4)发生的离子方程式为:_____ 。
(5)纯碱和小苏打都是重要的化工原料,根据不列三组实验,回答:
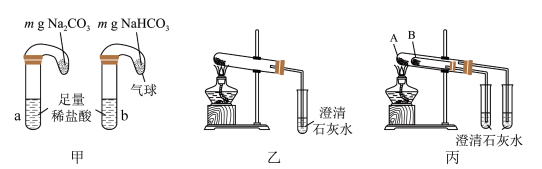
①甲组实验能鉴别纯碱和小苏打的实验现象是_____ 。
②乙、丙两组实验中,_____ 组能更便捷的验证两者的热稳定性(填“乙”或“丙”),丙组实验中 处盛放的物质为
处盛放的物质为_____ (填化学式)。

(1)金属钠保存在
(2)金属钠块投入水中后,观察到
(3)钠小球在水面上迅速游动,发出“嘶嘶”的声响,如果水中事先已滴入酚酞溶液,反应后溶液由无色变为
(4)发生的离子方程式为:
(5)纯碱和小苏打都是重要的化工原料,根据不列三组实验,回答:

①甲组实验能鉴别纯碱和小苏打的实验现象是
②乙、丙两组实验中,
 处盛放的物质为
处盛放的物质为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某研究性学习小组对亚硫酸钠的组成及性质进行探究。
(1)向Na2SO3溶液中滴加少量Na2S溶液无明显现象,继续滴加适量稀硫酸,有沉淀生成。
①该反应说明Na2SO3具有_______ (填“氧化性”或“还原性”),反应的离子方程式为_______ 。
②查资料知H2SO3是二元弱酸,Ka1=1.2×10-2,Ka2=6.3×10-8.判断NaHSO3溶液显_______ (填“酸性”、“碱性”或“中性”)。
(2)经分析,Na2SO3溶液在存放过程中有可能变质。甲同学设计了如下两种方案来检验Na2SO3溶液是否变质。
方案1:取样,加入稀盐酸有气泡生成,认为Na2SO3溶液没有变质。
方案2:取样,加入BaCl2溶液有白色沉淀生成,认为Na2SO3溶液完全变质。
乙同学认为上述两种方案均不合理。乙同学对方案2作出判断的依据是_______ 。
(3)丙同学设计了下图所示的实验装置(夹持装置已略去),测定Na2SO3溶液变质的百分率(变质的百分率=已变质的亚硫酸钠质量/溶液中亚硫酸钠的总质量×100%)。
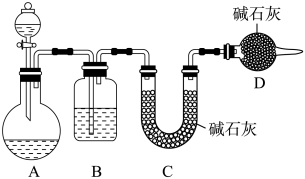
量取60mL标签上注明为1.0mol·L-1的Na2SO3溶液放入A装置中,进行实验。
①D装置的作用是_______ ;缺少B装置,测定的变质的百分率将会_______ (填“偏高”、“偏低”或“不变”)。
②该实验装置中存在的明显缺陷是_______ 。改进缺陷后再进行实验,若实验前后测得C装置增重3.2g,则Na2SO3变质的百分率为_______ 。
(1)向Na2SO3溶液中滴加少量Na2S溶液无明显现象,继续滴加适量稀硫酸,有沉淀生成。
①该反应说明Na2SO3具有
②查资料知H2SO3是二元弱酸,Ka1=1.2×10-2,Ka2=6.3×10-8.判断NaHSO3溶液显
(2)经分析,Na2SO3溶液在存放过程中有可能变质。甲同学设计了如下两种方案来检验Na2SO3溶液是否变质。
方案1:取样,加入稀盐酸有气泡生成,认为Na2SO3溶液没有变质。
方案2:取样,加入BaCl2溶液有白色沉淀生成,认为Na2SO3溶液完全变质。
乙同学认为上述两种方案均不合理。乙同学对方案2作出判断的依据是
(3)丙同学设计了下图所示的实验装置(夹持装置已略去),测定Na2SO3溶液变质的百分率(变质的百分率=已变质的亚硫酸钠质量/溶液中亚硫酸钠的总质量×100%)。

量取60mL标签上注明为1.0mol·L-1的Na2SO3溶液放入A装置中,进行实验。
①D装置的作用是
②该实验装置中存在的明显缺陷是
您最近一年使用:0次
【推荐1】化合物A由三种元素组成,是一种矿物的主要成分,可发生如下变化:
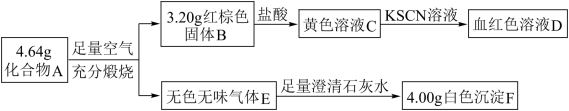
(1)A的化学式为___________ 。
(2)含化合物A的浊液长时间暴露在空气,会有部分固体表面变为红褐色,该红褐色物质的化学式为___________ 。
(3)化合物A在空气中充分煅烧的化学方程式为___________ 。
(4)红棕色固体B与盐酸反应的离子方程式___________ 。

(1)A的化学式为
(2)含化合物A的浊液长时间暴露在空气,会有部分固体表面变为红褐色,该红褐色物质的化学式为
(3)化合物A在空气中充分煅烧的化学方程式为
(4)红棕色固体B与盐酸反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】I.金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物相关知识回答下列问题:
(1)某溶液中有Mg2+、Fe2+、A13+、Cu2+等离子,向其中加入足量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___________。
(2)高铁酸钠(Na2FeO4)是一种新型水处理剂。某兴趣小组欲利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取高铁酸钠并回收金属Cu,其工艺流程如下:
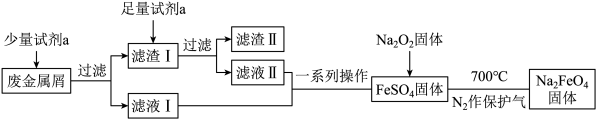
①试剂a为___________ (填化学式,下同),滤渣Ⅱ的主要成分为___________ 。
②在过滤操作中要使用玻璃棒,其作用是___________ 。
③检验滤液I中是否存在Fe3+的试剂是___________ 。
Ⅱ.利用铁元素价类二维图可以多角度研究含铁物质的性质及转化关系,请完成下列问题。
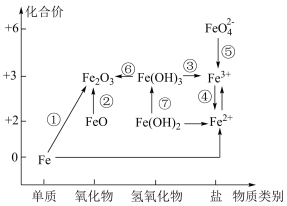
(3)下列说法正确的是___________。
(4)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:___________ 。
(5)K2FeO4常用作杀菌消毒剂,生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O(未配平),则该反应中氧化剂与还原剂的物质的量之比为___________ 。
(1)某溶液中有Mg2+、Fe2+、A13+、Cu2+等离子,向其中加入足量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___________。
| A.Mg2+ | B.Fe2+ | C.A13+ | D.Cu2+ |
(2)高铁酸钠(Na2FeO4)是一种新型水处理剂。某兴趣小组欲利用废金属屑(主要成分为Fe和Cu,含有少量Fe2O3)制取高铁酸钠并回收金属Cu,其工艺流程如下:

①试剂a为
②在过滤操作中要使用玻璃棒,其作用是
③检验滤液I中是否存在Fe3+的试剂是
Ⅱ.利用铁元素价类二维图可以多角度研究含铁物质的性质及转化关系,请完成下列问题。

(3)下列说法正确的是___________。
| A.Fe2O3是碱性氧化物 |
| B.铁与高温水蒸气的反应可实现上述转化① |
| C.FeO是一种黑色粉末,不稳定,在空气中受热,迅速发生转化② |
| D.硫酸亚铁片和维生素C(具有还原性)同时服用能增强治疗缺铁性贫血的效果 |
(4)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
(5)K2FeO4常用作杀菌消毒剂,生产K2FeO4的反应原理是:Fe(NO3)3+KClO+KOH→K2FeO4+KNO3+KCl+H2O(未配平),则该反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】稀土元素在耐热钢中有重要的作用。某废渣含Eu2O3、Fe2O3、Al2O3、Ta2O5、MnO等物质。以此废渣为原料,设计如下工艺流程对资源进行回收,可得到较为纯净的TaCl5(氯化钽)和Eu2O3(氧化铕)。
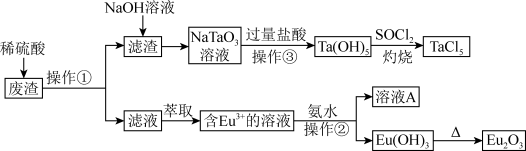
回答下列问题:
(1)操作②为_______ ,溶液A中含有的主要溶质为_______ (填化学名称)。
(2)滤渣与NaOH溶液反应的离子方程式为_______ ,灼烧时发生反应的化学方程式为_______ 。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。流程中为了用萃取剂除去金属杂质离子,进行萃取最适宜的pH是_______ (填字母),其原因是_______ 。
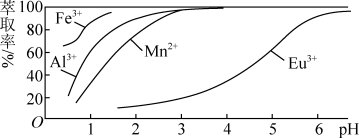
A.2.0左右 B.3.0左右 C.5.0左右
(4)FFC电解法可由金属氧化物直接电解制备金属单质,利用此法可电解Ta2O5制备稀土元素Ta,其原理如图所示。
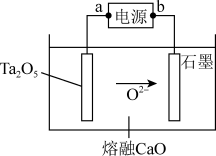
①电源b为_______ (填“正”或“负”)极。
②Ta2O5极发生的电极反应为_______ 。
③工业生产过程中,石墨电极需要定期更换,原因是:_______ 。

回答下列问题:
(1)操作②为
(2)滤渣与NaOH溶液反应的离子方程式为
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。流程中为了用萃取剂除去金属杂质离子,进行萃取最适宜的pH是

A.2.0左右 B.3.0左右 C.5.0左右
(4)FFC电解法可由金属氧化物直接电解制备金属单质,利用此法可电解Ta2O5制备稀土元素Ta,其原理如图所示。

①电源b为
②Ta2O5极发生的电极反应为
③工业生产过程中,石墨电极需要定期更换,原因是:
您最近一年使用:0次



