化学小组欲测定一份长期放置的补铁药品(有效成分是琥珀酸亚铁,化学式为FeC4H4O4)是否已变质,实验如下:
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色。
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色;再滴入3滴H2O2溶液,溶液红色加深。
Ⅲ.准确量取Ⅰ中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g。
Ⅳ.再准确量取Ⅰ中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)Ⅰ中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4___________ HCl(填“>”或“<”)。
(2)用离子方程式解释Ⅱ中实验现象产生的原因:___________ 、Fe3++3SCN−=Fe(SCN)3。
(3)Ⅳ中发生反应的离子方程式是___________ 。
(4)该补铁药中琥珀酸亚铁变质程度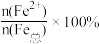 =
=___________ 。
(5)Ⅳ中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是___________ 。
Ⅰ.取补铁药样品10.00g,碾碎,溶于100.0mL稀盐酸中,过滤,滤液呈浅黄绿色。
Ⅱ.取少量滤液,滴加KSCN溶液,溶液变为浅红色;再滴入3滴H2O2溶液,溶液红色加深。
Ⅲ.准确量取Ⅰ中滤液20.00mL,加入足量H2O2溶液,再加入足量NaOH溶液,过滤、洗涤、常温晾干,获得Fe(OH)3固体0.642g。
Ⅳ.再准确量取Ⅰ中滤液20.00mL于大试管中,加入1.00g铜粉,用胶塞塞紧试管口,充分振荡后过滤,最后得到干燥的铜粉0.936g。
(1)Ⅰ中琥珀酸亚铁与稀盐酸反应生成FeCl2和琥珀酸(分子式为C4H6O4),说明酸性:C4H6O4
(2)用离子方程式解释Ⅱ中实验现象产生的原因:
(3)Ⅳ中发生反应的离子方程式是
(4)该补铁药中琥珀酸亚铁变质程度
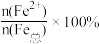 =
=(5)Ⅳ中溶液与铜粉反应时必须使用胶塞塞紧试管口,原因是
更新时间:2022-02-15 08:48:44
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
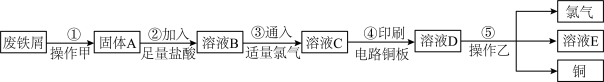
请回答下列问题:
(1)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是________ (填序号)。
A.先加氯水,后加KSCN溶液后显红色
B.先加KSCN溶液,不显红色,再加氯水后显红色
C.④只滴加KSCN溶液不显红色
(2)步骤④的化学方程式为_____________________________ 。
(3)若除去氯化亚铁中氯化铁可以加入试剂________________ 。

请回答下列问题:
(1)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是
A.先加氯水,后加KSCN溶液后显红色
B.先加KSCN溶液,不显红色,再加氯水后显红色
C.④只滴加KSCN溶液不显红色
(2)步骤④的化学方程式为
(3)若除去氯化亚铁中氯化铁可以加入试剂
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】利用废旧铁铜粉可以制备补血剂原料碳酸亚铁和杀菌剂胆矾。流程如下图所示:

回答下列问题:
(1)“滤液1”中一定含有的金属阳离子_______ ,写出检验该金属阳离子的方法_______ 。
(2)过滤用到的玻璃仪器是_______ 。
(3)“溶解1”过程温度不宜过高的原因是_______ 。
(4)向纯净的碳酸亚铁固体中加入足量乳酸溶液,在70℃下搅拌使其充分反应,可得到补铁剂乳酸亚铁。为防止乳酸亚铁变质,在反应体系中应加入少量_______ 。
(5)写出沉淀过程中发生反应的离子方程式_______ 。
(6)向 固体中加入蒸馏水,固体未见明显减少;一段时间后,难溶物上方出现红褐色氢氧化物并有气泡产生。试写出所发生的化学方程式
固体中加入蒸馏水,固体未见明显减少;一段时间后,难溶物上方出现红褐色氢氧化物并有气泡产生。试写出所发生的化学方程式_______ 。
(7)已知 可由煅烧
可由煅烧 获得,其反应为:
获得,其反应为: 。现煅烧
。现煅烧 的纯净的
的纯净的 ,得到
,得到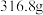 产品,若产品中杂质只有
产品,若产品中杂质只有 ,则该产品中
,则该产品中 的质量是
的质量是_______  。
。

回答下列问题:
(1)“滤液1”中一定含有的金属阳离子
(2)过滤用到的玻璃仪器是
(3)“溶解1”过程温度不宜过高的原因是
(4)向纯净的碳酸亚铁固体中加入足量乳酸溶液,在70℃下搅拌使其充分反应,可得到补铁剂乳酸亚铁。为防止乳酸亚铁变质,在反应体系中应加入少量
(5)写出沉淀过程中发生反应的离子方程式
(6)向
 固体中加入蒸馏水,固体未见明显减少;一段时间后,难溶物上方出现红褐色氢氧化物并有气泡产生。试写出所发生的化学方程式
固体中加入蒸馏水,固体未见明显减少;一段时间后,难溶物上方出现红褐色氢氧化物并有气泡产生。试写出所发生的化学方程式(7)已知
 可由煅烧
可由煅烧 获得,其反应为:
获得,其反应为: 。现煅烧
。现煅烧 的纯净的
的纯净的 ,得到
,得到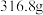 产品,若产品中杂质只有
产品,若产品中杂质只有 ,则该产品中
,则该产品中 的质量是
的质量是 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的工艺流程如下:
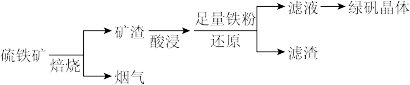
(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式___________ 。
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式___________ 。
(3)滤液中金属阳离子的检验方法___________ 。
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由___________ (结合化学用语说明原因)。
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T。f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:
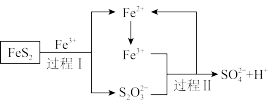
已知总反应为:FeS2+14Fe3++8H2O=2 +15Fe2++16H+
+15Fe2++16H+
将过程I离子方程式补充完整___________ 。
___________FeS2+___________Fe3++___________=7Fe2++___________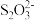 +___________H+
+___________H+
(6)绿矾晶体在空气中易被氧化。取xg样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液bmL。反应原理:6Fe2++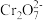 +14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
+14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为___________ 。(FeSO4·7H2O摩尔质量为278g/mol)
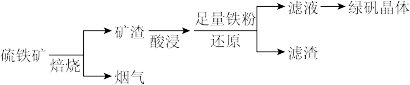
(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式
(3)滤液中金属阳离子的检验方法
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T。f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:

已知总反应为:FeS2+14Fe3++8H2O=2
 +15Fe2++16H+
+15Fe2++16H+将过程I离子方程式补充完整
___________FeS2+___________Fe3++___________=7Fe2++___________
 +___________H+
+___________H+(6)绿矾晶体在空气中易被氧化。取xg样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液bmL。反应原理:6Fe2++
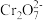 +14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
+14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】高铁酸钾( )是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。
)是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。
资料:①高铁酸钾在低温、碱性环境中稳定,高温、中性和酸性条件下不稳定,易分解生成氧气;
②高铁酸钾易溶于水,不溶于乙醇等有机溶剂;
③高铁酸钾具有强氧化性,且氧化性强于高锰酸钾。
实验室常用次氯酸钠氧化法制备高铁酸钾,具体实验步骤如下:
Ⅰ.用托盘天平称取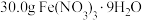 ,另取25.5g NaClO配成100mL溶液;
,另取25.5g NaClO配成100mL溶液;
Ⅱ.在冰水冷却的环境中向NaClO溶液中加入足量NaOH固体,直至无法溶解,得到NaClO的强碱性饱和溶液,缓慢少量分批加入 ,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;
,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;
Ⅲ.继续充分搅拌,向上述反应液中加入固体NaOH至饱和,直至溶液成粘稠状,过滤,得到滤液;
Ⅳ.向上述滤液中加入KOH固体至饱和,过滤、用乙醇洗涤所得固体,在80℃真空条件下烘干得到产品。
回答下列问题:
(1)配制Ⅰ中的NaClO溶液,下列仪器不需要的是___________ (填仪器名称)。___________ 。实验中若以 代替
代替 作铁源,
作铁源, 的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比
的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比 大,使得NaCl结晶去除率较低;另一个原因是
大,使得NaCl结晶去除率较低;另一个原因是___________ 。
(3)Ⅳ中加入KOH固体至饱和的作用是___________ ,说明此温度下
___________ 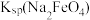 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(4)高铁酸钾溶液在中性条件下不稳定的原因是___________ (用离子方程式解释)。
(5)滴定法测定高铁酸钾样品的纯度,其方法是:称取2.0g产品溶于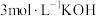 溶液中,加入足量
溶液中,加入足量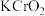 ,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用
,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用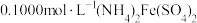 标准溶液滴定至终点,重复操作3次,平均消耗
标准溶液滴定至终点,重复操作3次,平均消耗 溶液的体积为24.00mL。
溶液的体积为24.00mL。
①定容后,加入稀硫酸酸化的目的是___________ ;
②该 产品的纯度为
产品的纯度为___________ (保留三位有效数字)。
 )是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。
)是一种有暗紫色光泽的粉末,极易溶于水而形成浅紫色的溶液。高铁酸钾是一种集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭八大特点为一体的新型、高效、多功能绿色水处理剂。资料:①高铁酸钾在低温、碱性环境中稳定,高温、中性和酸性条件下不稳定,易分解生成氧气;
②高铁酸钾易溶于水,不溶于乙醇等有机溶剂;
③高铁酸钾具有强氧化性,且氧化性强于高锰酸钾。
实验室常用次氯酸钠氧化法制备高铁酸钾,具体实验步骤如下:
Ⅰ.用托盘天平称取
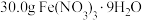 ,另取25.5g NaClO配成100mL溶液;
,另取25.5g NaClO配成100mL溶液;Ⅱ.在冰水冷却的环境中向NaClO溶液中加入足量NaOH固体,直至无法溶解,得到NaClO的强碱性饱和溶液,缓慢少量分批加入
 ,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;
,水浴温度控制在26℃,并不断搅拌1.5h左右,至溶液成深紫红色;Ⅲ.继续充分搅拌,向上述反应液中加入固体NaOH至饱和,直至溶液成粘稠状,过滤,得到滤液;
Ⅳ.向上述滤液中加入KOH固体至饱和,过滤、用乙醇洗涤所得固体,在80℃真空条件下烘干得到产品。
回答下列问题:
(1)配制Ⅰ中的NaClO溶液,下列仪器不需要的是
 代替
代替 作铁源,
作铁源, 的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比
的产率和纯度都会降低的原因之一是在反应温度和强碱环境下NaCl的溶解度比 大,使得NaCl结晶去除率较低;另一个原因是
大,使得NaCl结晶去除率较低;另一个原因是(3)Ⅳ中加入KOH固体至饱和的作用是

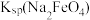 (填“>”“<”或“=”)
(填“>”“<”或“=”)(4)高铁酸钾溶液在中性条件下不稳定的原因是
(5)滴定法测定高铁酸钾样品的纯度,其方法是:称取2.0g产品溶于
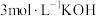 溶液中,加入足量
溶液中,加入足量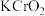 ,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用
,充分反应后得到铬酸钾和氢氧化铁沉淀,过滤,滤液在250mL容量瓶中定容;定容后取25.00mL加入稀硫酸酸化,加入二苯胺磺酸钠作指示剂,用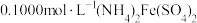 标准溶液滴定至终点,重复操作3次,平均消耗
标准溶液滴定至终点,重复操作3次,平均消耗 溶液的体积为24.00mL。
溶液的体积为24.00mL。①定容后,加入稀硫酸酸化的目的是
②该
 产品的纯度为
产品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】过氧化钙是一种温和的氧化剂,常温下为白色固体,易溶于酸,难溶于水、乙醇等溶剂。
(1)某实验小组拟选用如图装置(部分固定装置略)制备过氧化钙,按气流方向连接顺序为_______ (填仪器接口的字母编号,装置可重复使用)。
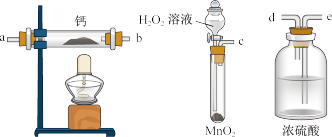
实验步骤如下:
①检验装置的气密性后,装入药品;
②打开分液漏斗活塞,通入一段时间气体,加热药品;
③反应结束后,先熄灭酒精灯,待反应管冷却至室温后,停止通入气体;
④拆除装置,取出产物。
实验步骤③的操作目的是_______ 。
(2)利用反应Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH ,在碱性环境下制取CaO2·8H2O的装置如图:
,在碱性环境下制取CaO2·8H2O的装置如图:
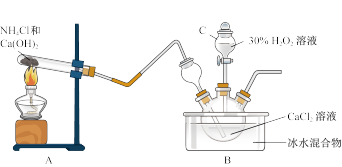
①仪器C的名称为_______ ;
②装置A试管中反应的化学方程式为_______ ;装置B中用冰水浴控制温度,其可能的原因是_______ 。
③测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品放入锥形瓶中,加入适量蒸馏水和过量b g KI晶体,再滴入少量2 mol·L-1硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴_______ (作指示剂)。
步骤三:逐滴加入浓度为c mol·L-1Na2S2O3溶液至反应完全,滴定至终点,记录数据。重复上述操作2次,三次平均消耗Na2S2O3溶液的体积为V mL,则CaO2·8H2O的质量分数为_______ (用含字母的式子表示)。(已知:I2+2S2O =2I-+S4O
=2I-+S4O )
)
(1)某实验小组拟选用如图装置(部分固定装置略)制备过氧化钙,按气流方向连接顺序为

实验步骤如下:
①检验装置的气密性后,装入药品;
②打开分液漏斗活塞,通入一段时间气体,加热药品;
③反应结束后,先熄灭酒精灯,待反应管冷却至室温后,停止通入气体;
④拆除装置,取出产物。
实验步骤③的操作目的是
(2)利用反应Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH
 ,在碱性环境下制取CaO2·8H2O的装置如图:
,在碱性环境下制取CaO2·8H2O的装置如图:
①仪器C的名称为
②装置A试管中反应的化学方程式为
③测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品放入锥形瓶中,加入适量蒸馏水和过量b g KI晶体,再滴入少量2 mol·L-1硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴
步骤三:逐滴加入浓度为c mol·L-1Na2S2O3溶液至反应完全,滴定至终点,记录数据。重复上述操作2次,三次平均消耗Na2S2O3溶液的体积为V mL,则CaO2·8H2O的质量分数为
 =2I-+S4O
=2I-+S4O )
)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知:氢化铝锂、氢化锂遇水都剧烈反应,并产生同一种气体。回答下列问题:
Ⅰ.制备氢化锂(LiH):
选择图中的装置制备氢化锂(必要时可重复使用)。

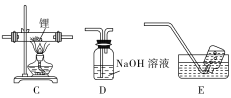
(1)装置D中NaOH溶液的作用是_______ 。
(2)装置的连接顺序(从左至右)为A→_______ 。
Ⅱ.制备氢化铝锂:1947年,Schlesinger、Bond 和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)将乙醚换为水是否可行,请简述理由:_______ 。
(4)氢化锂与无水三氯化铝反应的化学方程式为_______ 。
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度。
(5)按图装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是_______ 。读数之前,上下移动量气管在右侧的容器,使量气管左、右两侧的液面在同一水平面上,其目的是_______ 。

(6)标准状况下,反应前量气管读数为V1 mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为_______ (用含a、V1、V2的代数式表示)。若起始读数时俯视刻度线,测得的结果将_______ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备氢化锂(LiH):
选择图中的装置制备氢化锂(必要时可重复使用)。


(1)装置D中NaOH溶液的作用是
(2)装置的连接顺序(从左至右)为A→
Ⅱ.制备氢化铝锂:1947年,Schlesinger、Bond 和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)将乙醚换为水是否可行,请简述理由:
(4)氢化锂与无水三氯化铝反应的化学方程式为
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度。
(5)按图装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是

(6)标准状况下,反应前量气管读数为V1 mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】立德粉ZnS·BaSO4(也称锌钡白),难溶于水,是一种常用白色颜料。某学习小组设计如图所示实验制备少量的立德粉并测定其中S2-的含量。
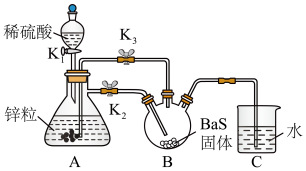
I.制备立德粉。
(1)连接装置,检查装置气密性。分别向分液漏斗、锥形瓶和装置B_____ (填名称)中,加入一定量的稀硫酸、锌粒和可溶性BaS固体。
(2)①打开分液漏斗上口玻璃塞,打开K1和K2,关闭K3,此时锥形瓶中有气体产生,该气体的作用是______ 。
②待锌粒溶解完后,打开K3,关闭K1和K2。锥形瓶中的溶液流入装置B中,其原因是___________ ;装置B中析出白色沉淀,该反应的离子方程式为___________ ,为使沉淀充分析出并分离,需采用的操作是_______ 、洗涤、干燥。
II.测定立德粉中的S2-含量。
(3)产品中S2-的含量可以用“碘量法”测得。称取ag样品,置于碘量瓶中,移取bmLxmol/L的I2-KI溶液于其中,并加入乙酸溶液,密闭,置于暗处反应5min,有单质硫析出(I2+S2-=2I-+S↓)。以淀粉为指示剂,过量的I用ymol/LNa2S2O3溶液滴定,反应式为I2+2S2O =2I-+S4O
=2I-+S4O 。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为_________ ,样品中S2-的含量(质量分数)为_________ %(写出表达式,结果要化简)。

I.制备立德粉。
(1)连接装置,检查装置气密性。分别向分液漏斗、锥形瓶和装置B
(2)①打开分液漏斗上口玻璃塞,打开K1和K2,关闭K3,此时锥形瓶中有气体产生,该气体的作用是
②待锌粒溶解完后,打开K3,关闭K1和K2。锥形瓶中的溶液流入装置B中,其原因是
II.测定立德粉中的S2-含量。
(3)产品中S2-的含量可以用“碘量法”测得。称取ag样品,置于碘量瓶中,移取bmLxmol/L的I2-KI溶液于其中,并加入乙酸溶液,密闭,置于暗处反应5min,有单质硫析出(I2+S2-=2I-+S↓)。以淀粉为指示剂,过量的I用ymol/LNa2S2O3溶液滴定,反应式为I2+2S2O
 =2I-+S4O
=2I-+S4O 。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为
。测定时消耗Na2S2O3溶液体积VmL。终点颜色变化为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
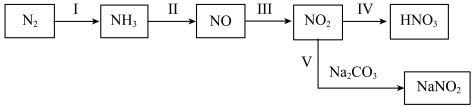
【推荐2】含氮物质转化关系如图。
(1)实验室制备 的化学方程式为
的化学方程式为_______ ,下列可用于吸收氨气尾气的装置为_______ (填标号)。_______ ,过程Ⅳ不断通入空气,理论上能使 最终完全吸收,
最终完全吸收, 发生反应的化学方程式
发生反应的化学方程式_______ ,1.7吨 理论上可以得到
理论上可以得到_______ 吨质量分数为63%的硝酸。
(3)过程Ⅴ是工业生产中吸收 的一种方法,其产物除
的一种方法,其产物除 外还有一种无污染气体和另一种盐,且氧化产物与还原产物的物质的量之比为1∶1,写出
外还有一种无污染气体和另一种盐,且氧化产物与还原产物的物质的量之比为1∶1,写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式_______ 。
(4)常温常压下,一定体积的 与
与 混合后被水完全吸收转化成200mL
混合后被水完全吸收转化成200mL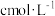 稀硝酸。200mL
稀硝酸。200mL 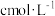 稀硝酸恰好将5.6g铁完全溶解,测得反应后的溶液
稀硝酸恰好将5.6g铁完全溶解,测得反应后的溶液 。
。
_____ 。
(1)实验室制备
 的化学方程式为
的化学方程式为
 最终完全吸收,
最终完全吸收, 发生反应的化学方程式
发生反应的化学方程式 理论上可以得到
理论上可以得到(3)过程Ⅴ是工业生产中吸收
 的一种方法,其产物除
的一种方法,其产物除 外还有一种无污染气体和另一种盐,且氧化产物与还原产物的物质的量之比为1∶1,写出
外还有一种无污染气体和另一种盐,且氧化产物与还原产物的物质的量之比为1∶1,写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式(4)常温常压下,一定体积的
 与
与 混合后被水完全吸收转化成200mL
混合后被水完全吸收转化成200mL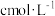 稀硝酸。200mL
稀硝酸。200mL 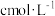 稀硝酸恰好将5.6g铁完全溶解,测得反应后的溶液
稀硝酸恰好将5.6g铁完全溶解,测得反应后的溶液 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】碘酸钙是一种无机精细与专用化学品。一种制备并测定六水合碘酸钙含量的实验设计如下:已知:碘酸钙为白色固体,微溶于水。Ca(IO3)2·6H2O 的式量为498。
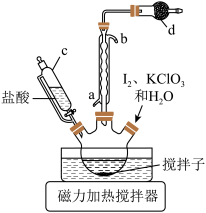
步骤Ⅰ.碘酸氢钾(KIO3·HIO3)的制备在三颈烧瓶中加入 2.54g碘、2.60g 氯酸钾和 50mL 水,滴加 6 mol/L 盐酸至 pH=1,控制温度 85℃左右,装置如图所示。
步骤Ⅱ.碘酸钙晶体[Ca(IO3)2·6H2O]的制备将反应后溶液转入烧杯中,加入 X 溶液,调节 pH=10.滴加 11 mL1mol/LCaCl2溶液,充分反应后用冰水冷却,抽滤、洗涤、晾干, 得粗产品碘酸钙晶体 4.50g。
步骤Ⅲ.产品中碘酸钙晶体含量测定
①准确称取 1.2000g 粗产品,置于烧杯中,加入 20mLHClO4溶解样品,转移到 250mL 容量瓶定容。量取 25.00mL 溶液于碘量瓶中,加入稍过量的 KI,然后用 0.1000mol/LNa2S2O3 溶液滴定至浅黄色,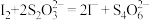 ,加入 2 滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去 25.24 mL 标准溶液。
,加入 2 滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去 25.24 mL 标准溶液。
②空白实验:不取产品,其余试剂用量和步骤相同,消耗 0.04 mLNa2S2O3标准溶液。
(1)仪器c 的名称为___________ 。
(2)步骤Ⅰ中有黄绿色气体产生,制备 KIO3·HIO3反应的化学方程式为___________ , 干燥管 d 中的试剂是________ 。
(3)步骤Ⅰ中温度不宜过高的原因是________ ,判断反应结束的实验现象是___________ 。
(4)步骤Ⅱ中 X 溶液是___________ 。
(5)步骤Ⅲ中量取 25.00 mL 溶液的玻璃仪器是___________ 。
(6)碘酸钙晶体中 Ca(IO3)2·6H2O 的纯度为___________ (保留两位小数)。若滴定过程中,溶液蓝色褪去,30 秒内又恢复蓝色,立即读数,则所测碘酸钙晶体的纯度___________ (填“偏高”“偏低”或“无影响”)。
(7)下列有关该实验的叙述正确的是___________。

步骤Ⅰ.碘酸氢钾(KIO3·HIO3)的制备在三颈烧瓶中加入 2.54g碘、2.60g 氯酸钾和 50mL 水,滴加 6 mol/L 盐酸至 pH=1,控制温度 85℃左右,装置如图所示。
步骤Ⅱ.碘酸钙晶体[Ca(IO3)2·6H2O]的制备将反应后溶液转入烧杯中,加入 X 溶液,调节 pH=10.滴加 11 mL1mol/LCaCl2溶液,充分反应后用冰水冷却,抽滤、洗涤、晾干, 得粗产品碘酸钙晶体 4.50g。
步骤Ⅲ.产品中碘酸钙晶体含量测定
①准确称取 1.2000g 粗产品,置于烧杯中,加入 20mLHClO4溶解样品,转移到 250mL 容量瓶定容。量取 25.00mL 溶液于碘量瓶中,加入稍过量的 KI,然后用 0.1000mol/LNa2S2O3 溶液滴定至浅黄色,
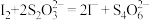 ,加入 2 滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去 25.24 mL 标准溶液。
,加入 2 滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去 25.24 mL 标准溶液。②空白实验:不取产品,其余试剂用量和步骤相同,消耗 0.04 mLNa2S2O3标准溶液。
(1)仪器c 的名称为
(2)步骤Ⅰ中有黄绿色气体产生,制备 KIO3·HIO3反应的化学方程式为
(3)步骤Ⅰ中温度不宜过高的原因是
(4)步骤Ⅱ中 X 溶液是
(5)步骤Ⅲ中量取 25.00 mL 溶液的玻璃仪器是
(6)碘酸钙晶体中 Ca(IO3)2·6H2O 的纯度为
(7)下列有关该实验的叙述正确的是___________。
| A.步骤Ⅰ中球形冷凝管的冷水进口为 b |
| B.步骤Ⅱ中用冰水冷却有利于碘酸钙晶体析出 |
| C.步骤Ⅲ中空白实验的主要目的是排除空气中 CO2的干扰 |
| D.本实验中制得的 Ca(IO3)2·6H2O 产品的产率约为 78.8% |
您最近一年使用:0次



