电负性的变化规律
(1)同周期(稀有气体元素除外),自左向右,元素的电负性逐渐___________ ,元素的非金属性逐渐___________ 、金属性逐渐___________ 。
(2)同主族,自上而下,元素的电负性逐渐___________ ,元素的金属性逐渐___________ 、非金属性逐渐___________ 。
(1)同周期(稀有气体元素除外),自左向右,元素的电负性逐渐
(2)同主族,自上而下,元素的电负性逐渐
22-23高二上·全国·课前预习 查看更多[3]
更新时间:2022-02-17 11:18:59
|
相似题推荐
填空题
|
容易
(0.94)
解题方法
【推荐1】主族元素电负性的变化规律
同一周期,主族元素的电负性从左到右依次_______ ,表明其吸引电子的能力逐渐_______ ,_______ 逐渐减弱,_________ 逐渐增强。
同一主族,元素的电负性从上到下呈现_______ 的趋势,表明其吸引电子的能力逐渐_______ ,_______ 逐渐增强,__________ 逐渐减弱。
同一周期,主族元素的电负性从左到右依次
同一主族,元素的电负性从上到下呈现
您最近一年使用:0次
填空题
|
容易
(0.94)
解题方法
【推荐2】下表是元素周期表的一部分,根据表中给出的10种元素,用元素符号 或化学式 回答下列问题:
(1)金属性最强的短周期元素是___________ ;化学性质最不活泼的单质是___________ ;
(2)Ca的最外层电子数为___________ ;
(3)表中元素最高价氧化物对应水化物酸性最强的酸是___________ ;
(4)某离子的原子结构示意图为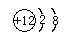 ,其对应的离子符号是
,其对应的离子符号是___________ ;
(5)硫有两种重要氧化物,分别为SO2和___________ (填化学式);
(6)H2S和HCl中,热稳定性较强的是___________ ;
(7)Si是带来人类文明的重要物质之一,晶体硅的主要用途是___________ (写出其中一种),其氧化物的化学式为___________ ;
(8)钠、铝最高价氧化物对应水化物之间反应的化学方程式是___________ 。
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
(2)Ca的最外层电子数为
(3)表中元素最高价氧化物对应水化物酸性最强的酸是
(4)某离子的原子结构示意图为
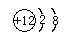 ,其对应的离子符号是
,其对应的离子符号是(5)硫有两种重要氧化物,分别为SO2和
(6)H2S和HCl中,热稳定性较强的是
(7)Si是带来人类文明的重要物质之一,晶体硅的主要用途是
(8)钠、铝最高价氧化物对应水化物之间反应的化学方程式是
您最近一年使用:0次
填空题
|
容易
(0.94)
名校
【推荐1】根据元素在周期表中的位置,判断下列各组化合物的酸、碱性强弱。
(1) 和
和
_________ ;
(2)KOH和
_________ ;
(3) 和
和
_________ ;
(1)
 和
和
(2)KOH和

(3)
 和
和
您最近一年使用:0次
填空题
|
容易
(0.94)
解题方法
【推荐2】O、P、S的原子半径由小到大的顺序为_______ 。
您最近一年使用:0次




