研究 、
、 、CO等大气污染气体的处理有重要意义。如图为
、CO等大气污染气体的处理有重要意义。如图为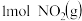 和
和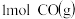 反应生成
反应生成 和
和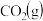 过程中的能量变化示意图。已知
过程中的能量变化示意图。已知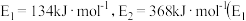 、
、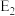 为反应的活化能
为反应的活化能 。
。
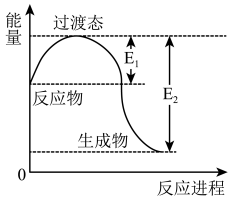
(1)则该反应放出的热量为_______ kJ。
(2)若在反应体系中加入催化剂,正反应速率_______ ,逆反应速率_______ ;E1_______ , E2_______ ; 
_______  以上均填“增大”、“减小”或“不变”
以上均填“增大”、“减小”或“不变” 。
。
(3)该条件下若 和
和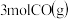 在密闭容器中充分反应后,放热140.4 kJ,则
在密闭容器中充分反应后,放热140.4 kJ,则 的转化率为
的转化率为_______ 。
 、
、 、CO等大气污染气体的处理有重要意义。如图为
、CO等大气污染气体的处理有重要意义。如图为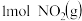 和
和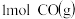 反应生成
反应生成 和
和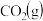 过程中的能量变化示意图。已知
过程中的能量变化示意图。已知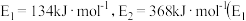 、
、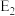 为反应的活化能
为反应的活化能 。
。
(1)则该反应放出的热量为
(2)若在反应体系中加入催化剂,正反应速率

 以上均填“增大”、“减小”或“不变”
以上均填“增大”、“减小”或“不变” 。
。(3)该条件下若
 和
和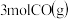 在密闭容器中充分反应后,放热140.4 kJ,则
在密闭容器中充分反应后,放热140.4 kJ,则 的转化率为
的转化率为
更新时间:2022-01-07 12:18:09
|
相似题推荐
填空题
|
较易
(0.85)
名校
【推荐1】热化学方程式的书写
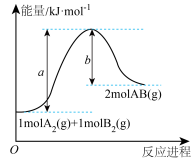
(1)1 g碳(s)与适量水蒸气完全反应生成CO(g)和H2(g),需要吸收10.94 kJ热量,该反应的热化学方程式为___________ 。
(2)已知某反应的能量变化如图所示,请写出该反应的热化学方程式:___________ 。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=−1275.6
②H2O(l)=H2O(g) ΔH=+44.0
写出表示甲醇燃烧热的热化学方程式___________ 。
(4)图为ⅥA族元素氢化物a、b、c、d的生成热数据示意图。

则硫化氢在上述条件下发生分解反应的热化学方程式为___________ 。
(1)1 g碳(s)与适量水蒸气完全反应生成CO(g)和H2(g),需要吸收10.94 kJ热量,该反应的热化学方程式为
(2)已知某反应的能量变化如图所示,请写出该反应的热化学方程式:

(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=−1275.6

②H2O(l)=H2O(g) ΔH=+44.0

写出表示甲醇燃烧热的热化学方程式
(4)图为ⅥA族元素氢化物a、b、c、d的生成热数据示意图。

则硫化氢在上述条件下发生分解反应的热化学方程式为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
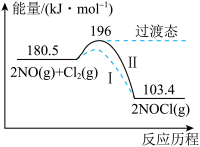
【推荐2】亚硝酰氯(NOCl)是有机合成中的重要试剂。通常条件下,NO和Cl2反应生成NOC1,其能量变化如图所示。
回答下列问题:
(1)曲线Ⅱ中正反应的活化能E1为_______________ ,逆反应的活化能E2为___________ 。 该反应能在通常情况下进行的主要原因是_____________________________ 。
(2)加入催化剂的曲线为_________________ (填“I”或“Ⅱ”)。加入催化剂,能提高化学反应速率的原因是_______________________________________________________ 。
(3)催化剂不能使平衡移动的原因是_________________________________________ 。
(4)上述合成NOCl(g)的热化学方程式为__________________________________ 。

回答下列问题:
(1)曲线Ⅱ中正反应的活化能E1为
(2)加入催化剂的曲线为
(3)催化剂不能使平衡移动的原因是
(4)上述合成NOCl(g)的热化学方程式为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】研究CO2氧化C2H6制C2H4对资源综合利用有重要意义。相关的主要化学反应有:
I.C2H6(g) C2H4(g)+H2(g) ΔH1=136kJ·mol-1
C2H4(g)+H2(g) ΔH1=136kJ·mol-1
II.C2H6(g)+CO2(g) C2H4(g)+H2O(g)+CO(g) ΔH2=177kJ·mol-1
C2H4(g)+H2O(g)+CO(g) ΔH2=177kJ·mol-1
III.C2H6(g)+2CO2(g) 4CO(g)+3H2(g) ΔH3
4CO(g)+3H2(g) ΔH3
IV.CO2(g)+H2(g) CO(g)+H2O(g) ΔH4=41kJ·mol-1
CO(g)+H2O(g) ΔH4=41kJ·mol-1
已知:298K时,相关物质的相对能量(如图)。

可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。例如:H2O(g)=H2O(l) ΔH=-286kJ·mol-1-(-242kJ·mol-1)=44kJ·mol-1。
请回答:根据相关物质的相对能量计算ΔH3=____ kJ·mol-1。
I.C2H6(g)
 C2H4(g)+H2(g) ΔH1=136kJ·mol-1
C2H4(g)+H2(g) ΔH1=136kJ·mol-1II.C2H6(g)+CO2(g)
 C2H4(g)+H2O(g)+CO(g) ΔH2=177kJ·mol-1
C2H4(g)+H2O(g)+CO(g) ΔH2=177kJ·mol-1III.C2H6(g)+2CO2(g)
 4CO(g)+3H2(g) ΔH3
4CO(g)+3H2(g) ΔH3IV.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH4=41kJ·mol-1
CO(g)+H2O(g) ΔH4=41kJ·mol-1已知:298K时,相关物质的相对能量(如图)。

可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。例如:H2O(g)=H2O(l) ΔH=-286kJ·mol-1-(-242kJ·mol-1)=44kJ·mol-1。
请回答:根据相关物质的相对能量计算ΔH3=
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】硫酸工业在国民经济中占有重要地位.工业制硫酸主要的生产流程如图:
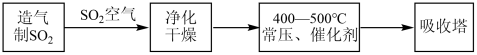
(1)工业制硫酸通常以______ 为原料,经造气、______ 、吸收三个主要生产阶段;
(2)硫酸生产的尾气中含有少量的SO2,通常用______ 来吸收处理;
(3)在工业生产中,反应条件有重要的作用.请回答:
①除去原料气中的有毒物质是为了防止______ ;
②使用催化剂是为了提高______ .

(1)工业制硫酸通常以
(2)硫酸生产的尾气中含有少量的SO2,通常用
(3)在工业生产中,反应条件有重要的作用.请回答:
①除去原料气中的有毒物质是为了防止
②使用催化剂是为了提高
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】针对反应速率与平衡产率的矛盾,我国科学家提出了采用 复合催化剂解决方案。
复合催化剂解决方案。 合成氨催化反应中活化能最大的
合成氨催化反应中活化能最大的 是
是_______ 。
(2)如图可以得出一个关于复合催化剂的结论是_______ 。
 复合催化剂解决方案。
复合催化剂解决方案。
 合成氨催化反应中活化能最大的
合成氨催化反应中活化能最大的 是
是(2)如图可以得出一个关于复合催化剂的结论是
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小的矿粒__________ ;
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2则很快产生气体________ ;
(3)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢_______ ;
(4)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速率不同______ ;
(5)夏天的食品易霉变,冬天就不易发生该现象_____________ ;
(1)黄铁矿煅烧时要粉碎成细小的矿粒
(2)熔化的KClO3放出气泡很慢,撒入少量MnO2则很快产生气体
(3)同浓度、同体积的盐酸中放入同样大小的锌粒和镁块,产生气体有快有慢
(4)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速率不同
(5)夏天的食品易霉变,冬天就不易发生该现象
您最近一年使用:0次
【推荐1】 作为重要的化工原料及清洁能源,一直备受关注。回答下列问题:
作为重要的化工原料及清洁能源,一直备受关注。回答下列问题:
I.利用 人工固氮,其反应原理为
人工固氮,其反应原理为 。
。
(1)部分化学键的键能(键能:断开 化学键所需的能量)如下表所示。
化学键所需的能量)如下表所示。
每有 参与人工固氮,
参与人工固氮,___________ (填“吸收”或“放出”)的能量为___________ kJ。
(2)T℃时,将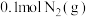 和
和 置于容积为
置于容积为 的恒容密闭容器中(起始压强为
的恒容密闭容器中(起始压强为 ),发生反应
),发生反应 。若保持温度不变,某兴趣小组的同学测得反应过程中容器内压强随时间变化关系如图所示:
。若保持温度不变,某兴趣小组的同学测得反应过程中容器内压强随时间变化关系如图所示: 内,用
内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________  。
。
② 的平衡转化率为
的平衡转化率为___________ 。
③下列事实能说明上述反应达到平衡状态的是___________ (填选项字母)。
a. 、
、 的浓度之比为
的浓度之比为
b.
c.混合气体的密度保持不变
d.混合气体的平均相对分子质量不随时间而变化
II.氢能源的利用。
(3)碱性氢氧燃料电池的工作原理如图所示。___________ (填“正极”或“负极”)。
②正极的电极反应式为___________ 。
③电池工作时,当外电路中流过 电子时,消耗的氧气在标准状况下的体积为
电子时,消耗的氧气在标准状况下的体积为_______ L。
 作为重要的化工原料及清洁能源,一直备受关注。回答下列问题:
作为重要的化工原料及清洁能源,一直备受关注。回答下列问题:I.利用
 人工固氮,其反应原理为
人工固氮,其反应原理为 。
。(1)部分化学键的键能(键能:断开
 化学键所需的能量)如下表所示。
化学键所需的能量)如下表所示。| 化学键 |  | H—H | N—H |
键能 | 946 | 436 | 391 |
 参与人工固氮,
参与人工固氮,(2)T℃时,将
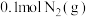 和
和 置于容积为
置于容积为 的恒容密闭容器中(起始压强为
的恒容密闭容器中(起始压强为 ),发生反应
),发生反应 。若保持温度不变,某兴趣小组的同学测得反应过程中容器内压强随时间变化关系如图所示:
。若保持温度不变,某兴趣小组的同学测得反应过程中容器内压强随时间变化关系如图所示: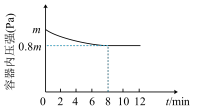
 内,用
内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为 。
。②
 的平衡转化率为
的平衡转化率为③下列事实能说明上述反应达到平衡状态的是
a.
 、
、 的浓度之比为
的浓度之比为
b.

c.混合气体的密度保持不变
d.混合气体的平均相对分子质量不随时间而变化
II.氢能源的利用。
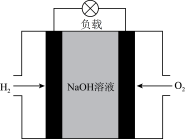
(3)碱性氢氧燃料电池的工作原理如图所示。
②正极的电极反应式为
③电池工作时,当外电路中流过
 电子时,消耗的氧气在标准状况下的体积为
电子时,消耗的氧气在标准状况下的体积为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)  2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示完成下列问题
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示完成下列问题
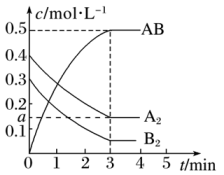
(1)求a=_______
(2)3分钟时反应达到平衡,求平衡时A2的转化率_______
(3)前3分钟AB的速率_______ (保留到小数点后两位)
(4)若向体系中再加入0.2molB2 ,则A2的转化率_______ ,B2的转化率_______ ,(填“增大”“减小”“不变”)
 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示完成下列问题
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示完成下列问题
(1)求a=
(2)3分钟时反应达到平衡,求平衡时A2的转化率
(3)前3分钟AB的速率
(4)若向体系中再加入0.2molB2 ,则A2的转化率
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料.
(1)已知CH3OH(g)+ O2(g)
O2(g) CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
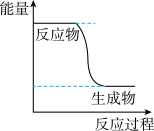
(2)某温度下,将5molCH3OH和2molO2充入2L的密闭容器中,经过4min反应达到平衡,测得c(O2)=0.2mol·L-1,4min内平均反应速度v(H2)=__________ ,则CH3OH的转化率为______ 。
(3)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气、KOH(电解质溶液)构成,则下列说法正确的是 ______
(4)写出甲醇燃料电池在酸性条件下负极的反应式为 ______ 。
(1)已知CH3OH(g)+
 O2(g)
O2(g) CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
CO2(g)+2H2(g)能量变化如图,下列说法正确的是______
| A.CH3OH转变成H2的过程是一个吸收能量的过程 |
| B.H2的生成速率与CH3OH的消耗速率之比为1:2 |
| C.化学变化不仅有新物质生成,同时也一定有能量变化 |
| D.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度 |
(3)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气、KOH(电解质溶液)构成,则下列说法正确的是 ______
| A.电池放电时通入空气的电极为负极 |
| B.电池放电时负极的电极反应式为CH3OH-6e-=CO2↑+2H2O |
| C.电池放电时,电解质溶液的碱性逐渐减弱 |
| D.电池放电时每消耗6.4gCH3OH转移1.2mol电子 |
您最近一年使用:0次



