某工业废水中存在大盘的Na+、 、Cu2+、
、Cu2+、 ,欲除去其中的Cu2+、
,欲除去其中的Cu2+、 ,设计的工艺流程如图所示:
,设计的工艺流程如图所示:

(1)加入NaOH溶液时反应的离子方程式:_______ 。
(2)试剂a为_______ ,试剂b为_______ 。
(3)流程图中操作X为_______ 。
(4)检验废水中的 已沉淀完全的方法为
已沉淀完全的方法为_______ 。
 、Cu2+、
、Cu2+、 ,欲除去其中的Cu2+、
,欲除去其中的Cu2+、 ,设计的工艺流程如图所示:
,设计的工艺流程如图所示:
(1)加入NaOH溶液时反应的离子方程式:
(2)试剂a为
(3)流程图中操作X为
(4)检验废水中的
 已沉淀完全的方法为
已沉淀完全的方法为
更新时间:2022-04-05 02:02:31
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】有一包粉末可能含有K+、Fe3+、Al3+、Cl−、SO42−、CO32−中的若干种,现进行以下实验:
①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
②向①溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成;
③取②中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
④重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
⑤向④的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的NaOH溶液,沉淀减少。
(1)根据上述实验,这包粉末中一定不含有的离子是______ ,肯定含有的离子是______ ,不能确定是否含有的离子______ 。可通过______ (填实验方法)来进一步确定该离子。
(2)步骤⑤中发生反应的离子方程式是______ ;______ ;______ 。
①取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
②向①溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成;
③取②中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
④重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
⑤向④的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的NaOH溶液,沉淀减少。
(1)根据上述实验,这包粉末中一定不含有的离子是
(2)步骤⑤中发生反应的离子方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
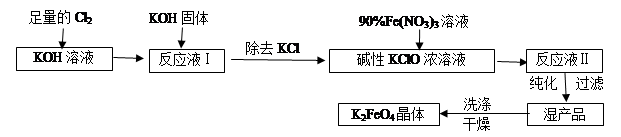
请回答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式___________ 。
(2)在溶液Ⅰ中加入KOH固体的目的是________ (填编号)。
A.为下一步反应提供碱性的环境
B.使 KClO3 转化为 KClO
C.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3) 从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为________ 。每制得59.4 克K2FeO4,理论上消耗氧化剂的物质的量为________ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式: FeO42-+ H2O= Fe(OH)3(胶体) + O2↑+ OH-。___________
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为_____________ 。


请回答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式
(2)在溶液Ⅰ中加入KOH固体的目的是
A.为下一步反应提供碱性的环境
B.使 KClO3 转化为 KClO
C.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3) 从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式: FeO42-+ H2O= Fe(OH)3(胶体) + O2↑+ OH-。
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】氧化铈( )是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含
)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含 、BaO、
、BaO、 等)为原料制备氧化铈,其工艺流程如图所示:
等)为原料制备氧化铈,其工艺流程如图所示: 形成复盐沉淀;
形成复盐沉淀;
②硫脲 具有还原性,酸性条件下易被氧化为
具有还原性,酸性条件下易被氧化为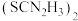 ;
;
③ 在空气中易被氧化为
在空气中易被氧化为 ,氧化性:
,氧化性: 。
。
回答下列问题:
(1)滤渣A的主要成分是______ (填化学式)。
(2)步骤①加入稀硫酸浸出,Ce的浸出率与温度、稀硫酸的浓度的变化关系如图所示,应选择的适宜条件为______ (填标号);硫酸浓度过大时,浸出率降低的原因是______ 。
A.65℃、2.0mol/L B.75℃、2.0mol/L
C.85℃、2.5mol/L D.100℃、2.5mol/L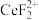 还原为
还原为 ,反应的离子方程式为
,反应的离子方程式为______ 。
(4)步骤③加入盐酸后,通常还需加入 ,其主要目的是
,其主要目的是______ 。
(5)常温下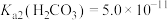 ,
,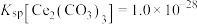 ,步骤④中
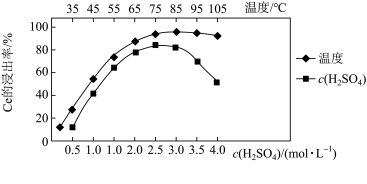
,步骤④中 恰好沉淀完全,
恰好沉淀完全,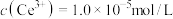 ,此时溶液的
,此时溶液的 ,则溶液中
,则溶液中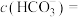
______ mol/L。
(6)若 经步骤⑤充分灼烧后质量减少5.8t,则获得
经步骤⑤充分灼烧后质量减少5.8t,则获得 的质量为
的质量为______ t。
 )是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含
)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含 、BaO、
、BaO、 等)为原料制备氧化铈,其工艺流程如图所示:
等)为原料制备氧化铈,其工艺流程如图所示: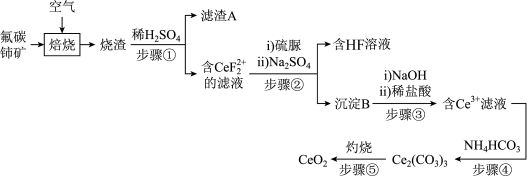
 形成复盐沉淀;
形成复盐沉淀;②硫脲
 具有还原性,酸性条件下易被氧化为
具有还原性,酸性条件下易被氧化为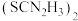 ;
;③
 在空气中易被氧化为
在空气中易被氧化为 ,氧化性:
,氧化性: 。
。回答下列问题:
(1)滤渣A的主要成分是
(2)步骤①加入稀硫酸浸出,Ce的浸出率与温度、稀硫酸的浓度的变化关系如图所示,应选择的适宜条件为
A.65℃、2.0mol/L B.75℃、2.0mol/L
C.85℃、2.5mol/L D.100℃、2.5mol/L
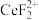 还原为
还原为 ,反应的离子方程式为
,反应的离子方程式为(4)步骤③加入盐酸后,通常还需加入
 ,其主要目的是
,其主要目的是(5)常温下
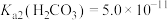 ,
,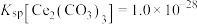 ,步骤④中
,步骤④中 恰好沉淀完全,
恰好沉淀完全,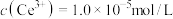 ,此时溶液的
,此时溶液的 ,则溶液中
,则溶液中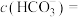
(6)若
 经步骤⑤充分灼烧后质量减少5.8t,则获得
经步骤⑤充分灼烧后质量减少5.8t,则获得 的质量为
的质量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】A、B、C、D为四种可溶性的盐,它们包含的阳离子和阴离子分别为Ba2+、Ag+、Na+、Cu2+和NO 、SO
、SO 、Cl-、CO
、Cl-、CO (离子在物质中不能重复出现)。
(离子在物质中不能重复出现)。
①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
(1)根据①②实验事实可推断它们的化学式为:A___ ;B___ 。
(2)写出过量醋酸与D反应放出气体的离子方程式:___ 。
(3)将含相同数量A、B、C的溶液混合,混合后溶液中存在的离子有___ 。各离子的个数之比为____ ,在此溶液中加入锌粒,写出发生反应的离子方程式:___ 。
(4)C溶液中阴离子的检验方法:___ 。
 、SO
、SO 、Cl-、CO
、Cl-、CO (离子在物质中不能重复出现)。
(离子在物质中不能重复出现)。①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
(1)根据①②实验事实可推断它们的化学式为:A
(2)写出过量醋酸与D反应放出气体的离子方程式:
(3)将含相同数量A、B、C的溶液混合,混合后溶液中存在的离子有
(4)C溶液中阴离子的检验方法:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】某溶液呈酸性,可能含有: 、
、 、
、 、
、 、
、 、
、 中的若干种。对其进行如下实验:
中的若干种。对其进行如下实验:
Ⅰ.取少量溶液,向其中加入过量 ,生成白色沉淀
,生成白色沉淀 和无色气体
和无色气体 ,该无色气体在空气中变为红棕色。
,该无色气体在空气中变为红棕色。
Ⅱ.将Ⅰ中所得溶液滤去沉淀后,加入过量浓 溶液,生成无色气体,最终得到红棕色沉淀
溶液,生成无色气体,最终得到红棕色沉淀 。
。
(1)上述6种离子中,该溶液肯定存在的为____________ ,肯定不存在 的为______ ,不能 确定是否存在的为______ 。
(2)请设计实验检验原溶液中是否存在 ,写出操作方法、现象及结论
,写出操作方法、现象及结论___________ 。
(3)生成无色气体 的离子方程式为
的离子方程式为____________ 。
(4)步骤Ⅱ中发生反应的离子方程式为___________________ 。
 、
、 、
、 、
、 、
、 、
、 中的若干种。对其进行如下实验:
中的若干种。对其进行如下实验:Ⅰ.取少量溶液,向其中加入过量
 ,生成白色沉淀
,生成白色沉淀 和无色气体
和无色气体 ,该无色气体在空气中变为红棕色。
,该无色气体在空气中变为红棕色。Ⅱ.将Ⅰ中所得溶液滤去沉淀后,加入过量浓
 溶液,生成无色气体,最终得到红棕色沉淀
溶液,生成无色气体,最终得到红棕色沉淀 。
。(1)上述6种离子中,该溶液肯定存在的为
(2)请设计实验检验原溶液中是否存在
 ,写出操作方法、现象及结论
,写出操作方法、现象及结论(3)生成无色气体
 的离子方程式为
的离子方程式为(4)步骤Ⅱ中发生反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】I.有A、B、C、D四种溶液,它们分别为K2CO3、K2SO4、H2SO4、Ba(NO3)2中的一种,分别取少量样品进行下列实验,现象为在A中加C,无明显变化;在A中加D,无明显变化;在B中加D,生成沉淀E,并得到一种溶液;在B中加C,生成沉淀并得到溶液F;将少量E加入过量F中,有气体放出。
(1)写出下列物质的化学式:B_______ ,C________ 。
(2)如果将A和B混合,有关反应的离子方程式为_______ ;将E加入过量F中,有关反应的离子方程式为_______ 。
II.某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如图,则
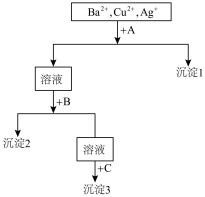
(3)若沉淀2为蓝色,则化学式为_______ 。
(4)写出混合液+A的离子方程式_______ ,溶液+B的离子方程式_______ 。
(1)写出下列物质的化学式:B
(2)如果将A和B混合,有关反应的离子方程式为
II.某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如图,则

(3)若沉淀2为蓝色,则化学式为
(4)写出混合液+A的离子方程式
您最近一年使用:0次
【推荐1】为除去粗盐中的Ca2+、Mg2+、 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
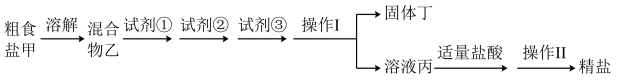
(1)操作Ⅰ需要用到的玻璃仪器有________ ,操作Ⅱ的名称是________ 。
(2)试剂①、②、③其实是三种物质:饱和Na2CO3溶液、BaCl2溶液、NaOH溶液,这三种物质的加入顺序可能有多种情况,下列选项中正确的是________ 。
A.饱和Na2CO3溶液、BaCl2溶液、NaOH溶液
B.BaCl2溶液、饱和Na2CO3溶液、NaOH溶液
C.NaOH溶液、BaCl2溶液、饱和Na2CO3溶液
D.饱和Na2CO3溶液、NaOH溶液、BaCl2溶液
(3)固体丁是混合物,除含有泥沙、CaCO3、BaSO4外,还含有________ (填化学式)。
(4)在混合物乙中分别加入试剂①、②、③的过程中,判断滴加BaCl2溶液已过量的方法是:加入BaCl2溶液后,静置,在上层清液中,________________ 。
 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)操作Ⅰ需要用到的玻璃仪器有
(2)试剂①、②、③其实是三种物质:饱和Na2CO3溶液、BaCl2溶液、NaOH溶液,这三种物质的加入顺序可能有多种情况,下列选项中正确的是
A.饱和Na2CO3溶液、BaCl2溶液、NaOH溶液
B.BaCl2溶液、饱和Na2CO3溶液、NaOH溶液
C.NaOH溶液、BaCl2溶液、饱和Na2CO3溶液
D.饱和Na2CO3溶液、NaOH溶液、BaCl2溶液
(3)固体丁是混合物,除含有泥沙、CaCO3、BaSO4外,还含有
(4)在混合物乙中分别加入试剂①、②、③的过程中,判断滴加BaCl2溶液已过量的方法是:加入BaCl2溶液后,静置,在上层清液中,
您最近一年使用:0次
【推荐2】硅胶在干燥时因加有氯化钴( )会有颜色的变化,随吸湿量的增加由蓝色逐渐转变成浅红色,使用非常方便。某学习小组设计实验制备氯化钴,并查阅到以下资料:钴与铁相似,常见化合价为+2、+3,可溶于稀盐酸(因反应极慢,需用硝酸作催化剂才可顺利进行)。钴在纯氧中加热至300℃以上生成CoO(熔点为1 935℃),400~900℃生成
)会有颜色的变化,随吸湿量的增加由蓝色逐渐转变成浅红色,使用非常方便。某学习小组设计实验制备氯化钴,并查阅到以下资料:钴与铁相似,常见化合价为+2、+3,可溶于稀盐酸(因反应极慢,需用硝酸作催化剂才可顺利进行)。钴在纯氧中加热至300℃以上生成CoO(熔点为1 935℃),400~900℃生成 。请回答下列问题:
。请回答下列问题:
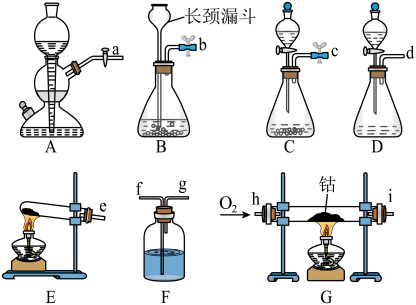
(1)实验①~④是制备氧气的试剂组合,请从A~E中选择最恰当装置符号填入表中。
(2)第一小组负责制备无水CoO,若选用装置C作为氧气的发生装置,则制备CoO完整装置的接口连接顺序为___________ ,装置C发生反应的化学方程式为_______ ;
(3) 与
与 类似,可以看作氧化钴(CoO)与氧化高钴(
类似,可以看作氧化钴(CoO)与氧化高钴( )形成的化合物,写出
)形成的化合物,写出 与盐酸反应的化学方程式:
与盐酸反应的化学方程式:________________ 。
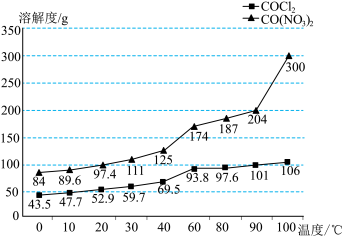
(4)第二小组同学提出另外的方案:用一定质量的钴粉与稀盐酸反应,滴入几滴稀硝酸,将得到的溶液倒入蒸发皿中,加热蒸发浓缩,38~40℃冷却结晶,趁热过滤,得到晶体。根据如图溶解度随温度变化,曲线解释能得到氯化钴晶体的原因:__________ 。
(5)为了确定晶体的化学式,小组同学把晶体洗涤、干燥、称量得到23.8 g固体,用坩埚加热至质量不再变化,数据如表所示,则该晶体的化学式为________ 。
 )会有颜色的变化,随吸湿量的增加由蓝色逐渐转变成浅红色,使用非常方便。某学习小组设计实验制备氯化钴,并查阅到以下资料:钴与铁相似,常见化合价为+2、+3,可溶于稀盐酸(因反应极慢,需用硝酸作催化剂才可顺利进行)。钴在纯氧中加热至300℃以上生成CoO(熔点为1 935℃),400~900℃生成
)会有颜色的变化,随吸湿量的增加由蓝色逐渐转变成浅红色,使用非常方便。某学习小组设计实验制备氯化钴,并查阅到以下资料:钴与铁相似,常见化合价为+2、+3,可溶于稀盐酸(因反应极慢,需用硝酸作催化剂才可顺利进行)。钴在纯氧中加热至300℃以上生成CoO(熔点为1 935℃),400~900℃生成 。请回答下列问题:
。请回答下列问题:
(1)实验①~④是制备氧气的试剂组合,请从A~E中选择最恰当装置符号填入表中。
| 实验 编号 | ① | ② | ③ | ④ |
| 试剂 | H2O2 溶液 | H2O2 溶液 | KMnO4 固体 | H2O2溶液 |
| 催化剂 | MnO2粉末 | FeCl3溶液 | 以Al2O3为载体,混有MnO2的块状物 | |
| 装置 |
(3)
 与
与 类似,可以看作氧化钴(CoO)与氧化高钴(
类似,可以看作氧化钴(CoO)与氧化高钴( )形成的化合物,写出
)形成的化合物,写出 与盐酸反应的化学方程式:
与盐酸反应的化学方程式:(4)第二小组同学提出另外的方案:用一定质量的钴粉与稀盐酸反应,滴入几滴稀硝酸,将得到的溶液倒入蒸发皿中,加热蒸发浓缩,38~40℃冷却结晶,趁热过滤,得到晶体。根据如图溶解度随温度变化,曲线解释能得到氯化钴晶体的原因:

(5)为了确定晶体的化学式,小组同学把晶体洗涤、干燥、称量得到23.8 g固体,用坩埚加热至质量不再变化,数据如表所示,则该晶体的化学式为
加热前质量 | |
| W1(坩埚)18.4g | W2(坩埚+晶体)42.2g |
加热后质量 | |
第一次 | W3(坩埚+晶体)31.3g |
第二次 | W4(坩埚+晶体)31.5g |
第三次 | W5(坩埚+晶体)31.4g |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】NiSO4•XH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外还含有铜、锌、铁等元素)为原料获得。操作步骤如图:
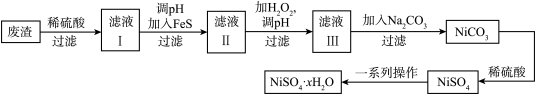
(1)镍元素的基态原子的价电子排布式为___ ,该基态原子有___ 种能量相同的电子。
(2)电镀在铜上的镍层破损后,镀层___ (填“能”或“否”)继续保护内部金属。
(3)向滤液Ⅰ中加入FeS的目的是___ ,当Zn2+恰好沉淀完全时,则c(Cu2+)=___ mol/L [已知Ksp(CuS)=l.3×10-36(mol/L)2,Ksp(ZnS)=l.3×10-24(mol/L)2]
(4)对滤液Ⅱ中加入H2O2时发生的反应离子方程式为___ 。
(5)滤液Ⅲ中溶质的主要成分是NiSO4,加入Na2CO3过滤后再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是___ 。
(6)为测定NiSO4・xH2O晶体x的值,称取5.26g晶体加热至完全失去结晶水,剩余固体3.10g,则x的值等于___ 。

(1)镍元素的基态原子的价电子排布式为
(2)电镀在铜上的镍层破损后,镀层
(3)向滤液Ⅰ中加入FeS的目的是
(4)对滤液Ⅱ中加入H2O2时发生的反应离子方程式为
(5)滤液Ⅲ中溶质的主要成分是NiSO4,加入Na2CO3过滤后再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
(6)为测定NiSO4・xH2O晶体x的值,称取5.26g晶体加热至完全失去结晶水,剩余固体3.10g,则x的值等于
您最近一年使用:0次
【推荐1】草木灰中含有可溶性钾盐(主要成分是 、
、 、KCl)。某同学设计实验拟提取草木灰中的钾盐。
、KCl)。某同学设计实验拟提取草木灰中的钾盐。
实验步骤:I.取适量的草木灰,加水搅拌,溶解,过滤,取滤液;
II.经过蒸发结晶,得到白色固体。
(1)实验步骤I和II中均需要用到的玻璃仪器为_______ 。
(2)为检验草木灰中的离子,某实验小组设计了四组实验,其装置如图所示:
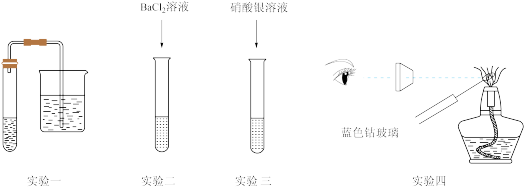
①实验一:往试管中先加入实验步骤I中的滤液,再加入稀盐酸,烧杯中加入澄清石灰水,可观察到_______ ,说明草木灰中含有 。
。
②实验二:取少量实验步骤I中的滤液,先加入稀盐酸酸化,无明显变化,再加入 溶液,有白色沉淀生成。得出的结论是
溶液,有白色沉淀生成。得出的结论是____ ,写出生成白色沉淀的离子方程式:_____ 。
③实验三:取少量实验步骤I中的滤液,加入过量的 溶液后过滤,往滤液中滴加硝酸银溶液,有白色沉淀生成。根据实验现象,该小组同学得出结论:草木灰中含有
溶液后过滤,往滤液中滴加硝酸银溶液,有白色沉淀生成。根据实验现象,该小组同学得出结论:草木灰中含有 。你认为是否正确;
。你认为是否正确;____ (填“是”或“否”);理由是____ 。
④实验四:用洁净的铂丝蘸取实验步骤I中的滤液,进行如图所示实验,预计观察到的实验现象为___ 。
 、
、 、KCl)。某同学设计实验拟提取草木灰中的钾盐。
、KCl)。某同学设计实验拟提取草木灰中的钾盐。实验步骤:I.取适量的草木灰,加水搅拌,溶解,过滤,取滤液;
II.经过蒸发结晶,得到白色固体。
(1)实验步骤I和II中均需要用到的玻璃仪器为
(2)为检验草木灰中的离子,某实验小组设计了四组实验,其装置如图所示:

①实验一:往试管中先加入实验步骤I中的滤液,再加入稀盐酸,烧杯中加入澄清石灰水,可观察到
 。
。②实验二:取少量实验步骤I中的滤液,先加入稀盐酸酸化,无明显变化,再加入
 溶液,有白色沉淀生成。得出的结论是
溶液,有白色沉淀生成。得出的结论是③实验三:取少量实验步骤I中的滤液,加入过量的
 溶液后过滤,往滤液中滴加硝酸银溶液,有白色沉淀生成。根据实验现象,该小组同学得出结论:草木灰中含有
溶液后过滤,往滤液中滴加硝酸银溶液,有白色沉淀生成。根据实验现象,该小组同学得出结论:草木灰中含有 。你认为是否正确;
。你认为是否正确;④实验四:用洁净的铂丝蘸取实验步骤I中的滤液,进行如图所示实验,预计观察到的实验现象为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】青蒿素是高效的抗疟药,无色针状晶体,易溶于苯,在乙醇、乙醚中可溶解,在水中几乎不溶。熔点为156-157℃,热稳定性差。已知:乙醚的沸点为35℃。从青蒿中提取青蒿素的方法之一是乙醚浸取法和汽油浸取法。如图所示:
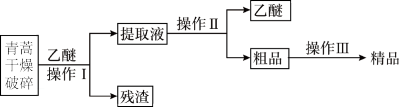
(1)对青蒿进行破碎的目的是______________ 。
(2)操作I需要的玻璃仪器主要有:烧杯、玻璃棒、_____________ 。
(3)操作Ⅱ的名称是_____________ 。
(4)操作Ⅲ的主要过程可能是_____________ (请选择)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液

(1)对青蒿进行破碎的目的是
(2)操作I需要的玻璃仪器主要有:烧杯、玻璃棒、
(3)操作Ⅱ的名称是
(4)操作Ⅲ的主要过程可能是
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某工厂生产废液中含有大量的Cu2+、Fe3+、Fe2+、 。某兴趣小组设计了以下方案,对废液加以综合利用获得了Cu和绿矾(FeSO4·7H2O):
。某兴趣小组设计了以下方案,对废液加以综合利用获得了Cu和绿矾(FeSO4·7H2O):
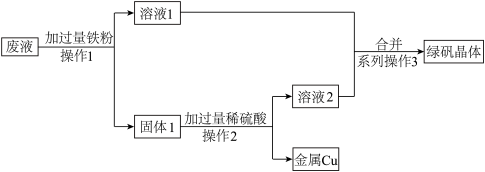
请回答以下问题:
(1)操作1和操作2的名称是________ 。
(2)废液中加过量铁时发生反应的离子方程式为_______________ 、________________ 。
(3)合并溶液1和溶液2后,系列操作3包含__________ 、____________ 、过滤等操作。
(4)若使用得到的绿矾晶体制备净水剂Fe2(SO4)3溶液,除在绿矾中加入适量稀硫酸外,还需要加入____ (填标号)。
①稀H2SO4②Cl2③H2O2④Fe粉
 。某兴趣小组设计了以下方案,对废液加以综合利用获得了Cu和绿矾(FeSO4·7H2O):
。某兴趣小组设计了以下方案,对废液加以综合利用获得了Cu和绿矾(FeSO4·7H2O):
请回答以下问题:
(1)操作1和操作2的名称是
(2)废液中加过量铁时发生反应的离子方程式为
(3)合并溶液1和溶液2后,系列操作3包含
(4)若使用得到的绿矾晶体制备净水剂Fe2(SO4)3溶液,除在绿矾中加入适量稀硫酸外,还需要加入
①稀H2SO4②Cl2③H2O2④Fe粉
您最近一年使用:0次



