由三种元素组成的化合物X,相对分子质量小于120,按如图流程进行实验。气体A是由红棕色气体E和黄绿色气体F组成的混合物,溶液B是两种强酸的混合物,可被80 mL 1.5 mol·L-1NaOH溶液恰好中和。
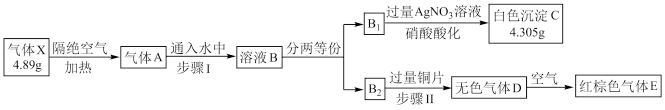
请回答:
(1)组成X的三种元素是_______ (填元素符号)。
(2)X的化学式是_______ 。
(3)步骤I发生反应的化学方程式是_______ 。
(4)步骤II发生反应的离子方程式是_______ 。
(5)已知:气体X直接溶于水也可得到溶液B。有文献指出,气体X溶于水得到溶液B的反应分两步进行:第一步生成物之一是具有漂白性的含氧酸,第二步接着反应得到溶液B。写出第一步反应的化学方程式_______ 。

请回答:
(1)组成X的三种元素是
(2)X的化学式是
(3)步骤I发生反应的化学方程式是
(4)步骤II发生反应的离子方程式是
(5)已知:气体X直接溶于水也可得到溶液B。有文献指出,气体X溶于水得到溶液B的反应分两步进行:第一步生成物之一是具有漂白性的含氧酸,第二步接着反应得到溶液B。写出第一步反应的化学方程式
更新时间:2022-04-21 12:12:56
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】高铁酸钾(K2FeO4)可做饮用水消毒剂。以废铁屑(表面带油污)为原料制备K2FeO4的流程如图:

回答下列问题:
(1)高铁酸钾中Fe元素的化合价为____ 。
(2)“碱洗”步骤的目的是____ 。
(3)“沉铁”步骤加入H2O2溶液,其对应反应的离子方程式为____ 。
(4)“氧化”步骤对应的化学方程式为____ 。
(5)该流程中可以循环利用的物质是____ (填化学式)。
(6)Zn和K2FeO4可以组成高铁电池,电池工作原理如图所示,正极的电极反应式为____ 。


回答下列问题:
(1)高铁酸钾中Fe元素的化合价为
(2)“碱洗”步骤的目的是
(3)“沉铁”步骤加入H2O2溶液,其对应反应的离子方程式为
(4)“氧化”步骤对应的化学方程式为
(5)该流程中可以循环利用的物质是
(6)Zn和K2FeO4可以组成高铁电池,电池工作原理如图所示,正极的电极反应式为

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】某研究性小组同学带领兴趣小组的同学完成了下列任务。
任务一:探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。

(1)比较两实验装置,图2装置的优点是:①能更好的吸收有毒气体SO2,防止其污染环境;②___________ 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是___________ 。
(3)能说明图2有SO2气体产生的实验现象是___________ 。
(4)反应一段时间后,用滴管吸取(图2)A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有三种可能:I:只含有Fe3+;II:只含有Fe2+;III:既有Fe3+又有Fe2+。为验证III的可能性,选用如下试剂,填写下列空格:
A.稀H2SO4 B.NaOH溶液 C.KSCN溶液 D.KMnO4溶液 E.氯水。
取试样,滴加少量的___________ (填试剂序号),经观察现象可确定含有Fe3+;再取适量的试样滴加少量的___________ (填试剂序号),观察现象则可确定含有Fe2+。
任务二:测定空气中SO2的含量
(5)某课外小组的同学将空气样品经过管道通入密闭容器中的300mL0.100mo/L的酸性KMnO4溶液。写出SO2与该溶液反应的离子方程式为:___________ 。若管道中空气流量为aL/min,经过bmin溶液恰好褪色,假定样品中的SO2可被溶液充分吸收,则该空气样品中SO2的含量是___________ g/L。
任务一:探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。

(1)比较两实验装置,图2装置的优点是:①能更好的吸收有毒气体SO2,防止其污染环境;②
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是
(3)能说明图2有SO2气体产生的实验现象是
(4)反应一段时间后,用滴管吸取(图2)A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有三种可能:I:只含有Fe3+;II:只含有Fe2+;III:既有Fe3+又有Fe2+。为验证III的可能性,选用如下试剂,填写下列空格:
A.稀H2SO4 B.NaOH溶液 C.KSCN溶液 D.KMnO4溶液 E.氯水。
取试样,滴加少量的
任务二:测定空气中SO2的含量
(5)某课外小组的同学将空气样品经过管道通入密闭容器中的300mL0.100mo/L的酸性KMnO4溶液。写出SO2与该溶液反应的离子方程式为:
您最近一年使用:0次
【推荐3】磷酸铁(FePO4)常用作电极材料。以硫铁矿(主要成分是FeS2,含少量Al2O3、SiO2和Fe3O4)为原料制备磷酸铁的流程如图:

已知几种金属离子沉淀的pH如表所示:
请回答下列问题:
(1)滤渣3的主要成分是_______ (写出化学式)。
(2)用FeS还原Fe3+的目的是_______ ,加入FeO的作用是_______ (用离子方程式表示)。
(3)试剂R宜选择_______(填字母)。
(4)检验“氧化”之后溶液是否含Fe2+的操作是_______ 。

已知几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 4.0 |
| 完全沉淀的pH | 4.1 | 9.7 | 5.2 |
请回答下列问题:
(1)滤渣3的主要成分是
(2)用FeS还原Fe3+的目的是
(3)试剂R宜选择_______(填字母)。
| A.高锰酸钾 | B.稀硝酸 | C.双氧水 | D.次氯酸钠 |
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
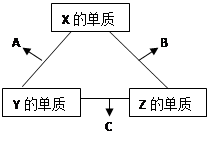
已知一个B分子中含有的Z元素的原子个数比C
分子中的少一个。请回答下列问题:
(1)Y单质分子的电子式为______________ 。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________ (填物质名称或化学式均可);负极电极反应式为______________________________ 。
(3)已知Y的单质与Z的单质生成C的反应是可逆反应,将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是__________ (填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小

已知一个B分子中含有的Z元素的原子个数比C
分子中的少一个。请回答下列问题:
(1)Y单质分子的电子式为
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入
(3)已知Y的单质与Z的单质生成C的反应是可逆反应,将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿制高锰酸钾的流程如下(部分条件和产物省略):

请回答下列问题:
(1)提高锰酸钾浸出率(浸出锰酸钾质量与固体总质量之比)的措施有______ (任答一项即可)
(2)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:______ 。
(3)从经济性考虑试剂X宜选择(填名称):___________ 。上述流程中,设计步骤IV和V的目的是___ 。
(4)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化。
①阳极反应式为______ 。
②电解过程中,阴极附近电解质溶液的pH将________ (填:增大、减小或不变)。
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色,表明达到滴定终点。写出离子方程式:________

请回答下列问题:
(1)提高锰酸钾浸出率(浸出锰酸钾质量与固体总质量之比)的措施有
(2)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:
(3)从经济性考虑试剂X宜选择(填名称):
(4)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化。
①阳极反应式为
②电解过程中,阴极附近电解质溶液的pH将
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色,表明达到滴定终点。写出离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐3】昆一中化学竞赛班和理科学社(chemistryking)的学长特别设计了如图所示的图案欢迎你加入百年名校,成为昆华园的一员。图中A~G均为初中化学常见物质,“-”表示物质之间能够相互反应,“→”表示物质之间的转化关系(所涉及反应均为初中常见的化学反应)。A、B、C、D、E分别属于酸、碱、盐、氧化物、单质中的一种,其中A、B均为黑色固体,A具有吸附性,C、E在农业上常用于配制农药波尔多液。
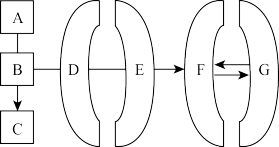
请回答:
(1)A的化学式为____ 。
(2)D属于题中所述物质类别中的____ 。
(3)B→C的化学方程式为_____ 。
(4)F和G对应的物质可能是_____ 。(填序号)
①水和氧气 ②氢氧化钠和碳酸钠 ③二氧化碳和一氧化碳

请回答:
(1)A的化学式为
(2)D属于题中所述物质类别中的
(3)B→C的化学方程式为
(4)F和G对应的物质可能是
①水和氧气 ②氢氧化钠和碳酸钠 ③二氧化碳和一氧化碳
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】淡黄色固体A由三种元素组成(分子量小于160),能发生如下转化。其中B、C、D均为常见气体,D为单质。反应生成的E与D可继续反应,生成黑色固体F,同时剩余1.92gD。黑色固体E可溶于稀盐酸,滴加KSCN溶液无现象,加入酸性双氧水后变红色。
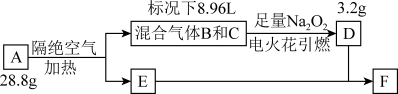
(1)A中含有的元素名称为_____________ ,A的化学式为_________________ 。
(2)写出F与足量稀硝酸反应的离子方程式为____________ 。写出图中标况下8.96L混合气体B和C与足量Na2O2反应的化学方程式为__________ 。
(3)为了验证A中阳离子的价态,某小组做了如下实验:取适量样品溶于稀硫酸,滴加适量酸性KMnO4溶液,溶液褪色,达到了检测目标。请评价该方案是否合理并说明理由___________ 。

(1)A中含有的元素名称为
(2)写出F与足量稀硝酸反应的离子方程式为
(3)为了验证A中阳离子的价态,某小组做了如下实验:取适量样品溶于稀硫酸,滴加适量酸性KMnO4溶液,溶液褪色,达到了检测目标。请评价该方案是否合理并说明理由
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】研究金属与稀硝酸的反应,实验如下。
(1)Ⅰ中的无色气体是_______ 。
(2)Ⅱ中生成H2的离子方程式是_______ 。
(3)研究Ⅱ中的氧化剂。
① 甲同学通过理论分析,认为NO 也能被还原。其依据是
也能被还原。其依据是_______ 。
② 乙认为该浓度的硝酸中H+的氧化性大于NO ,所以NO
,所以NO 没有发生反应。根据Ⅰ和Ⅱ,丙同学认为乙的说法不正确。其理由是
没有发生反应。根据Ⅰ和Ⅱ,丙同学认为乙的说法不正确。其理由是_______ 。
③ 丙同学通过实验证实了反应后的溶液中含有NH 。生成NH
。生成NH 的离子方程式是
的离子方程式是_______ 。
(4)丙同学进一步研究了Al与NO 反应的情况。
反应的情况。
根据实验Ⅰ~Ⅴ,金属与NO 反应时,影响NO
反应时,影响NO 还原产物不同的因素有
还原产物不同的因素有_______ 。
(5)将一定质量的铁粉加入装有100mL某浓度稀硝酸的容器中充分反应,容器中剩余铁粉,收集到NO气体448mL(标准状况下),所得溶液溶质的化学式是_______ ,稀硝酸的物质的量浓度为_______ 。
| 序号 | 实验试剂(20℃) | 实验现象 |
| Ⅰ | 过量铜粉、2mL0.5mol/LHNO3 | 无色气体(遇空气变红棕色),溶液变为蓝色 |
| Ⅱ | 过量铁粉、2mL0.5mol/LHNO3 | 6mL无色气体(经检测为H2),溶液几乎无色 |
(2)Ⅱ中生成H2的离子方程式是
(3)研究Ⅱ中的氧化剂。
① 甲同学通过理论分析,认为NO
 也能被还原。其依据是
也能被还原。其依据是② 乙认为该浓度的硝酸中H+的氧化性大于NO
 ,所以NO
,所以NO 没有发生反应。根据Ⅰ和Ⅱ,丙同学认为乙的说法不正确。其理由是
没有发生反应。根据Ⅰ和Ⅱ,丙同学认为乙的说法不正确。其理由是③ 丙同学通过实验证实了反应后的溶液中含有NH
 。生成NH
。生成NH 的离子方程式是
的离子方程式是(4)丙同学进一步研究了Al与NO
 反应的情况。
反应的情况。| 序号 | 实验试剂(20℃) | 实验现象 |
| Ⅲ | 铝粉、稀硝酸 | 溶液无色,试管上方呈浅红棕色 |
| Ⅳ | 铝粉、NaNO3溶液、几滴NaOH | 产生大量气泡,能使湿润红色石蕊试纸变蓝 |
| Ⅴ | 铝粉、NaNO3溶液 | 产生气泡,能使湿润红色石蕊试纸变蓝 |
 反应时,影响NO
反应时,影响NO 还原产物不同的因素有
还原产物不同的因素有(5)将一定质量的铁粉加入装有100mL某浓度稀硝酸的容器中充分反应,容器中剩余铁粉,收集到NO气体448mL(标准状况下),所得溶液溶质的化学式是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)

(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则物质C中所含化学键类型为为____________ ,反应④的化学方程式为____________________________ ;
(2)若A是常见的金属单质,D、F是气态单质,且反应①在水溶液中进行.反应②也在水溶液中进行,其离子方程式是_____________________ ;检验E物质中阳离子的操作和现象___________ ,A单质与1mol/L稀硝酸160mL恰好反应,最多消耗A单质______________ g;
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为___________________________________________ ;

(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则物质C中所含化学键类型为为
(2)若A是常见的金属单质,D、F是气态单质,且反应①在水溶液中进行.反应②也在水溶液中进行,其离子方程式是
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为
您最近一年使用:0次



