某兴趣小组用L-乳酸钙制备L-乳酸亚铁晶体,流程如下:

已知: Fe3+对产品的品质有较大的影响,相关实验结果图示如下:

请回答:
(1)步骤II中反应时间控制在30min,不能过长也不能过短,原因是___________ 。
(2)下列说法不正确的是___________
A.步骤I,反应中控制温度的方法可以采用恒温水浴加热
B.反应温度65-70°C时,产品的收率高,生成的结晶颗粒较大,固液分离较为完全,产品中夹杂的Fe3+含量减少。
C.步骤II,反应应在密闭容器或通氮条件下进行,以减少空气对亚铁盐的氧化
D.步骤III中,为析出颗粒比较大晶体,可采用冰水冷却
E.步骤V,将滤液蒸发、浓缩、过滤、结晶可得副产物CaCl2
(3)对于步骤IV:
①洗涤剂可通过蒸馏实现循环利用。如图是蒸馏装置示意图,其中分馏柱分馏柱的作用是___________ 。

②在干燥前,为得到纯度较高的L-乳酸亚铁晶体,需要对粗产品进行洗涤,请从下列选项中选出合理的操作(操作不能重复使用) 并排序:___________
粗产品放入烧杯中→( )→( )→ ( )→( )→低温真空干燥
a.加入适量的冷水
b.加入适量的65°C- 70°C的水
c.加入80% -85%的乙醇溶液。
d.静置使产品充分沉降
e.将烧杯中的上层清液沿玻璃棒倒入另一只烧杯中
f.用玻璃棒充分搅拌
(4)实验室可用电位滴定法测定L-乳酸亚铁中的Fe2+含量。在被测溶液中插入一个指示电极和一个参比电极组成一个工作电池,当用酸性高锰酸钾标准溶液滴定乳酸亚铁溶液时,Fe2+浓度不断变化,指示电极的电位相应变化,根据测量工作电池电动势的变化就可确定终点。用E表示指示电极的电位,V表示标准溶液体积,△E表示指示电极的电位改变量,△V表示标准溶液体积增量,以下滴定过程中所示图象正确的是
(5)某研究小组用KMnO4滴定法测定样品中乳酸亚铁含量进而计算产品中乳酸亚铁的纯度,发现结果总是大于100%,其原因可能是___________

已知: Fe3+对产品的品质有较大的影响,相关实验结果图示如下:

请回答:
(1)步骤II中反应时间控制在30min,不能过长也不能过短,原因是
(2)下列说法不正确的是
A.步骤I,反应中控制温度的方法可以采用恒温水浴加热
B.反应温度65-70°C时,产品的收率高,生成的结晶颗粒较大,固液分离较为完全,产品中夹杂的Fe3+含量减少。
C.步骤II,反应应在密闭容器或通氮条件下进行,以减少空气对亚铁盐的氧化
D.步骤III中,为析出颗粒比较大晶体,可采用冰水冷却
E.步骤V,将滤液蒸发、浓缩、过滤、结晶可得副产物CaCl2
(3)对于步骤IV:
①洗涤剂可通过蒸馏实现循环利用。如图是蒸馏装置示意图,其中分馏柱分馏柱的作用是

②在干燥前,为得到纯度较高的L-乳酸亚铁晶体,需要对粗产品进行洗涤,请从下列选项中选出合理的操作(操作不能重复使用) 并排序:
粗产品放入烧杯中→( )→( )→ ( )→( )→低温真空干燥
a.加入适量的冷水
b.加入适量的65°C- 70°C的水
c.加入80% -85%的乙醇溶液。
d.静置使产品充分沉降
e.将烧杯中的上层清液沿玻璃棒倒入另一只烧杯中
f.用玻璃棒充分搅拌
(4)实验室可用电位滴定法测定L-乳酸亚铁中的Fe2+含量。在被测溶液中插入一个指示电极和一个参比电极组成一个工作电池,当用酸性高锰酸钾标准溶液滴定乳酸亚铁溶液时,Fe2+浓度不断变化,指示电极的电位相应变化,根据测量工作电池电动势的变化就可确定终点。用E表示指示电极的电位,V表示标准溶液体积,△E表示指示电极的电位改变量,△V表示标准溶液体积增量,以下滴定过程中所示图象正确的是
A. | B. |
C. | D. |
更新时间:2022-05-14 12:40:04
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】MnO2是重要的化工原料,由软锰矿(主要成分为MnO2,主要杂质有Al2O3和SiO2)制备MnO2的一种工艺流程如图:

资料:①该工艺条件下MnO2与H2SO4不反应。
②部分金属阳离子沉淀的pH(25℃)。
(1)“溶出”前,软锰矿需要进行研磨的目的___________ 。
(2)“溶出”时,Fe的氧化过程及得到Mn2+的主要途径如图所示。

步骤Ⅱ是从软锰矿石中溶出Mn2+的主要反应,反应的离子方程式是___________ 。
(3)“纯化”时,先向溶出液中加入MnO2,将Fe2+氧化;再加入NH3·H2O调节溶液pH,使Fe3+、Al3+转化为氢氧化物沉淀而除去。适宜调节的pH范围是___________ 。
(4)“纯化”后,过滤所得的滤渣中含有Al(OH)3和Fe(OH)3,实验室欲以该滤渣为原料制备少量Al2O3,实验操作为:取少量滤渣放入烧杯中,___________ 。(须使用的试剂:6mol·L-1NaOH溶液、干冰、蒸馏水)
(5)向4.350g所得MnO2产品中依次加入足量6.700gNa2C2O4和足量稀H2SO4,加热至充分反应,再用0.0200mol·L-1KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为20.00mL。
已知过程中发生的反应为:5C2O +2MnO
+2MnO +16H+→2Mn2++10CO2↑+8H2O、MnO2+C2O
+16H+→2Mn2++10CO2↑+8H2O、MnO2+C2O +4H+→Mn2++2CO2↑+2H2O
+4H+→Mn2++2CO2↑+2H2O
①滴定终点的现象是:___________ 。
②计算该产品中MnO2的纯度___________ (杂质不参加反应,写出计算过程)。

资料:①该工艺条件下MnO2与H2SO4不反应。
②部分金属阳离子沉淀的pH(25℃)。
| Fe3+ | Al3+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)“溶出”前,软锰矿需要进行研磨的目的
(2)“溶出”时,Fe的氧化过程及得到Mn2+的主要途径如图所示。

步骤Ⅱ是从软锰矿石中溶出Mn2+的主要反应,反应的离子方程式是
(3)“纯化”时,先向溶出液中加入MnO2,将Fe2+氧化;再加入NH3·H2O调节溶液pH,使Fe3+、Al3+转化为氢氧化物沉淀而除去。适宜调节的pH范围是
(4)“纯化”后,过滤所得的滤渣中含有Al(OH)3和Fe(OH)3,实验室欲以该滤渣为原料制备少量Al2O3,实验操作为:取少量滤渣放入烧杯中,
(5)向4.350g所得MnO2产品中依次加入足量6.700gNa2C2O4和足量稀H2SO4,加热至充分反应,再用0.0200mol·L-1KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为20.00mL。
已知过程中发生的反应为:5C2O
 +2MnO
+2MnO +16H+→2Mn2++10CO2↑+8H2O、MnO2+C2O
+16H+→2Mn2++10CO2↑+8H2O、MnO2+C2O +4H+→Mn2++2CO2↑+2H2O
+4H+→Mn2++2CO2↑+2H2O①滴定终点的现象是:
②计算该产品中MnO2的纯度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】重铬酸铵[(NH4)2Cr2O7]可用作媒染剂和有机合成催化剂,具有强氧化性。实验室将NH3通入重铬酸(H2Cr2O7)溶液中制备[(NH4)2Cr2O7]的装置如图所示(夹持装置略)。回答下列问题:
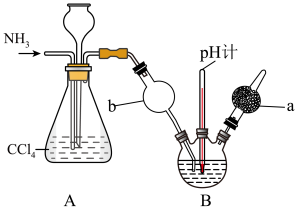
已知: (橙色)+H2O⇌2
(橙色)+H2O⇌2 (黄色)+2H+。
(黄色)+2H+。
(1)仪器a的名称是_______ ,A装置的作用为_______ 。
(2)在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是_______ 。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2++ +H2O=2BaCrO4+2H+、4
+H2O=2BaCrO4+2H+、4 +6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。
+6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:
I.称取样品12.00g,配成250mL溶液。
II.量取25.00mL样品溶液,用氯化钡溶液使Cr2O72-完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5min。
III.以酚酞作指示剂,用1.00mol·L-1的NaOH标准溶液滴定,记录数据。
IV.重复步骤II、III2~3次,处理数据。
①滴定终点的颜色变化为_______ 。
②用_______ (填“酸式”或“碱式”)滴定管量取25.00mL样品溶液于250mL锥形瓶中。
③与NaOH反应时,1mol(CH2)6N4H+与1molH+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是_______ 。
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7(摩尔质量为252g·mol-1)的质量分数为_______ %。
⑤若滴定终点时仰视读数,则测定的质量分数将_______ (填“偏大”、“偏小”或“不变”)。

已知:
 (橙色)+H2O⇌2
(橙色)+H2O⇌2 (黄色)+2H+。
(黄色)+2H+。(1)仪器a的名称是
(2)在试管中加入少量(NH4)2Cr2O7固体,加水溶解,再滴加足量KOH浓溶液,振荡,微热,观察到的主要现象是
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的产品中(NH4)2Cr2O7的质量分数,其反应原理为2Ba2++
 +H2O=2BaCrO4+2H+、4
+H2O=2BaCrO4+2H+、4 +6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。
+6HCHO=(CH2)6N4H++6H2O+3H+,然后用NaOH标准溶液滴定反应生成的酸。实验步骤:
I.称取样品12.00g,配成250mL溶液。
II.量取25.00mL样品溶液,用氯化钡溶液使Cr2O72-完全沉淀后,加入足量的20%中性甲醛溶液,摇匀,静置5min。
III.以酚酞作指示剂,用1.00mol·L-1的NaOH标准溶液滴定,记录数据。
IV.重复步骤II、III2~3次,处理数据。
①滴定终点的颜色变化为
②用
③与NaOH反应时,1mol(CH2)6N4H+与1molH+相当,步骤III中(CH2)6N4H+与NaOH发生反应的离子方程式是
④若实验平均消耗NaOH溶液的体积为16.00mL,则所得产物中(NH4)2Cr2O7(摩尔质量为252g·mol-1)的质量分数为
⑤若滴定终点时仰视读数,则测定的质量分数将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】 是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备
是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备 (夹持装置略去)。
(夹持装置略去)。 易挥发,高温时能与
易挥发,高温时能与 反应,不与HCl反应,其他相关信息如下表:
反应,不与HCl反应,其他相关信息如下表:
回答下列问题:
(1)装置A中盛装浓盐酸的仪器可换为下图仪器中的___________ (填“①”或“②”)。装置D中的仪器b通入冷却水的入口是___________ (填“c”或“d”)。 前,先打开开关K,从侧管通入
前,先打开开关K,从侧管通入 一段时间,目的是
一段时间,目的是___________ 。
(3)装置B中的液体是___________ 。若无装置B, 的产率会
的产率会___________ ①(填“增大”“减小”或“无影响”)。
(4)装置C中除生成 外,还生成一种气态不成盐氧化物,该反应的化学方程式为
外,还生成一种气态不成盐氧化物,该反应的化学方程式为___________ 。
(5)制得的 中常含有少量的
中常含有少量的 ,从混合液中分离出
,从混合液中分离出 的实验方法是
的实验方法是___________ (填操作名称)。
(6)利用如图装置测定所得 的纯度:取2.000g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待
的纯度:取2.000g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待 充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,滴加几滴(
充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,滴加几滴(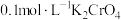 溶液作指示剂,用
溶液作指示剂,用 的
的 标准溶液滴定至终点,平行滴定三次,平均消耗标准溶液36.00mL。已知:常温下,
标准溶液滴定至终点,平行滴定三次,平均消耗标准溶液36.00mL。已知:常温下,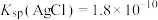 ,
, 。
。 呈砖红色。
呈砖红色。 。
。___________ 。
②滴定终点的判断方法是___________ 。
③产品的纯度为___________ (保留三位有效数字)。
 是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备
是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备 (夹持装置略去)。
(夹持装置略去)。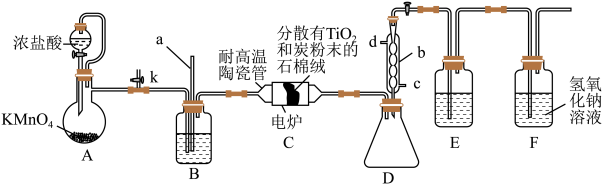
 易挥发,高温时能与
易挥发,高温时能与 反应,不与HCl反应,其他相关信息如下表:
反应,不与HCl反应,其他相关信息如下表:| 熔点/℃ | 沸点/℃ | 密度 | 水溶性 | |
 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于 |
 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)装置A中盛装浓盐酸的仪器可换为下图仪器中的

 前,先打开开关K,从侧管通入
前,先打开开关K,从侧管通入 一段时间,目的是
一段时间,目的是(3)装置B中的液体是
 的产率会
的产率会(4)装置C中除生成
 外,还生成一种气态不成盐氧化物,该反应的化学方程式为
外,还生成一种气态不成盐氧化物,该反应的化学方程式为(5)制得的
 中常含有少量的
中常含有少量的 ,从混合液中分离出
,从混合液中分离出 的实验方法是
的实验方法是(6)利用如图装置测定所得
 的纯度:取2.000g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待
的纯度:取2.000g产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待 充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,滴加几滴(
充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,滴加几滴(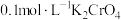 溶液作指示剂,用
溶液作指示剂,用 的
的 标准溶液滴定至终点,平行滴定三次,平均消耗标准溶液36.00mL。已知:常温下,
标准溶液滴定至终点,平行滴定三次,平均消耗标准溶液36.00mL。已知:常温下,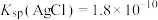 ,
, 。
。 呈砖红色。
呈砖红色。 。
。
②滴定终点的判断方法是
③产品的纯度为
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D是四种常见的有机物,其中,A是一种气态烃,在标准状况下的密度是1.25 g/L ,其产量是衡量一个国家石油化工发展水平的标志之一;C的分子式为C2H4O2;B和C在浓硫酸和加热的条件下发生反应,生成的有机物有特殊的香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):
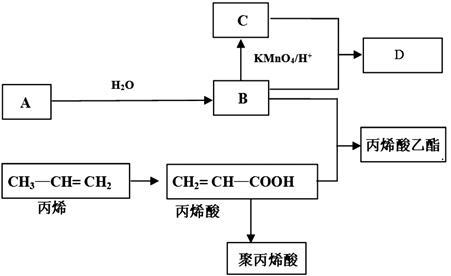
根据以上材料和你所学的化学知识回答下列问题:
(1)B中所含官能团名称:________________ ,C中所含官能团名称______________
(2)丙烯酸(CH2 =" CH" — COOH)的性质可能有( )
① 加成反应 ②取代反应 ③加聚反应 ④中和反应 ⑤氧化反应
A.只有①③ B.只有①③④ C.只有①③④⑤ D.①②③④⑤
(3)写出下列反应方程式
①A B:
B:_______________________________ 反应类型:________________
②丙烯酸 + B 丙烯酸乙酯 :
丙烯酸乙酯 :__________________________ 反应类型:______________
(4)聚丙烯酸的结构简式______________ ,丙烯中最多有_____________ 个原子共面。

根据以上材料和你所学的化学知识回答下列问题:
(1)B中所含官能团名称:
(2)丙烯酸(CH2 =" CH" — COOH)的性质可能有
① 加成反应 ②取代反应 ③加聚反应 ④中和反应 ⑤氧化反应
A.只有①③ B.只有①③④ C.只有①③④⑤ D.①②③④⑤
(3)写出下列反应方程式
①A
 B:
B:②丙烯酸 + B
 丙烯酸乙酯 :
丙烯酸乙酯 :(4)聚丙烯酸的结构简式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某实验小组用下列装置进行乙醇催化氧化的实验.
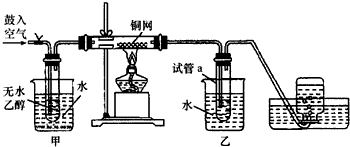
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式____________________ ;
(2)甲和乙两个水浴作用不相同,甲的作用是________________ ,乙的作用是_________________ ;
(3)下列反应原理可以用于检查司机是否酒后开车:
2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
(橙色) (绿色)
①若司机酒后开车,应显示出______ 色;
②生成1mol Cr3+转移的电子数为___________ 。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
(2)甲和乙两个水浴作用不相同,甲的作用是
(3)下列反应原理可以用于检查司机是否酒后开车:
2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
(橙色) (绿色)
①若司机酒后开车,应显示出
②生成1mol Cr3+转移的电子数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】已二酸 是一种二元弱酸,实验室以环已醇(
是一种二元弱酸,实验室以环已醇( )为原料制取己二酸的实验流程如图:
)为原料制取己二酸的实验流程如图:

已知:①不同温度下,相关物质在水中的溶解度如下表:
②“氧化”过程在三颈烧瓶(如下图1所示)中进行,发生的主要反应为: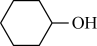

回答下列问题:
(1)在水溶液中已二酸的电离方程式为_______ 。
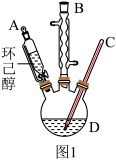
(2)实验操作1的名称为_______ ;图1中仪器 的名称为
的名称为_______ 。
(3)“氧化”过程在环已醇不同滴速下,溶液温度随时间变化曲线如图2所示,实验过程中应选择的环己醇滴速为_______ 滴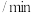 。
。

(4)蒸发浓缩操作中当溶液表面出现_______ 现象时停止加热。
(5)除去己二酸晶体中含有的氯化钠杂质通常采取的实验方法为_______ 。
(6)实验时称取的环己醇质量为 ,最终得到纯净的己二酸晶体
,最终得到纯净的己二酸晶体 ,则该实验中已二酸的产率为
,则该实验中已二酸的产率为_______ %(保留两位有效数字)。
 是一种二元弱酸,实验室以环已醇(
是一种二元弱酸,实验室以环已醇( )为原料制取己二酸的实验流程如图:
)为原料制取己二酸的实验流程如图:
已知:①不同温度下,相关物质在水中的溶解度如下表:
| 物质 | 已二酸 | 氯化钠 | 氯化钾 |
| 25℃时溶解度/g | 2.1 | 36.1 | 34.3 |
| 70℃时溶解度/g | 68 | 37.8 | 48 |
| 100℃时溶解度/g | 160 | 39.5 | 56.3 |


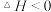
回答下列问题:
(1)在水溶液中已二酸的电离方程式为
(2)实验操作1的名称为
 的名称为
的名称为
(3)“氧化”过程在环已醇不同滴速下,溶液温度随时间变化曲线如图2所示,实验过程中应选择的环己醇滴速为
 。
。
(4)蒸发浓缩操作中当溶液表面出现
(5)除去己二酸晶体中含有的氯化钠杂质通常采取的实验方法为
(6)实验时称取的环己醇质量为
 ,最终得到纯净的己二酸晶体
,最终得到纯净的己二酸晶体 ,则该实验中已二酸的产率为
,则该实验中已二酸的产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】2019年度诺贝尔化学奖奖励理电池的研发者,一种以废旧锂离子电池的正极材料,[主要含LiCoO2 (难溶于水)、Al,还含有少量Ca、Mg、Cu、Fe等元素]为原料制备Co2O3的流程如下:
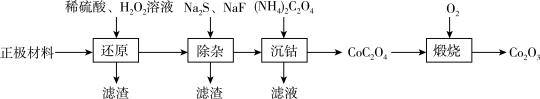
(1)还原步骤在70℃左右,LiCoO2 发生反应的化学方程式为_________ 。
(2)除杂后的滤渣中含有Fe(OH)3、Al(OH)3、 CuS等。已知除杂后所得常温下溶液的pH=6,c(S2-)=0.03 mol/L,则溶液中c(Fe3+):c(Cu2+)=_______ 。[已知Fe(OH)3的Ksp=4×10-38,CuS的Ksp=6×10-36]
(3)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000 g于锥形瓶中,加入足量硫酸和50 mL0.50000 mol/LFeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0. 0500 mol/LKMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00 mL。
已知步骤1、2中所涉及物质的转化分别为:Co3+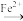 Co2+、MnO
Co2+、MnO
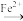 Mn2+通过计算确定Co2O3样品中Co2O3的质量分数
Mn2+通过计算确定Co2O3样品中Co2O3的质量分数_______ (写出计算过程)。

(1)还原步骤在70℃左右,LiCoO2 发生反应的化学方程式为
(2)除杂后的滤渣中含有Fe(OH)3、Al(OH)3、 CuS等。已知除杂后所得常温下溶液的pH=6,c(S2-)=0.03 mol/L,则溶液中c(Fe3+):c(Cu2+)=
(3)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000 g于锥形瓶中,加入足量硫酸和50 mL0.50000 mol/LFeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0. 0500 mol/LKMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00 mL。
已知步骤1、2中所涉及物质的转化分别为:Co3+
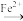 Co2+、MnO
Co2+、MnO
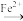 Mn2+通过计算确定Co2O3样品中Co2O3的质量分数
Mn2+通过计算确定Co2O3样品中Co2O3的质量分数
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
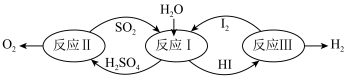
(1)已知:






反应I的热化学方程式:_______ 。
(2)反应I所得产物的溶液在碘过量时会自发分成两层。分离两层溶液的实验操作是_______ 。
(3)研究发现,通过电解方法实现反应I,既可减少碘的加入量,也可减少溶液后续纯化过程的能耗。写出通过电解法实现反应I时,阳极的电极反应式:_______ 。
(4)碘硫循环过程中反应I所制备出的HI浓度较低,必须对HI溶液进行浓缩。电解电渗析浓缩HI溶液的原理如下图所示,初始时阳极液和阴极液相同,溶液组成均为n(HI):n(H2O):n(I2)=1:6.8:2。
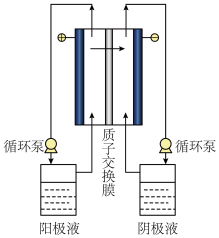
①电渗析过程中,阳极液中I2的浓度会_______ (填“增大”或“减小”)。
②结合化学用语,解释阴极区进行HI浓缩的原理_______ 。
(5)某科研小组采用双极膜电渗析法制备高浓度氢碘酸,工作原理如下图所示。

已知:双极膜在直流电场作用下可将水解离,在双极膜的两侧分别得到H+和OH-。
①X极是_______ (填“阳极”或“阴极”)。
②电解后,_______ 室获得较浓的氢碘酸(填“a”、“b”或“c”)。

(1)已知:






反应I的热化学方程式:
(2)反应I所得产物的溶液在碘过量时会自发分成两层。分离两层溶液的实验操作是
(3)研究发现,通过电解方法实现反应I,既可减少碘的加入量,也可减少溶液后续纯化过程的能耗。写出通过电解法实现反应I时,阳极的电极反应式:
(4)碘硫循环过程中反应I所制备出的HI浓度较低,必须对HI溶液进行浓缩。电解电渗析浓缩HI溶液的原理如下图所示,初始时阳极液和阴极液相同,溶液组成均为n(HI):n(H2O):n(I2)=1:6.8:2。

①电渗析过程中,阳极液中I2的浓度会
②结合化学用语,解释阴极区进行HI浓缩的原理
(5)某科研小组采用双极膜电渗析法制备高浓度氢碘酸,工作原理如下图所示。

已知:双极膜在直流电场作用下可将水解离,在双极膜的两侧分别得到H+和OH-。
①X极是
②电解后,
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下:2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
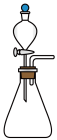
(1)如用下图I装置制取氨气,锥形瓶中可选择的试剂是_________________ 。
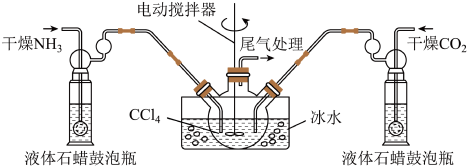
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。当悬浮物较多时,停止制备。
Ⅰ Ⅱ
注:CCl4与液体石蜡均为惰性介质。
①图I中滴加液体的仪器名称是_________ ,液体石蜡鼓泡瓶的作用是_____________ ,发生器用冰水冷却的原因是_________________ 。
②从反应后的混合物中分离出产品的实验方法是____________ (填写操作名称),为了得到干燥产品,应采取的方法是________ (填写选项序号)。
a.常压加热烘干 b.减压40℃以下烘干 c.高压加热烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸。
②根据①的结论:取氨基甲酸铵样品3.30g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97g。则样品中氨基甲酸铵的物质的量分数为_________ 。【Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr[(NH4)2CO3]=96、Mr(BaCO3)=197.(NH2COO)2Ba易溶于水】
 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0(1)如用下图I装置制取氨气,锥形瓶中可选择的试剂是
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。当悬浮物较多时,停止制备。


Ⅰ Ⅱ
注:CCl4与液体石蜡均为惰性介质。
①图I中滴加液体的仪器名称是
②从反应后的混合物中分离出产品的实验方法是
a.常压加热烘干 b.减压40℃以下烘干 c.高压加热烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解。 | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置。 | 溶液变浑浊,则证明固体中含有 |
| 步骤3:取步骤2的上层清液于试管中加入少量的 | 溶液不变浑浊,则证明固体中不含有 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】硝酸银是一种无色晶体,常用于照相、制镜、印刷、医药等。其水溶液和固体常被保存在棕色试剂瓶中,硝酸银不稳定,受热分解生成固体、NO2和O2。为了研究AgNO3的受热分解产物的性质,某同学设计了以下实验:实验所用的装置如图(图中加热、夹持仪器等均略去):

实验步骤为:a.仪器连接后,放入AgNO3固体之前,关闭k,微热硬质玻璃管A。
b.称取AgNO3固体1.7g置于A中,先通入一段时间N2,再关闭k,用酒精灯加热硬质玻璃管A。
c.待样品完全分解,A装置冷却至室温、称量,测得剩余园体的质量为1.08g。……
请回答下列问题:
(1)使用酒精灯对AgNO3固体加热的操作方法是________________________ 。
(2)步骤a的操作目的是_________________________________________ 。
(3)步骤b中先通入一段时间N2的操作目的是__________________________ 。
(4)装置C瓶中盛装的药品名称为___________ ,装置D中可观察到的实验现象为___________ 。
(5)设计实验证明AgNO3分解产物中气体的体积比_______________________ 。
(6)从实验安全角度考虑该实验装置有缺陷,应如何改进?_________________ 。

实验步骤为:a.仪器连接后,放入AgNO3固体之前,关闭k,微热硬质玻璃管A。
b.称取AgNO3固体1.7g置于A中,先通入一段时间N2,再关闭k,用酒精灯加热硬质玻璃管A。
c.待样品完全分解,A装置冷却至室温、称量,测得剩余园体的质量为1.08g。……
请回答下列问题:
(1)使用酒精灯对AgNO3固体加热的操作方法是
(2)步骤a的操作目的是
(3)步骤b中先通入一段时间N2的操作目的是
(4)装置C瓶中盛装的药品名称为
(5)设计实验证明AgNO3分解产物中气体的体积比
(6)从实验安全角度考虑该实验装置有缺陷,应如何改进?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】二氧化氯( )是一种优良的消毒剂,熔点为
)是一种优良的消毒剂,熔点为 ,沸点为
,沸点为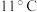 ,
,浓度过高时易发生分解 ,甚至爆炸 。某课外兴趣小组通过氯气与 溶液反应来制取少量
溶液反应来制取少量 ,装置如下图所示:
,装置如下图所示:
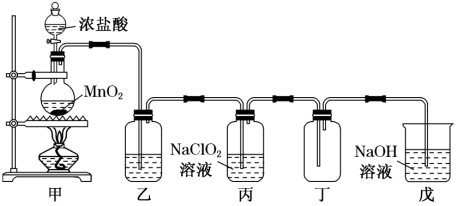
(1)甲装置中圆底烧瓶内发生反应的化学方程式是_______ 。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:①_______ (用化学方程式表示),② 。
。
(3) 存在时会催化
存在时会催化 的生成,若无乙装置,则丙装置内产生
的生成,若无乙装置,则丙装置内产生 的速率明显加快。乙装置中试剂瓶内的液体是
的速率明显加快。乙装置中试剂瓶内的液体是_______ 。戊装置的作用是_______ 。
(4)戊装置烧杯中 溶液吸收
溶液吸收 后,生成了
后,生成了 、
、 ,该反应的离子方程式是
,该反应的离子方程式是_______ 。
(5)向 和
和 溶液中缓慢通入
溶液中缓慢通入 恰好完全反应,测得反应后溶液中氯和碘的存在形式及物质的量分别为:
恰好完全反应,测得反应后溶液中氯和碘的存在形式及物质的量分别为:
则a为_______  ,原溶液中
,原溶液中 的物质的量为
的物质的量为_______  。
。
 )是一种优良的消毒剂,熔点为
)是一种优良的消毒剂,熔点为 ,沸点为
,沸点为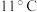 ,
, 溶液反应来制取少量
溶液反应来制取少量 ,装置如下图所示:
,装置如下图所示:
(1)甲装置中圆底烧瓶内发生反应的化学方程式是
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:①
 。
。(3)
 存在时会催化
存在时会催化 的生成,若无乙装置,则丙装置内产生
的生成,若无乙装置,则丙装置内产生 的速率明显加快。乙装置中试剂瓶内的液体是
的速率明显加快。乙装置中试剂瓶内的液体是(4)戊装置烧杯中
 溶液吸收
溶液吸收 后,生成了
后,生成了 、
、 ,该反应的离子方程式是
,该反应的离子方程式是(5)向
 和
和 溶液中缓慢通入
溶液中缓慢通入 恰好完全反应,测得反应后溶液中氯和碘的存在形式及物质的量分别为:
恰好完全反应,测得反应后溶液中氯和碘的存在形式及物质的量分别为:| 粒子 |  |  |  |
物质的量( ) ) | 0.28 | 0.04 | a |
 ,原溶液中
,原溶液中 的物质的量为
的物质的量为 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】利用 悬浊液吸收
悬浊液吸收 气体制取连二硫酸锰
气体制取连二硫酸锰 和硫酸锰
和硫酸锰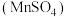 的装置(部分夹持、加热仪器已省略)如图所示。
的装置(部分夹持、加热仪器已省略)如图所示。
已知:ⅰ. 易溶于水,其在
易溶于水,其在 为2.8-3.5时最稳定,温度超过
为2.8-3.5时最稳定,温度超过 会快速分解生成易溶于水的
会快速分解生成易溶于水的 ;
;
ii.连二硫酸的结构简式为: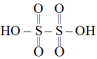

(1) 中S的化合价为
中S的化合价为_________ 。
(2)仪器a应装入的药品最好是_________。
(3)装置B的作用为_________ ,装置C中的化学方程式为_________ ,表明反应完成的现象是_________ 。装置D中水浴温度应控制在 左右,温度不能过高的原因是
左右,温度不能过高的原因是_________ 。
(4)测定 中锰的含量:准确称量产品质量,充分加热使之完全分解得到
中锰的含量:准确称量产品质量,充分加热使之完全分解得到 ,加适量水溶解,用
,加适量水溶解,用 标准溶液进行滴定(
标准溶液进行滴定( 元素均转化为
元素均转化为 ),即可计算出
),即可计算出 中锰的含量。滴定过程中发生反应的离子方程式为
中锰的含量。滴定过程中发生反应的离子方程式为_________ 。
 悬浊液吸收
悬浊液吸收 气体制取连二硫酸锰
气体制取连二硫酸锰 和硫酸锰
和硫酸锰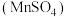 的装置(部分夹持、加热仪器已省略)如图所示。
的装置(部分夹持、加热仪器已省略)如图所示。已知:ⅰ.
 易溶于水,其在
易溶于水,其在 为2.8-3.5时最稳定,温度超过
为2.8-3.5时最稳定,温度超过 会快速分解生成易溶于水的
会快速分解生成易溶于水的 ;
;ii.连二硫酸的结构简式为:
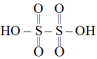

(1)
 中S的化合价为
中S的化合价为(2)仪器a应装入的药品最好是_________。
| A.70%的硫酸溶液 | B.稀盐酸 | C.稀硝酸 | D.浓硝酸 |
 左右,温度不能过高的原因是
左右,温度不能过高的原因是(4)测定
 中锰的含量:准确称量产品质量,充分加热使之完全分解得到
中锰的含量:准确称量产品质量,充分加热使之完全分解得到 ,加适量水溶解,用
,加适量水溶解,用 标准溶液进行滴定(
标准溶液进行滴定( 元素均转化为
元素均转化为 ),即可计算出
),即可计算出 中锰的含量。滴定过程中发生反应的离子方程式为
中锰的含量。滴定过程中发生反应的离子方程式为
您最近一年使用:0次



