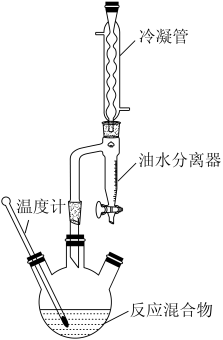
甲基丙烯酸甲酯是合成有机玻璃的单体。某小组拟在实验室制备甲基丙烯酸甲酯,装置如图所示(加热、搅拌装置省略)。
已知几种物质的物理性质如表所示。
在三颈瓶中依次加入甲醇、浓硫酸、甲基丙烯酸,加热至完全反应;提纯粗产品。
请回答下列问题:
(1)图中冷凝管的作用是_______ 。
(2)油水分离器中上层是_______ (填“水层”或“有机层”)。每隔一段时间,打开油水分离器,将下层物质放出来,提高原料转化率。
(3)三颈瓶中制备产品的化学方程式为_______ 。
(4)提纯产品的流程如图:

①饱和 溶液的作用是
溶液的作用是_______ (填字母)。
a.吸收甲醇
b.除去硫酸和甲基丙烯酸
c.促进产品分层
②选择如图装置完成操作X,得到纯产品时温度计指示温度为_______ 。

(5)验证甲基丙烯酸甲酯含碳碳双键。设计简单实验检验产品含有碳碳双键:取少量产品于试管,滴加少量酸性 溶液,振荡,若
溶液,振荡,若_______ (填现象),则说明产品含有碳碳双键。
(6)探究产品水解反应速率与酸碱性关系。实验结果如表所示:
实验测得 ,由此得出结论:在相同条件下,对于酯类水解反应,碱催化效率
,由此得出结论:在相同条件下,对于酯类水解反应,碱催化效率_______ (填“大于”“小于”或“等于”)酸。上述表格四组实验中,反应最快的是_______ (填实验序号)。

已知几种物质的物理性质如表所示。
| 物质 |  |  |  |
| 沸点/℃ | 163 | 64.8 | 100 |
密度/ | 1.05 | 0.791 | 0.943 |
| 水溶性 | 溶于水 | 与水互溶 | 微溶 |
请回答下列问题:
(1)图中冷凝管的作用是
(2)油水分离器中上层是
(3)三颈瓶中制备产品的化学方程式为
(4)提纯产品的流程如图:

①饱和
 溶液的作用是
溶液的作用是a.吸收甲醇
b.除去硫酸和甲基丙烯酸
c.促进产品分层
②选择如图装置完成操作X,得到纯产品时温度计指示温度为

(5)验证甲基丙烯酸甲酯含碳碳双键。设计简单实验检验产品含有碳碳双键:取少量产品于试管,滴加少量酸性
 溶液,振荡,若
溶液,振荡,若(6)探究产品水解反应速率与酸碱性关系。实验结果如表所示:
| 序号 | 样品 | 加入试剂/5mL | 温度/℃ | 油层消失的时间/min |
| Ⅰ | 2mL |  NaOH溶液 NaOH溶液 | 30 |  |
| Ⅱ | 2mL | 蒸馏水 | 30 |  |
| Ⅲ | 2mL |  稀硫酸 稀硫酸 | 30 |  |
| Ⅳ | 2mL |  NaOH溶液 NaOH溶液 | 45 |  |
 ,由此得出结论:在相同条件下,对于酯类水解反应,碱催化效率
,由此得出结论:在相同条件下,对于酯类水解反应,碱催化效率
更新时间:2022-05-22 17:15:12
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】氯化铵( )易溶于水,微溶于乙醇,是一种常见的化肥,也可用于制造干电池。25℃时,
)易溶于水,微溶于乙醇,是一种常见的化肥,也可用于制造干电池。25℃时, ,
,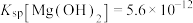 。
。
回答下列问题:
(1) 是侯氏制碱法的副产品,实验室用如图所示装置模拟侯氏制碱法。侯氏制碱法的原理为
是侯氏制碱法的副产品,实验室用如图所示装置模拟侯氏制碱法。侯氏制碱法的原理为 。
。
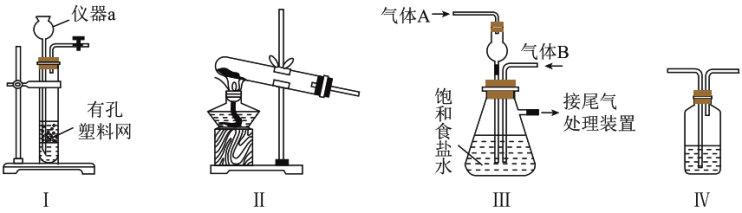
①仪器a的名称为___________ ;制取 可选择上图装置
可选择上图装置___________ (填“Ⅰ”或“Ⅱ”)。
②实验开始时,应先通气体___________ (填“A”或“B”)。
(2)某学习小组探究各因素对 水解程度的影响。设计实验方案如表所示(表中
水解程度的影响。设计实验方案如表所示(表中 浓度均为
浓度均为 ):
):
①实验1和2,探究浓度对 水解程度的影响,则a
水解程度的影响,则a___________ ;当A2与A1满足___________ 关系时,说明溶液浓度越小, 水解程度越大。
水解程度越大。
②有同学认为实验测得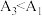 ,不能说明温度升高,促进了
,不能说明温度升高,促进了 水解,其理由为
水解,其理由为___________ 。
(3)将打磨过的镁条放入水中,无明显现象,但放入 溶液中,能观察到剧烈反应并产生较多的气泡。
溶液中,能观察到剧烈反应并产生较多的气泡。
①甲小组同学查阅资料得知,Mg与 难反应是因为Mg与水反应生成的
难反应是因为Mg与水反应生成的 ,覆盖在Mg表面阻碍Mg与
,覆盖在Mg表面阻碍Mg与 进一步反应,加入
进一步反应,加入 能发生反应:
能发生反应: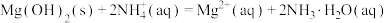 ,从而去除
,从而去除 。实验小组计算了该反应的
。实验小组计算了该反应的
___________ (保留3位有效数字),说明了反应能够进行(若 ,说明反应能够进行)。
,说明反应能够进行)。
②乙小组同学提出如下猜想:
猜想一:Mg可与 直接反应
直接反应
猜想二:Mg与 水解产生的
水解产生的 反应
反应
猜想三:Mg既与 直接反应同时与其水解产生的
直接反应同时与其水解产生的 反应
反应
设计了以下实验验证猜想,请帮助完成表格内容(已知: 微溶于乙醇)。
微溶于乙醇)。
实验发现实验Ⅱ、Ⅲ测定的pH变化和温度变化趋势基本一致,猜想一正确。
 )易溶于水,微溶于乙醇,是一种常见的化肥,也可用于制造干电池。25℃时,
)易溶于水,微溶于乙醇,是一种常见的化肥,也可用于制造干电池。25℃时, ,
,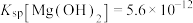 。
。回答下列问题:
(1)
 是侯氏制碱法的副产品,实验室用如图所示装置模拟侯氏制碱法。侯氏制碱法的原理为
是侯氏制碱法的副产品,实验室用如图所示装置模拟侯氏制碱法。侯氏制碱法的原理为 。
。
①仪器a的名称为
 可选择上图装置
可选择上图装置②实验开始时,应先通气体
(2)某学习小组探究各因素对
 水解程度的影响。设计实验方案如表所示(表中
水解程度的影响。设计实验方案如表所示(表中 浓度均为
浓度均为 ):
):| 序号 | 温度/℃ | 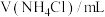 | 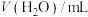 | pH |
| 1 | 25 | 40.0 | 0 | A1 |
| 2 | a | 4.0 | 36.0 | A2 |
| 3 | 85 | 40.0 | 0 | A3 |
 水解程度的影响,则a
水解程度的影响,则a 水解程度越大。
水解程度越大。②有同学认为实验测得
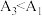 ,不能说明温度升高,促进了
,不能说明温度升高,促进了 水解,其理由为
水解,其理由为(3)将打磨过的镁条放入水中,无明显现象,但放入
 溶液中,能观察到剧烈反应并产生较多的气泡。
溶液中,能观察到剧烈反应并产生较多的气泡。①甲小组同学查阅资料得知,Mg与
 难反应是因为Mg与水反应生成的
难反应是因为Mg与水反应生成的 ,覆盖在Mg表面阻碍Mg与
,覆盖在Mg表面阻碍Mg与 进一步反应,加入
进一步反应,加入 能发生反应:
能发生反应: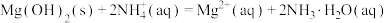 ,从而去除
,从而去除 。实验小组计算了该反应的
。实验小组计算了该反应的
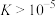 ,说明反应能够进行)。
,说明反应能够进行)。②乙小组同学提出如下猜想:
猜想一:Mg可与
 直接反应
直接反应猜想二:Mg与
 水解产生的
水解产生的 反应
反应猜想三:Mg既与
 直接反应同时与其水解产生的
直接反应同时与其水解产生的 反应
反应设计了以下实验验证猜想,请帮助完成表格内容(已知:
 微溶于乙醇)。
微溶于乙醇)。| 实验I | 将Mg粉加入乙醇中,发现无明显现象,再将Mg粉加入 |
| 实验Ⅱ | 取 的 的 溶液 溶液 置于烧杯中并连接传感器,加入镁粉,测定溶液的pH变化和温度变化 置于烧杯中并连接传感器,加入镁粉,测定溶液的pH变化和温度变化 |
| 实验Ⅲ | 取 的 的 溶液 溶液 置于烧杯中并连接传感器,加入少量 置于烧杯中并连接传感器,加入少量 |
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】氯化铜用途广泛,可用作媒染剂、氧化剂、木材防腐剂、食品添加剂、消毒剂等。某研究小组用粗铜(含杂质Fe)制备氯化铜晶体(CuCl2·xH2O),已知氯化铜易溶于水、乙醇。
Ⅰ.制备粗氯化铜
实验室采用如图所示装置,将粗铜与Cl2反应转化为固体粗氯化铜(部分加热和夹持装置已略去)。

(1)实验需要480 mL 10.00 mol·L-1浓盐酸,配制时除了需要用到量筒、烧杯、玻璃棒,还需要用到的玻璃仪器是___________ 。
(2)引发B中反应的操作是___________ 。
(3)有同学认为应在盛放浓硫酸的洗气瓶前增加吸收HCl的装置,你认为是否必要?___________ (填“是”或“否”),理由是___________ 。
(4)实验结束时,B和D处酒精灯应先熄灭的是___________ 。
(5)该装置存在缺陷,改进的措施为___________ 。
Ⅱ.氯化铜精制
将粗氯化铜溶解在足量盐酸中,加入双氧水,再加入物质A调节pH至4~5使溶液中Fe3+转化为Fe(OH)3沉淀, 过滤,滤液经过加热浓缩、冷却结晶、过滤、洗涤、干燥得到CuCl2·xH2O。
(6)物质A可选用下列试剂中的___________ (填序号)。
a.NaOH溶液 b.NH3·H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
(7)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:称取m g晶体溶于足量水中,加入足量氢氧化钠溶液,过滤、洗涤沉淀后用小火加热至质量不再减轻,冷却,称量所得黑色固体的质量为n g。洗涤沉淀的操作方法是___________ ,根据实验数据测得x=___________ (用含m、n的代数式表示)。
Ⅰ.制备粗氯化铜
实验室采用如图所示装置,将粗铜与Cl2反应转化为固体粗氯化铜(部分加热和夹持装置已略去)。

(1)实验需要480 mL 10.00 mol·L-1浓盐酸,配制时除了需要用到量筒、烧杯、玻璃棒,还需要用到的玻璃仪器是
(2)引发B中反应的操作是
(3)有同学认为应在盛放浓硫酸的洗气瓶前增加吸收HCl的装置,你认为是否必要?
(4)实验结束时,B和D处酒精灯应先熄灭的是
(5)该装置存在缺陷,改进的措施为
Ⅱ.氯化铜精制
将粗氯化铜溶解在足量盐酸中,加入双氧水,再加入物质A调节pH至4~5使溶液中Fe3+转化为Fe(OH)3沉淀, 过滤,滤液经过加热浓缩、冷却结晶、过滤、洗涤、干燥得到CuCl2·xH2O。
(6)物质A可选用下列试剂中的
a.NaOH溶液 b.NH3·H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
(7)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:称取m g晶体溶于足量水中,加入足量氢氧化钠溶液,过滤、洗涤沉淀后用小火加热至质量不再减轻,冷却,称量所得黑色固体的质量为n g。洗涤沉淀的操作方法是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐3】25℃,两种酸的电离平衡常数如下表。
(1)物质的量浓度均为0.1mol/L的四种溶液:a.CH3COONab.Na2CO3c.NaClOd.NaHCO3,pH由大到小的顺序为______ (用编号填写)。
(2)根据上表数据判断,下列离子方程式错误的是____ 。
A.CO2(过量)+H2O+ClO-=HCO +HClO
+HClO
B.SO2(过量)+H2O+ClO-=HSO +HClO
+HClO
C.CO2(少量)+H2O+CN-=HCO +HCN
+HCN
D.SO2(少量)+H2O+CN-=HSO +HCN
+HCN
E.SO2(少量)+2CO +H2O=SO
+H2O=SO +2HCO
+2HCO
F.2SO2(过量)+CO +H2O=2HSO
+H2O=2HSO +CO2↑
+CO2↑
(3)0.10mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为_____ 。
(4)25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=_____ (已知lg2=0.3,lg5=0.7)。
(5)25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中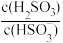 将
将_____ (填“增大”“减小”或“不变”)。
| 化学式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
| 电离常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
(1)物质的量浓度均为0.1mol/L的四种溶液:a.CH3COONab.Na2CO3c.NaClOd.NaHCO3,pH由大到小的顺序为
(2)根据上表数据判断,下列离子方程式错误的是
A.CO2(过量)+H2O+ClO-=HCO
 +HClO
+HClOB.SO2(过量)+H2O+ClO-=HSO
 +HClO
+HClOC.CO2(少量)+H2O+CN-=HCO
 +HCN
+HCND.SO2(少量)+H2O+CN-=HSO
 +HCN
+HCNE.SO2(少量)+2CO
 +H2O=SO
+H2O=SO +2HCO
+2HCO
F.2SO2(过量)+CO
 +H2O=2HSO
+H2O=2HSO +CO2↑
+CO2↑(3)0.10mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为
(4)25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=
(5)25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中
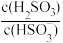 将
将
您最近一年使用:0次
解答题-有机推断题
|
较易
(0.85)
名校
解题方法
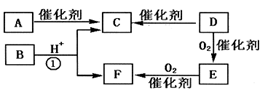
【推荐1】根据下面的反应路线及所给信息填空。
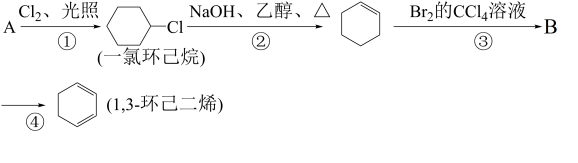
(1)A的结构简式是________ ,B分子中含有的官能团名称______ 。
(2)①的反应类型分别是___________ ,②的反应类型是________ 。
(3)反应③的化学方程式是__________ 。
(4)反应④的化学方程式是__________ 。

(1)A的结构简式是
(2)①的反应类型分别是
(3)反应③的化学方程式是
(4)反应④的化学方程式是
您最近一年使用:0次
解答题-有机推断题
|
较易
(0.85)
解题方法
【推荐2】如图表示4-溴环己烯所发生的4个不同反应。
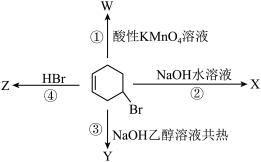
(1)X的结构简式_______ ,Z的结构简式_______
(2)反应②、③的反应类型分别为_______ 、_______
(3)反应②的化学方程式是_______
(4)反应④的化学方程式是_______

(1)X的结构简式
(2)反应②、③的反应类型分别为
(3)反应②的化学方程式是
(4)反应④的化学方程式是
您最近一年使用:0次
【推荐3】丁基橡胶可用于制造汽车内胎,合成丁基橡胶的一种单体A的分子式为C4H8,A与H2加成后得到2—甲基丙烷。完成下列填空:
(1)写出A的结构简式___________
(2)写出将A通入下列两种溶液后出现的现象。
A通入溴水___________ ,A通入溴的四氯化碳溶液___________
(3)写出分子式为C4H8的烯烃除A以外的同分异构体___________ 。
(4)A与某烷烃发生反应生成分子式为C8H18的物质B,B的一卤代物只有4种,且碳链不对称。写出B的结构简式___________
(1)写出A的结构简式
(2)写出将A通入下列两种溶液后出现的现象。
A通入溴水
(3)写出分子式为C4H8的烯烃除A以外的同分异构体
(4)A与某烷烃发生反应生成分子式为C8H18的物质B,B的一卤代物只有4种,且碳链不对称。写出B的结构简式
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】已知A的产量通常用来衡量一个国家的石油化工发展水平,B是饮食中常见的有机物,D和B的相对分子质量相同,E是一种有香味的物质,现以A为主要原料合成E,其合成路线如图所示。
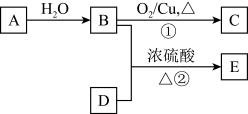
(1)A的结构简式是________________ 。
(2)B中官能团的名称是______________ ,由A生成B的反应类型是______________ 反应。由B生成C的反应类型是______________ 反应
(3)反应②的化学方程式是__________________________________ 。
(4)下列说法正确的是____________。

(1)A的结构简式是
(2)B中官能团的名称是
(3)反应②的化学方程式是
(4)下列说法正确的是____________。
| A.A、B、C均能发生加聚反应生成高分子化合物 |
| B.饱和Na2CO3溶液能鉴别B、D、E三种物质 |
| C.A能使溴水、酸性高锰酸钾溶液褪色,两者原理相同 |
| D.反应②中,浓硫酸用作催化剂和吸水剂 |
您最近一年使用:0次
解答题-有机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】已知有机物A、B、C、D、E、F、G有如图转化关系,其中C的产量可用来衡量一个国家石油化工发展水平,G的分子式为C9H10O2,试回答下列有关问题。

(1)C的电子式___ ,G的结构简式为____ 。
(2)指出下列反应的反应类型:A转化为B:___ ,C转化为D:___ 。
(3)B的同分异构体有很多种,遇FeCl3溶液显紫色的同分异构体共有__ 种。
(4)写出下列反应的化学方程式。
A→B的化学方程式:___ 。
B和F生成G的化学方程式:___ 。

(1)C的电子式
(2)指出下列反应的反应类型:A转化为B:
(3)B的同分异构体有很多种,遇FeCl3溶液显紫色的同分异构体共有
(4)写出下列反应的化学方程式。
A→B的化学方程式:
B和F生成G的化学方程式:
您最近一年使用:0次
解答题-有机推断题
|
较易
(0.85)
名校
【推荐3】化合物G是一种重要的有机合成中间体,由烃A和烃B合成G的路线如下(部分产物及条件已略去):
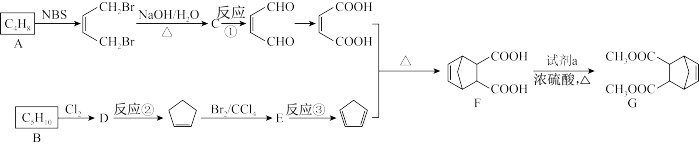
已知:①烃A的核磁共振氢谱显示有两组峰,烃B的核磁共振氢谱显示为单峰
②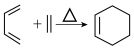
回答下列问题:
(1)烃A的名称为_______ ,C中含有的官能团名称为_______ 。
(2)B的结构简式为_______ 。
(3)试剂a的名称为_______ ,反应②的反应条件为_______ 。
(4)反应①的反应类型为_______ ,反应③的化学方程式为_______ 。
(5)F的同分异构体中,符合下列条件的有_______ 种。
①苯环上有三个取代基,其中两个取代基相同
②能与碳酸氢钠溶液反应
③能与FeCl3溶液发生显色反应
(6)请以乙烯和环己烯( )为原料制备
)为原料制备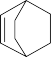 ,写出相应的合成路线
,写出相应的合成路线_______ 。(无机试剂任选,合成路线参照本题,反应条件不能省略)

已知:①烃A的核磁共振氢谱显示有两组峰,烃B的核磁共振氢谱显示为单峰
②
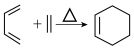
回答下列问题:
(1)烃A的名称为
(2)B的结构简式为
(3)试剂a的名称为
(4)反应①的反应类型为
(5)F的同分异构体中,符合下列条件的有
①苯环上有三个取代基,其中两个取代基相同
②能与碳酸氢钠溶液反应
③能与FeCl3溶液发生显色反应
(6)请以乙烯和环己烯(
 )为原料制备
)为原料制备 ,写出相应的合成路线
,写出相应的合成路线
您最近一年使用:0次
解答题-有机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】某有机物 A,由 C、H、O三种元素组成,在一定条件下,由 A可以转化为有机物 B、C 和 D、E;C又可以转化为 B、A。它们的转化关系如下:
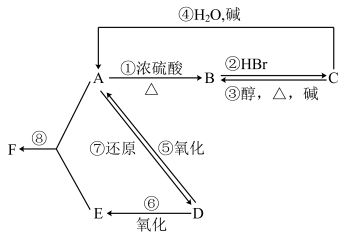
已知 D 的蒸气密度是氢气的 22 倍,并可以发生银镜反应。回答下列问题:
(1)D 的分子式是______________________
(2)F 的名称是_________________________
(3)在①②③④等反应中,属于消去反应的是________________________ 。
(4)在 A、B、C、D、E、F 中,能与酸性高锰酸钾溶液反应的是(填字母)________________________

已知 D 的蒸气密度是氢气的 22 倍,并可以发生银镜反应。回答下列问题:
(1)D 的分子式是
(2)F 的名称是
(3)在①②③④等反应中,属于消去反应的是
(4)在 A、B、C、D、E、F 中,能与酸性高锰酸钾溶液反应的是(填字母)
您最近一年使用:0次
解答题-有机推断题
|
较易
(0.85)
解题方法
【推荐2】某有机物A的分子式为C4H8O2,已知A~E有下列转化关系如下,试回答下列问题:
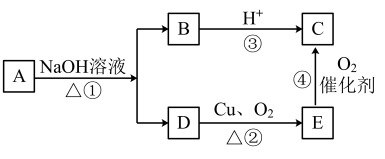
(1)C中的官能团名称是_______ ;
(2)E的结构简式是_______ 。
(3)在图中①~④的反应中,属于氧化反应的有________ 。
(4)写出反应②的化学方程式_______ 。

(1)C中的官能团名称是
(2)E的结构简式是
(3)在图中①~④的反应中,属于氧化反应的有
(4)写出反应②的化学方程式
您最近一年使用:0次