维生素C又称抗坏血酸,其化学式为 ,在有氧、光照的条件下易被氧化,维生素C含量的测定就是利用其较强的还原性,可以与具有氧化性的物质如,发生化学反应,把维生素C氧化生成去氢抗坏血酸。维生素C与碘单质的化学反应如下:
,在有氧、光照的条件下易被氧化,维生素C含量的测定就是利用其较强的还原性,可以与具有氧化性的物质如,发生化学反应,把维生素C氧化生成去氢抗坏血酸。维生素C与碘单质的化学反应如下: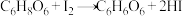 。
。
某实验小组准确量取稀释过的市售饮料 ,用已经标定的
,用已经标定的 的
的 溶液进行滴定,记录所用体积,平行滴定三次。消耗
溶液进行滴定,记录所用体积,平行滴定三次。消耗 溶液体积如下表所示:
溶液体积如下表所示:
回答下列问题:
(1)标准 溶液应装入
溶液应装入___________ (填“酸式”或“碱式”)滴定管,应选用___________ 作指示剂。
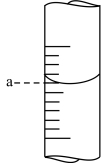
(2)如图表示某次放液后 滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积___________(填字母)。
滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积___________(填字母)。
(3)滴定终点的判断方法是___________ 。
(4)该市售饮料维生素C的浓度为___________ 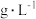 。
。
(5)其他操作均正确,下列操作会导致维生素C测定结果偏低的是___________ (填字母)。
A.锥形瓶中有少量水
B.盛装标准液的滴定管用蒸馏水清洗后未用标准液润洗
C.滴定结束时仰视刻度线读数
D.量取待测液的滴定管没有润洗
E.滴定后盛装标准液的滴定管中有气泡
 ,在有氧、光照的条件下易被氧化,维生素C含量的测定就是利用其较强的还原性,可以与具有氧化性的物质如,发生化学反应,把维生素C氧化生成去氢抗坏血酸。维生素C与碘单质的化学反应如下:
,在有氧、光照的条件下易被氧化,维生素C含量的测定就是利用其较强的还原性,可以与具有氧化性的物质如,发生化学反应,把维生素C氧化生成去氢抗坏血酸。维生素C与碘单质的化学反应如下: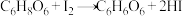 。
。某实验小组准确量取稀释过的市售饮料
 ,用已经标定的
,用已经标定的 的
的 溶液进行滴定,记录所用体积,平行滴定三次。消耗
溶液进行滴定,记录所用体积,平行滴定三次。消耗 溶液体积如下表所示:
溶液体积如下表所示:| 实验编号 | 待测溶液的体积( ) ) | 滴定前 溶液读数( 溶液读数( ) ) | 滴定后 溶液读数( 溶液读数( ) ) |
| 1 | 10.00 | 1.20 | 13.22 |
| 2 | 10.00 | 1.21 | 13.19 |
| 3 | 10.00 | 2.00 | 14.00 |
(1)标准
 溶液应装入
溶液应装入(2)如图表示某次放液后
 滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积___________(填字母)。
滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积___________(填字母)。
A. | B.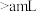 | C.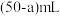 | D.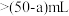 |
(4)该市售饮料维生素C的浓度为
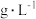 。
。(5)其他操作均正确,下列操作会导致维生素C测定结果偏低的是
A.锥形瓶中有少量水
B.盛装标准液的滴定管用蒸馏水清洗后未用标准液润洗
C.滴定结束时仰视刻度线读数
D.量取待测液的滴定管没有润洗
E.滴定后盛装标准液的滴定管中有气泡
更新时间:2022-07-19 08:13:59
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】二草酸合铜酸钾是一种重要的化工原料,微溶于冷水、酒精,可溶于热水。已知CuO+2KHC2O4=K2[Cu(C2O4)2]+H2O,实验室制备二草酸合铜酸钾晶体K2[Cu(C2O4)2]•2H2O可采用如下步骤:

(1)上述过程中“加热煮沸”的目的是____ ;配制草酸溶液时“微热”的原因是____ 。
(2)采用如图装置,经过一系列操作完成CuO的抽滤和洗涤,正确的操作顺序(洗涤操作只需考虑一次):开抽气泵→a→b→d→______→____→____→______→c→关抽气泵。____ 。

a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(3)制备KHC2O4和K2C2O4混合液时,K2CO3固体分批而不一次性加入的原因是___ 。
(4)“操作1”中需要将KHC2O4和K2C2O4的混合溶液加热至80-85℃,加入CuO,全部溶解后,趁热过滤。趁热过滤的原因是_____ 。
(5)将滤液用蒸汽浴加热浓缩,经“系列操作”后,干燥,得到二草酸合铜酸钾晶体。其中获得晶体时的“系列操作”应为____ 。
(6)产品纯度的测定:准确称取制得的晶体试样ag溶于氨水中,并加水定容至250mL,取试样溶液25.00mL,再加入10mL的稀硫酸,用bmol•L-1的KMnO4标准液滴定,消耗KMnO4标准液VmL。(2 +5
+5 +16H+=2Mn2++10CO2↑+8H2O)
+16H+=2Mn2++10CO2↑+8H2O)
①实验中KMnO4标准液应使用____ 滴定管(填“酸式”或“碱式”)。
②该产品的纯度为____ (用含字母的最简式表示)。

(1)上述过程中“加热煮沸”的目的是
(2)采用如图装置,经过一系列操作完成CuO的抽滤和洗涤,正确的操作顺序(洗涤操作只需考虑一次):开抽气泵→a→b→d→______→____→____→______→c→关抽气泵。

a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(3)制备KHC2O4和K2C2O4混合液时,K2CO3固体分批而不一次性加入的原因是
(4)“操作1”中需要将KHC2O4和K2C2O4的混合溶液加热至80-85℃,加入CuO,全部溶解后,趁热过滤。趁热过滤的原因是
(5)将滤液用蒸汽浴加热浓缩,经“系列操作”后,干燥,得到二草酸合铜酸钾晶体。其中获得晶体时的“系列操作”应为
(6)产品纯度的测定:准确称取制得的晶体试样ag溶于氨水中,并加水定容至250mL,取试样溶液25.00mL,再加入10mL的稀硫酸,用bmol•L-1的KMnO4标准液滴定,消耗KMnO4标准液VmL。(2
 +5
+5 +16H+=2Mn2++10CO2↑+8H2O)
+16H+=2Mn2++10CO2↑+8H2O)①实验中KMnO4标准液应使用
②该产品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某学生用已知物质的量浓度的NaOH标准溶液来测定未知物质的量浓度的盐酸,有关数据记录如表,回答下列问题。
(1)配制480mL0.2500mol∙L-1NaOH标准溶液。所需的玻璃仪器有:烧杯、量筒、玻璃棒、___________ 、___________ 等。
(2)实验室中有石蕊和酚酞两种指示剂,该实验应选用___________ 作指示剂。滴定终点的现象是___________ 。
(3)如图表示第二次滴定时50mL碱式滴定管中滴定前后液面的位置。该次滴定所用烧碱溶液体积为___________ mL。

(4)根据所给数据,计算出该盐酸的物质的量浓度,c(HCl)=___________ 。
(5)下列操作会引起测定结果偏大的是___________(填标号)。
| 滴定序号 | 待测液体积/mL | 所消耗烧碱标准液的体积/mL | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 25.00 | 0.50 | 25.12 | 24.62 |
| 2 | 25.00 | |||
| 3 | 25.00 | 5.00 | 29.58 | 24.58 |
(1)配制480mL0.2500mol∙L-1NaOH标准溶液。所需的玻璃仪器有:烧杯、量筒、玻璃棒、
(2)实验室中有石蕊和酚酞两种指示剂,该实验应选用
(3)如图表示第二次滴定时50mL碱式滴定管中滴定前后液面的位置。该次滴定所用烧碱溶液体积为

(4)根据所给数据,计算出该盐酸的物质的量浓度,c(HCl)=
(5)下列操作会引起测定结果偏大的是___________(填标号)。
| A.摇动锥形瓶时溶液溅出 | B.碱式滴定管滴定前管中有气泡,滴定后气泡消失 |
| C.锥形瓶未干燥有水 | D.滴定终点俯视 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】四氯化锡(SnCl4)是无色液体,熔点-36℃,沸点114℃,极易发生水解。实验室利用如图所示装置制备少量SnCl4(夹持装置略)。

(1)按照气流方向,装置的链接顺序依次为A→( ) →( ) →( ) →( ) →D。
(2)装置A中发生反应的离子方程式为______ 。导管a的作用为_________ 。
(3)试剂M的名称为_____ ;
(4)SnCl4遇水易水解生成SnO2xH2O,该水解反应的化学方程式为_____ 。
(5)①产品SnCl4中常混有SnCl2,利用反应Sn2+ + I2 =Sn4+ + 2 I-可测定产品的纯度。称取m g产品,用浓盐酸溶解并加水稀释后配成500mL溶液,取出25.00mL,加入作为指示剂,用c mol/L碘标准液进行滴定实验,当_____________ 即为终点。继续滴定,平行滴定3次,消耗标准液平均用量为V mL。则产品中SnCl4纯度为_____________ 〔用含c、V的代数式表示,M(SnCl2)=190〕。
②下列操作可能使测定结果偏低的是___________ 。
a 滴定前平视读数,滴定终点时仰视读数 b 装碘标准液的滴定管用蒸馏水洗净后未润洗
c 滴定尖嘴部分,滴定前有气泡,滴定后无气泡 d 滴定过程中锥形瓶内溶液洒出锥形瓶

(1)按照气流方向,装置的链接顺序依次为A→
(2)装置A中发生反应的离子方程式为
(3)试剂M的名称为
(4)SnCl4遇水易水解生成SnO2xH2O,该水解反应的化学方程式为
(5)①产品SnCl4中常混有SnCl2,利用反应Sn2+ + I2 =Sn4+ + 2 I-可测定产品的纯度。称取m g产品,用浓盐酸溶解并加水稀释后配成500mL溶液,取出25.00mL,加入作为指示剂,用c mol/L碘标准液进行滴定实验,当
②下列操作可能使测定结果偏低的是
a 滴定前平视读数,滴定终点时仰视读数 b 装碘标准液的滴定管用蒸馏水洗净后未润洗
c 滴定尖嘴部分,滴定前有气泡,滴定后无气泡 d 滴定过程中锥形瓶内溶液洒出锥形瓶
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】硒是人体所需微量元素之一,也是一种重要的工业原料。工业上在103℃的条件下,可用甲酸(HCOOH)还原含H2SeO3的工业废液提取硒。请回答下列问题:
(1)写出甲酸还原H2SeO3反应的化学方程式___________ 。
(2)常温下,H2SeO3电离平衡体系中含Se(+4价)微粒的物质的量分数与pH的关系如图所示。

向亚硒酸溶液滴入氨水至pH=2.5,过程中主要反应的离子方程式___________ 。
(3)还原时,进行了下述实验:向10mL2.5mol·L-1亚硒酸溶液中先加入10mL氨水,再加入10mL甲酸溶液(甲酸浓度分别为5、7.5及10mol·L-1),加热至沸腾(103℃),反应10小时,实验数据如图所示。

①曲线_____ (填曲线字母编号)对应甲酸浓度为10mol·L-1,判断的理由是________ 。
②当氨水浓度在0~1.25mol·L-1之间,随着氨水浓度逐渐增大,亚硒酸还原率逐渐升高,其可能的原因是______ 。
(4)Na2S2O3可以用于测定粗硒中硒的含量,操作步骤如下:
I.用浓H2SO4将样品中的Se氧化为SeO2;
II.用KI溶液还原SeO2为Se,同时生成I2;
III.以淀粉为指示剂,用Na2S2O3标准溶液滴定Ⅱ中生成的I2(I2+2S2O =2I-+S4O
=2I-+S4O )。实验中准确称量0.4000g粗硒样品,滴定中消耗0.8000mol·L-1的Na2S2O3溶液20.00mL。
)。实验中准确称量0.4000g粗硒样品,滴定中消耗0.8000mol·L-1的Na2S2O3溶液20.00mL。
①则粗硒样品中硒的质量分数为___________ 。
②下列操作中可能使样品中硒的含量偏高的是___________ 。
A.锥形瓶清洗干净后未干燥B.滴定前,滴定管内无气泡,滴定后有气泡
C.读数时,滴定前平视,滴定后俯视D.盛标准液的滴定管水洗后,直接装标准液
(1)写出甲酸还原H2SeO3反应的化学方程式
(2)常温下,H2SeO3电离平衡体系中含Se(+4价)微粒的物质的量分数与pH的关系如图所示。

向亚硒酸溶液滴入氨水至pH=2.5,过程中主要反应的离子方程式
(3)还原时,进行了下述实验:向10mL2.5mol·L-1亚硒酸溶液中先加入10mL氨水,再加入10mL甲酸溶液(甲酸浓度分别为5、7.5及10mol·L-1),加热至沸腾(103℃),反应10小时,实验数据如图所示。

①曲线
②当氨水浓度在0~1.25mol·L-1之间,随着氨水浓度逐渐增大,亚硒酸还原率逐渐升高,其可能的原因是
(4)Na2S2O3可以用于测定粗硒中硒的含量,操作步骤如下:
I.用浓H2SO4将样品中的Se氧化为SeO2;
II.用KI溶液还原SeO2为Se,同时生成I2;
III.以淀粉为指示剂,用Na2S2O3标准溶液滴定Ⅱ中生成的I2(I2+2S2O
 =2I-+S4O
=2I-+S4O )。实验中准确称量0.4000g粗硒样品,滴定中消耗0.8000mol·L-1的Na2S2O3溶液20.00mL。
)。实验中准确称量0.4000g粗硒样品,滴定中消耗0.8000mol·L-1的Na2S2O3溶液20.00mL。①则粗硒样品中硒的质量分数为
②下列操作中可能使样品中硒的含量偏高的是
A.锥形瓶清洗干净后未干燥B.滴定前,滴定管内无气泡,滴定后有气泡
C.读数时,滴定前平视,滴定后俯视D.盛标准液的滴定管水洗后,直接装标准液
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】我们在研究物质时,常常需要对物质进行定量分析。某兴趣小组用含少量杂质(杂质不与盐酸反应)的固体烧碱样品进行以下实验:
Ⅰ.用酸碱中和滴定法测定该烧碱样品的纯度。
将1.70g上述样品配制成200mL溶液,向锥形瓶中滴入20.00mL待测溶液,再向其中滴加2滴酚酞溶液,用 盐酸标准液滴定该待测溶液。
盐酸标准液滴定该待测溶液。
(1)滴定终点的判断方法是______ 。
(2)三次平行测定的数据如下表。分别计算出三次实验标准溶液的用量,针对该滴定数据,应采取的措施是______ 。
(3)结合表中数据计算,烧碱样品的纯度为______ (保留小数点后两位)。
(4)本实验中,如果滴定管用蒸馏水洗后未用盐酸标准液润洗,则测定结果______ (填“偏高”、“偏低”或“无影响”)。
Ⅱ.测定中和反应的反应热,其数值Q可通过量热装置测量反应前后体系温度变化,用公式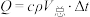 计算获得。
计算获得。
(5)取上述NaOH溶液和盐酸各50mL,用简易量热计进行实验,图中仪器a的名称为______ 。
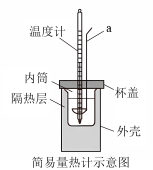
(6)该实验要测定盐酸的温度( )、NaOH溶液的温度(
)、NaOH溶液的温度( )和反应后体系的温度(
)和反应后体系的温度( ),反应前体系的温度t为
),反应前体系的温度t为______ (用 、
、 、
、 表示);该过程放出的热量为
表示);该过程放出的热量为______ J(c和ρ分别取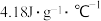 和
和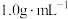 ,忽略水以外各物质吸收的热量)。
,忽略水以外各物质吸收的热量)。
(7)以上两个实验方案都出现了图标 和
和 ,前者提示实验中应开启排风扇,后者要求实验者
,前者提示实验中应开启排风扇,后者要求实验者______ (填防护措施)。
Ⅰ.用酸碱中和滴定法测定该烧碱样品的纯度。
将1.70g上述样品配制成200mL溶液,向锥形瓶中滴入20.00mL待测溶液,再向其中滴加2滴酚酞溶液,用
 盐酸标准液滴定该待测溶液。
盐酸标准液滴定该待测溶液。(1)滴定终点的判断方法是
(2)三次平行测定的数据如下表。分别计算出三次实验标准溶液的用量,针对该滴定数据,应采取的措施是
| 滴定序号 | 待测液体积(mL) | 消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.60 |
| 2 | 20.00 | 3.00 | 22.90 |
| 3 | 20.00 | 0.00 | 22.10 |
(3)结合表中数据计算,烧碱样品的纯度为
(4)本实验中,如果滴定管用蒸馏水洗后未用盐酸标准液润洗,则测定结果
Ⅱ.测定中和反应的反应热,其数值Q可通过量热装置测量反应前后体系温度变化,用公式
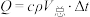 计算获得。
计算获得。(5)取上述NaOH溶液和盐酸各50mL,用简易量热计进行实验,图中仪器a的名称为

(6)该实验要测定盐酸的温度(
 )、NaOH溶液的温度(
)、NaOH溶液的温度( )和反应后体系的温度(
)和反应后体系的温度( ),反应前体系的温度t为
),反应前体系的温度t为 、
、 、
、 表示);该过程放出的热量为
表示);该过程放出的热量为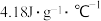 和
和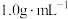 ,忽略水以外各物质吸收的热量)。
,忽略水以外各物质吸收的热量)。(7)以上两个实验方案都出现了图标
 和
和 ,前者提示实验中应开启排风扇,后者要求实验者
,前者提示实验中应开启排风扇,后者要求实验者
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】常温下,用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1CH3COOH溶液所得滴定曲线如图:
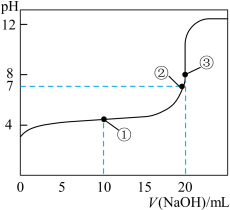
(1)在整个实验过程中,不需要的仪器是______ (填序号).
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
(2)点②所示溶液为中性:c(Na+)________ c(CH3COO-)(填“>”“<”或“=”)。
(3)盛装标准NaOH溶液选择图中滴定管_________ (填标号)。

(4)滴定时边滴边摇动锥形瓶,眼睛应注意观察____________ 。
(5)下列操作会导致测定结果偏低的是______ 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
Ⅰ、滴定终点的现象是_________________________________ 。
Ⅱ、计算:血液中含钙离子的浓度为______ mol/L。

(1)在整个实验过程中,不需要的仪器是
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
(2)点②所示溶液为中性:c(Na+)
(3)盛装标准NaOH溶液选择图中滴定管

(4)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(5)下列操作会导致测定结果偏低的是
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
Ⅰ、滴定终点的现象是
Ⅱ、计算:血液中含钙离子的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某FeSO4在空气中久置发生了部分变质,为测定该样品的纯度,进行如下分析:
(1)准确移取25.00 mL 0.05000 mol·L-1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5mL6 mol·L-1的H2SO4溶液,微热至60~70°C,用KMnO4溶液滴定,消耗27.75mL。写出滴定过程发生的反应的离子方程式_______ ;达到滴定终点的现象是_______ ;计算KMnO4溶液的浓度为_______ (保留2位有效数字)
(2)准确称取mg样品,放入锥形瓶中,加入25 mL蒸馏水和5mL6 mol·L-1的H2SO4溶液,微热至60~70°C,用上述KMnO4溶液滴定,消耗12.75 mL。则该样品中FeSO4的质量分数为_______ (用含m的式子表示)。
(3)测定样品纯度的过程中,下列操作会引起所测FeSO4的质量分数偏低的是_______ 。
A.称取mg样品放入锥形瓶中,加入25 mL蒸馏水溶解时搅拌时间过长
B.上述(2)步骤中,用KMnO4溶液滴定达终点读数时俯视
C.上述(2)步骤中,所用的锥形瓶不干燥
(1)准确移取25.00 mL 0.05000 mol·L-1的草酸钠水溶液,放入锥形瓶中,加入25 mL蒸馏水和5mL6 mol·L-1的H2SO4溶液,微热至60~70°C,用KMnO4溶液滴定,消耗27.75mL。写出滴定过程发生的反应的离子方程式
(2)准确称取mg样品,放入锥形瓶中,加入25 mL蒸馏水和5mL6 mol·L-1的H2SO4溶液,微热至60~70°C,用上述KMnO4溶液滴定,消耗12.75 mL。则该样品中FeSO4的质量分数为
(3)测定样品纯度的过程中,下列操作会引起所测FeSO4的质量分数偏低的是
A.称取mg样品放入锥形瓶中,加入25 mL蒸馏水溶解时搅拌时间过长
B.上述(2)步骤中,用KMnO4溶液滴定达终点读数时俯视
C.上述(2)步骤中,所用的锥形瓶不干燥
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】现使用酸碱中和滴定法测定市售白醋的总酸量(总酸量单位:g/100mL)
(1)准备与滴定
a.待测液的准备:将10 mL食用白醋稀释至100 mL,用___________ (填仪器名称)量取稀释后的溶液20.00 mL于锥形瓶中;
b.标准溶液的准备:用碱式滴定管盛装25.00 mL 0.1000 mol/L NaOH标准溶液;
c.滴定:向盛有白醋样品的锥形瓶中加入2滴酚酞作为指示剂,把锥形瓶放在碱式滴定管的下方,瓶下垫一张白纸,小心地滴入碱。边滴边摇动锥形瓶,直到___________ ,表示已经到达滴定终点。
d.重复上述操作三次。四次测定数据如表:
(2)数据处理与计算
①所消耗NaOH溶液的平均体积为___________ mL。
②计算得出白醋的总酸量为___________ g/100mL(精确到小数点后一位)。
③实验测定白醋的总酸量比理论值偏大,可能与下列操作有关的是___________ (填字母)。
A.用蒸馏水洗净碱式滴定管后,注入NaOH标准溶液进行滴定
B.用蒸馏水洗涤锥形瓶后装入一定体积的待测白醋进行滴定
C.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
D.使用碱式滴定管加液,读取体积时,开始平视读数,后来俯视读数
(3)曲线分析:以NaOH溶液的体积为横坐标,pH为纵坐标得到的滴定曲线如图所示。

①实验测得a点溶液的pH=2.8,则溶液中由水电离出来的c(OH-)=___________ 。
②当溶液pH=7时,c(CH3COO-)___________ c(Na+)(填“>”“<”或“=”)。
(1)准备与滴定
a.待测液的准备:将10 mL食用白醋稀释至100 mL,用
b.标准溶液的准备:用碱式滴定管盛装25.00 mL 0.1000 mol/L NaOH标准溶液;
c.滴定:向盛有白醋样品的锥形瓶中加入2滴酚酞作为指示剂,把锥形瓶放在碱式滴定管的下方,瓶下垫一张白纸,小心地滴入碱。边滴边摇动锥形瓶,直到
d.重复上述操作三次。四次测定数据如表:
| 序号 | 1 | 2 | 3 | 4 |
| 标准溶液体积/mL | 20.05 | 20.00 | 18.40 | 19.95 |
(2)数据处理与计算
①所消耗NaOH溶液的平均体积为
②计算得出白醋的总酸量为
③实验测定白醋的总酸量比理论值偏大,可能与下列操作有关的是
A.用蒸馏水洗净碱式滴定管后,注入NaOH标准溶液进行滴定
B.用蒸馏水洗涤锥形瓶后装入一定体积的待测白醋进行滴定
C.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
D.使用碱式滴定管加液,读取体积时,开始平视读数,后来俯视读数
(3)曲线分析:以NaOH溶液的体积为横坐标,pH为纵坐标得到的滴定曲线如图所示。

①实验测得a点溶液的pH=2.8,则溶液中由水电离出来的c(OH-)=
②当溶液pH=7时,c(CH3COO-)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】I、某学生欲用已知物质的量浓度的盐酸来测定未知物质的最浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白。
(1)用标准的盐酸溶液滴定待测的氯氧化钠溶液时,标准的盐酸溶液应该装在______ (填仪器名称)中;滴定达到终点的现象为:______ 。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是______ (填序号)。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)某学生根据三次实验分别记录有关数据如表:
请选用数据计算该氢氧化钠溶液的物质的量浓度: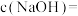
______ mol/L(保留小数点后4位)
Ⅱ、某学习小组用“间接碘量法”测定含有晶体的试样(不含能与厂发生反应的氧化性杂质)的纯度。过程如下:取0.36 g试样溶于水,加过量KI固体,充分反应,生成白色沉淀 。用0.1000 mol/L
。用0.1000 mol/L  标准溶液滴定,到达滴定终点时,消耗
标准溶液滴定,到达滴定终点时,消耗 标准溶液20.00 mL。
标准溶液20.00 mL。
已知:① ②
②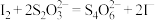
(4)选用______ 作滴定指示剂,试样中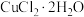 的质量分数为
的质量分数为______ 。(保留小数点后一位)
(1)用标准的盐酸溶液滴定待测的氯氧化钠溶液时,标准的盐酸溶液应该装在
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)某学生根据三次实验分别记录有关数据如表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
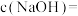
Ⅱ、某学习小组用“间接碘量法”测定含有晶体的试样(不含能与厂发生反应的氧化性杂质)的纯度。过程如下:取0.36 g试样溶于水,加过量KI固体,充分反应,生成白色沉淀
 。用0.1000 mol/L
。用0.1000 mol/L  标准溶液滴定,到达滴定终点时,消耗
标准溶液滴定,到达滴定终点时,消耗 标准溶液20.00 mL。
标准溶液20.00 mL。已知:①
 ②
②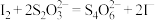
(4)选用
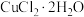 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:
CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl
据此,某学生设计了下列实验.
【制备NaClO溶液】实验装置如下图左图所示(部分夹持装置已省略)
已知:3NaClO 2NaCl+NaClO3
2NaCl+NaClO3
(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有_______ (填字母)。
A. 容量瓶 B. 烧杯 C. 移液管 D. 玻璃棒
(2)装置I中发生的离子反应方程式是_______ ;Ⅱ中玻璃管a的作用为_______ ;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是_______ ;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的_______
【制取水合肼】实验装置如上图右图所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2 H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式_______ ;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品,B装置的名称是_______
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol.L-1 的I2溶液滴定。
已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为_______ ;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为_______ 。
CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl
据此,某学生设计了下列实验.
【制备NaClO溶液】实验装置如下图左图所示(部分夹持装置已省略)
已知:3NaClO
 2NaCl+NaClO3
2NaCl+NaClO3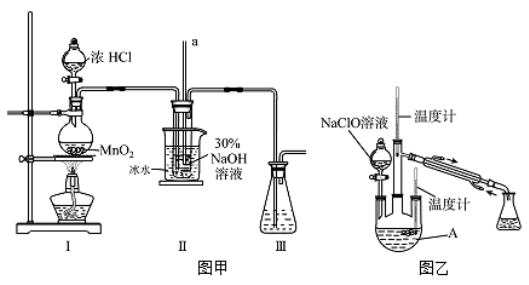
(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有
A. 容量瓶 B. 烧杯 C. 移液管 D. 玻璃棒
(2)装置I中发生的离子反应方程式是
【制取水合肼】实验装置如上图右图所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2 H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol.L-1 的I2溶液滴定。
已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某小组欲研究烷烃的某些性质设计下图实验装置。回答下列问题:
向如图的B中通入一定量的氯气和甲烷气体,混合均匀后通入C中硬质玻璃管中,夹紧两个弹簧夹,用光照射硬质玻璃管。
(1)B装置有三种功能:①均匀混合气体;②干燥混合气体;③___________ 。
(2)写出装置C中 与
与 反应生成氯仿的化学方程式
反应生成氯仿的化学方程式___________ 。
(3)一段时间后,C中玻璃管内的实验现象:___________ 、___________ 。
(4)若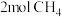 与
与 发生取代反应,测得生成4种有机取代产物的物质的量相等,则产物中最多的物质的物质的量是
发生取代反应,测得生成4种有机取代产物的物质的量相等,则产物中最多的物质的物质的量是___________ mol。
Ⅱ.某烃可以发生氧化反应
将 的某烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。
的某烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。
(5)试写出该烃结构简式___________ 。
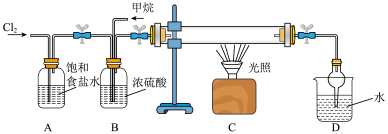
向如图的B中通入一定量的氯气和甲烷气体,混合均匀后通入C中硬质玻璃管中,夹紧两个弹簧夹,用光照射硬质玻璃管。
(1)B装置有三种功能:①均匀混合气体;②干燥混合气体;③
(2)写出装置C中
 与
与 反应生成氯仿的化学方程式
反应生成氯仿的化学方程式(3)一段时间后,C中玻璃管内的实验现象:
(4)若
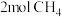 与
与 发生取代反应,测得生成4种有机取代产物的物质的量相等,则产物中最多的物质的物质的量是
发生取代反应,测得生成4种有机取代产物的物质的量相等,则产物中最多的物质的物质的量是Ⅱ.某烃可以发生氧化反应
将
 的某烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。
的某烃在足量氧气中充分燃烧,并使产生的气体全部通入下图装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。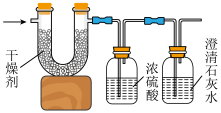
| 实验前 | 实验后 | |
| 实验前实验后(干燥剂+U形管)的质量 | 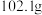 | 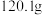 |
| (石灰水+广口瓶)的质量 |  | 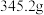 |
(5)试写出该烃结构简式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题。
Ⅰ.钠是一种非常活泼、具有广泛应用的金属。请回答:
(1)将一小块金属钠投入水中,可观察到的实验现象是有:钠浮在水面,熔成小球,四处游动,有嘶嘶声,若滴加酚酞,溶液变红,写出发生反应的化学方程式___________ 。
(2)用金属钠制取氧化钠通常利用 ,而不是钠与氧气的反应,是因为产物中只有
,而不是钠与氧气的反应,是因为产物中只有 固体生成,且
固体生成,且___________ 。
Ⅱ.现有含有 杂质的
杂质的 样品,用如图所示实验装置测定
样品,用如图所示实验装置测定 样品的纯度。(可供选用的反应物有
样品的纯度。(可供选用的反应物有 固体、盐酸、稀硫酸和蒸馏水)
固体、盐酸、稀硫酸和蒸馏水)

(3)装置 中反应的化学方程式是
中反应的化学方程式是___________ 。
(4)装置 中碱石灰的作用是
中碱石灰的作用是___________ 。
(5)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后中液面的读数并求其差值的过程中,需要待恢复室温后,___________ ,且视线与凹液面最低处相平才能读数。
(6)若开始时测得样品的质量为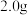 ,反应结束后测得气体体积(折合为标准状况)为
,反应结束后测得气体体积(折合为标准状况)为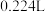 ,则
,则 试样的纯度为
试样的纯度为___________ 。
Ⅰ.钠是一种非常活泼、具有广泛应用的金属。请回答:
(1)将一小块金属钠投入水中,可观察到的实验现象是有:钠浮在水面,熔成小球,四处游动,有嘶嘶声,若滴加酚酞,溶液变红,写出发生反应的化学方程式
(2)用金属钠制取氧化钠通常利用
 ,而不是钠与氧气的反应,是因为产物中只有
,而不是钠与氧气的反应,是因为产物中只有 固体生成,且
固体生成,且Ⅱ.现有含有
 杂质的
杂质的 样品,用如图所示实验装置测定
样品,用如图所示实验装置测定 样品的纯度。(可供选用的反应物有
样品的纯度。(可供选用的反应物有 固体、盐酸、稀硫酸和蒸馏水)
固体、盐酸、稀硫酸和蒸馏水)
(3)装置
 中反应的化学方程式是
中反应的化学方程式是(4)装置
 中碱石灰的作用是
中碱石灰的作用是(5)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后中液面的读数并求其差值的过程中,需要待恢复室温后,
(6)若开始时测得样品的质量为
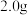 ,反应结束后测得气体体积(折合为标准状况)为
,反应结束后测得气体体积(折合为标准状况)为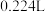 ,则
,则 试样的纯度为
试样的纯度为
您最近一年使用:0次



